肺炎克雷伯菌碳青霉烯酶研究进展*
李凤妍,严茹钰,曹小利
(南京大学医学院附属鼓楼医院检验科,南京210008)
碳青霉烯类抗生素具有抗菌谱广、抗菌活性强、低毒性等特点,临床常用于治疗产超广谱β-内酰胺酶肠杆菌科细菌所引起的严重感染[1]。该类药物作用于细菌细胞膜上的青霉素结合蛋白(penicillin-binding protein, BPS),抑制胞壁粘肽合成酶,阻碍细胞壁粘肽合成,使细菌胞壁缺损,菌体渗透压改变并溶解,从而杀灭细菌。近年来,由于临床上碳青霉烯类抗生素的广泛使用,碳青霉烯耐药的肠杆菌(Carbapenem-resistantEnterobacteriaceae,CRE)不断出现。碳青霉烯酶的产生是肠杆菌科细菌对碳青霉烯耐药的主要原因,其中,肺炎克雷伯菌碳青霉烯酶(Klebsiellapneumoniaecarbapenemases, KPC)是全球流行最广泛的碳青霉烯酶[2]。
1 KPC的主要特征
1.1KPC酶的结构特征 KPC型碳青霉烯酶属于Ambler分子分类法的A类酶,在Bush功能分类法中为2f组。blaKPC长度约为882 bp,平均由294个氨基酸组成,结构较保守,第70位丝氨酸(S70)为酶活性中心,周围有4段保守的氨基酸序列,分别是α3-与α4-螺旋之间的环区(L102至S106)、Ω环(R164至D179)、β3-和β4-折叠之间的环区(C238至T243)以及β5-与α11-螺旋之间的环区(A267至S275),具有活性位点SXXK、SDN和KTG[2]。其中,Ω环位于KPC活性位点周围,与环外的许多残基相互作用,是维持蛋白质结构的基础,而Glu166和Asn170是对β-内酰胺脱酰基必需的氨基酸残基。Tooke等[3]研究发现,可变的Ω环结构能赋予KPC-2对β-内酰胺类抗生素的广谱水解活性,Ω环易发生突变,介导KPC耐药性的变化。
1.2KPC的流行特征
1.2.1KPC变异体的地域分布 自KPC酶分离以来,产KPC酶的肠杆菌科细菌在美国不断被发现,2006年以来,KPC酶在全球快速播散,并产生多种变异体。截止2023年6月,在数据库Beta-Lactamase DataBase(BLDB, http://www.bldb.eu/BLDB.php?prot=A#KPC)中列出了164种KPC酶的变异体。值得注意的是,它们虽然都是KPC酶,但并不都具有碳青霉烯水解活性,有些则属于超广谱β-内酰胺酶(ESBLs,表1)。不同地区间KPC亚型分布有一定的差异,KPC-2和KPC-3是其他KPC变异体的主要来源。一项全球CRE的监测报告中显示,KPC-2是亚太地区、拉丁美洲和北美洲最常见的KPC酶型,而欧洲、中东和非洲主要的流行亚型是KPC-2和KPC-3[4]。
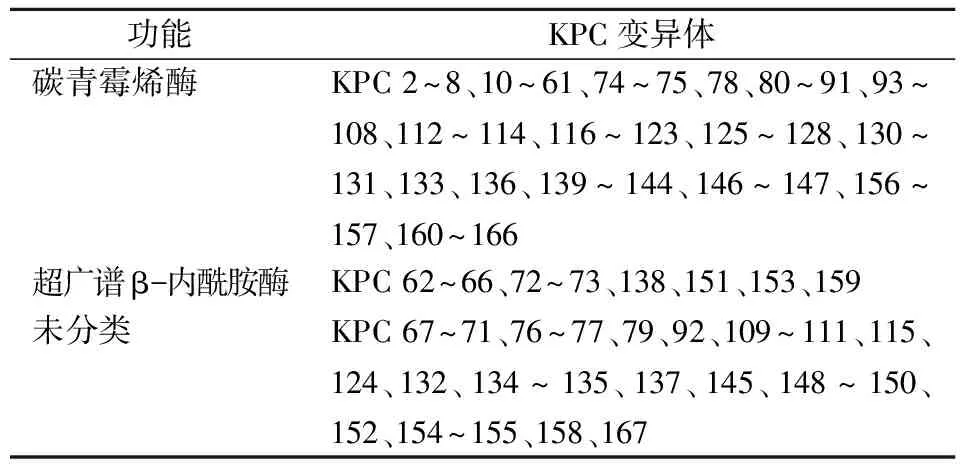
表1 164种 KPC变异体的功能分类
1.2.2KPC菌种分布 KPC最常流行于肺炎克雷伯菌中,通过质粒等移动元件可在不同菌种间传播,目前不仅在产酸克雷伯菌、大肠埃希菌、粘质沙雷菌、弗劳地枸橼酸杆菌、阴沟肠杆菌、奇异变形杆菌和摩根菌等肠杆菌科细菌中发现KPC;其也存在于铜绿假单胞菌和鲍曼不动杆菌等非发酵性革兰氏阴性杆菌中[2]。
1.2.3KPC人群分布 医院中产KPC革兰阴性杆菌主要引起患者呼吸道感染、菌血症和尿路感染。痰液、血液和尿液标本中分离得到KPC阳性菌的概率较高。患者常为免疫力低下人群,通常使用过碳青霉烯类药物或长时间使用多种抗生素;接受过侵入性操作如深静脉插管、气管切开术、留置导尿管或入住ICU及手术科室[5]。KPC定植是医院感染发生的危险因素与先决条件,CRE肠道定植率与感染率呈正相关[6]。故而加强环境监测,规范医疗器械及废弃物管理,做好消毒工作和手部卫生,减少不必要的侵入性操作,对于预防院内感染至关重要。
1.3KPC酶的耐药特征
1.3.1泛耐药/全耐药特征 通常单产KPC酶的临床分离株很少见,大部分产KPC菌株常伴有其他多种抗生素耐药基因的检出,或合并其他耐药机制,如外排泵的过表达或外膜孔蛋白的缺失,往往表现为泛耐药(extensively drug resistant, XDR)或全耐药(pan-drug resistant, PDR)的耐药特征[7]。在这些共存的耐药基因中,blaSHV、blaCTX-M、blaTEM往往比较常见;此外,氨基糖苷类耐药基因、质粒介导的喹诺酮耐药基因、磷霉素耐药基因fosA等常被报道;氯霉素、四环素以及磺胺类药物相关的耐药基因则少有报道,它们常位于同一质粒或整合在同一可移动遗传元件上传播。Xu等[8]报道了1株产KPC酶的PDR肺炎克雷伯菌,该菌不仅携带了7种抗生素耐药基因,染色体上mgrB和rpsJ基因突变还导致了粘菌素和替加环素的耐药。临床上,这种泛耐药/全耐药菌株的不断增加往往导致临床抗菌药物治疗失败,患者病程迁延,死亡风险增高。
1.3.2KPC变异体的突变介导对头孢他啶/阿维巴坦的耐药 头孢他啶/阿维巴坦(ceftazidime/avibactam, CAZ/AVI)是治疗产KPC酶肠杆菌感染的有效抗生素之一,随着该药的临床应用,CAZ/AVI耐药的产酶株不断出现,主要与KPC变异体的出现有关。目前,国内外已报道了多种CAZ/AVI耐药的KPC变异体[2],主要是由于KPC酶活性中心区域发生的某些氨基酸替换、插入或缺失后,导致了酶对头孢他啶的催化活性增强或者阿维巴坦对酶的抑制减弱,进而导致产酶菌株对CAZ/AVI产生耐药性。突变主要集中于3个区域:Ω环区域(氨基酸164~179位)、β链区域(氨基酸234~242位)以及临近Ω环区域(氨基酸263~277位)[2]。其中,Ω环区域突变占比最多,D179Y是Ω环中最常发生的突变,介导了KPC-33和KPC-31对CAZ/AVI较高的耐药性,同时恢复对碳青霉烯类抗生素的敏感性,这可能与突变使R164与D179之间的静电引力和氢键作用减弱,Ω环结构松散有关[9]。Ω环外的某些突变则同时介导碳青霉烯类抗生素及CAZ/AVI的耐药。
其次,一些野生型KPC分离株可能由于blaKPC基因的相对拷贝数量和表达量较高,外排泵高表达或合并外膜孔蛋白OmpK35或OmpK36缺失以及PBPs的突变产生了对CAZ/AVI的抗性[10]。Shen等[11]将214株产KPC酶的肺炎克雷伯菌根据CAZ/AVI的最小抑菌浓度(minimal inhibitory concentration, MIC)分为高、中、低3组,发现高值组对头孢他啶的亲和力及blaKPC基因的表达和拷贝量明显高于中值组和低值组;而聚丙烯酰胺凝胶电泳显示所有MIC值≥1 mg/L菌株的OmpK35蛋白编码基因携带提前终止的移码突变或者反向调控基因micF和ompR过度表达。相反,在MIC值≤0.5 mg/L的分离株中均能观察到OmpK35和OmpK36条带。产酶株对CAZ/AVI的耐药性可能是在抗生素压力下选择产生的,或预先存在于人群中[10]。虽然CAZ/AVI对产KPC菌株有较好的疗效,但实际用药时仍需谨慎,检测CAZ/AVI的MIC值对合理用药有重要意义。
2 KPC的播散机制
2.1垂直播散机制 KPC酶主要流行于肺炎克雷伯菌,对产酶菌株的遗传相关性分析显示,KPC酶在全球范围内的传播与肺炎克雷伯菌的一些主要克隆或克隆复合群的流行有关。虽然产KPC酶的肺炎克雷伯菌存在多种序列型(sequence type, ST),但目前在全球大范围播散的ST型主要为CC258克隆复合群,CC258包含四十余种ST型,其中最常见的ST型为ST258、ST11、ST512、ST340、ST437和ST833[12]。ST258主要在北美、拉丁美洲、欧洲流行。ST258型菌株特异性的蛋白质与细菌的运动、分泌以及DNA修复与修饰密切相关,可能是ST258菌株成为流行菌株的基础要素[12]。值得注意的是,ST11和ST258亲缘关系很近,二者仅有1个管家基因(tonB)的差别,但ST258在我国的检出率很低,ST11则是亚洲地区尤其是我国的主要克隆型,这可能是因为ST11可携带多种毒力基因并耐受体液免疫,有利于菌株局部定植、形成生物膜、对抗免疫细胞吞噬作用,从而成为主要的流行菌株[13]。也有研究报道,ST11和ST258菌株均携带ICEKp258.1中的Ⅳ型分泌系统(type Ⅳ secretion system, T4SS),可以促进质粒等可移动元件的传播,促使CC258成为主要的克隆复合群[13]。ST512是ST258的1个单基因座变体,近年报道较多,常携带blaKPC-3,可引起医院感染的暴发流行[14]。近年产KPC酶的大肠埃希菌ST131是一种多重耐药的高危克隆,具有在各种生态环境中持续存在和定植的能力,并能抵抗粘菌素,成为KPC酶在全球扩散的另一个主体菌株,值得引起重视[15]。
2.2水平播散机制
2.2.1质粒介导的播散blaKPC主要位于多种不同大小的接合性质粒上,一般为20~200 kb,质粒的多样性可能是由于在抗生素压力下,发生了各种移动元件的重组或插入事件,加快了耐药基因的传播进程[16]。目前,携带blaKPC基因的质粒有IncF、IncN、Inc A/C、IncX、IncI、IncL/M、IncR、IncH、IncP,其中IncF型质粒最常见,其次为IncA/C、IncX[17]。pKpQIL是第一个在ST258中发现的编码blaKPC的IncF型质粒,也是blaKPC在北美、欧洲和中东传播的重要载体。ST11携带的IncFⅡ型质粒介导了blaKPC在中国的传播[18]。另有研究表明,某些流行克隆中限制性修饰 (restriction and modification,RM)系统和CRISPR-Cas系统的缺乏是blaKPC-IncF质粒在其间传播的潜在因素之一[7,19]。而耐药质粒与毒力质粒的融合,导致了耐碳青霉烯高毒力肺炎克雷伯菌出现,严重威胁患者生命。通过积极寻找质粒中关键的分子标记,可以实现对高危菌株的追踪和控制[20]。
2.2.2转座子(Transposon,Tn)介导的播散 Tn是可以在基因组上自由移动,并插入其中的DNA序列。质粒介导的碳青霉烯酶类抗生素耐药,主要通过转座子Tn4401实现。Tn4401序列两侧有5 bp的靶位复制序列,可以携带blaKPC非特异性地插入到不同质粒的开放读码框中,是欧美地区携带blaKPC最常见的基因元件[21]。其结构组成包括blaKPC-2基因、转座酶基因(tnpA)、解离酶基因(tnpR)以及ISKpn6和ISKpn7插入序列。Tn4401大小为10 kb,属于Tn3转座子家族,现已有多种异构体被发现,其中Tn4401a和Tn4401b分布最广[22]。
非Tn4401元件(NTE)中也发现了blaKPC基因。第一个NTE于2007年在中国被报道,以Tn3整合子为基础,各基因的顺序为Tn3转座酶、Tn3解离酶、ISKpn8、blaKPC-2基因、类ISKpn6插入序列,与国外Tn4401转座子差异明显[23]。之后在阿根廷、哥伦比亚、智利和巴西等国家也有了不同结构NTE的报道[24]。中国流行的ST11型肺炎克雷伯菌携带的blaKPC-2基因大部分在非Tn4401元件上发现,尤其以NTEKPC-Ⅰ和NTEKPC-Ⅱ为主,我国产KPC酶的肠杆菌所携带的blaKPC基因环境十分相似,复合转座子Tn3-Tn4401和转座子Tn1721最常被报道[22,25]。
2.2.3插入序列(insertion sequence, IS)和整合子介导的播散 IS是最简单的转座子,它不含有任何与转位功能无关的基因,可独立存在,也可构成了Tn的两臂。在细菌染色体和质粒中存在多种IS或多个拷贝的IS,可介导blaKPC复制转座及水平传播,从而增加细菌耐药性。Li等[26]发现了质粒pKPC-J5501中blaKPC-2的双拷贝且证实两侧序列是IS26,2个拷贝的IS26可形成复合转座子,该转座子可以从质粒中切下并转移,参与了blaKPC-2的传播和扩增。双拷贝的blaKPC-2可能是IS26同源重组介导的,blaKPC高表达使该菌株耐药性增强。转座子中的插入序列影响了启动子活性和表达水平,Mmatli等[27]报道IS26在ardK中的插入使亚胺培南酶的表达增加了53倍。因此,插入序列和启动子对细菌耐药性的影响也不容忽视。
整合子是可移动的DNA分子,通过捕获外源耐药基因并稳定表达,以提高细菌对周围环境改变的耐受性。blaKPC常位于整合子可变区,它的传播与Ⅰ、Ⅱ类整合子密切相关[28]。
3 KPC检测方法
碳青霉烯酶的检测与分型对于临床感染控制和精准用药十分重要,目前碳青霉烯酶检测方法分为表型检测和基因型检测。表型检测主要包括Carba NP试验、改良碳青霉烯灭活试验(包括mCIM和eCIM)、碳青霉烯酶抑制剂增强试验(APB/EDTA)。这类检测方法只能对碳青霉烯酶初步筛查并不能确定待测酶的基因型;针对KPC酶的特异性基因检测方法主要包括NG-test Carba5胶体金免疫层析技术或利用荧光定量PCR技术研发的一些试剂盒如Filmarray血流感染或肺炎检测试剂盒、GeneXpert Carba-R、Verigene革兰阴性菌血培养鉴定试剂盒,这类方法快速、高效,但需要特殊的试剂和设备检测特异性靶基因,若待测基因与目标基因不同,会呈假阴性结果。KPC突变体往往具有不同的药敏特性,一些菌株表现为低水平的碳青霉烯类抗生素耐药,甚至敏感,造成临床检出困难,Ding等[29]评估了mCIM和eCIM、APB/EDTA、NG-test Carba 5、 GeneXpert Carba-R 4种方法对6种CAZ/AVI耐药的blaKPC-2变异体的检测效果,结果表明,使用mCIM和eCIM、APB/EDTA都无法检出blaKPC-2变体,而使用NG-test Carba 5时,少部分变异体可检出KPC阳性,假阴性率高,GeneXpert Carba-R可以检测到所有blaKPC-2变体,这项研究提示临床实验室对blaKPC-2变异体的检测要注意选择合适的方法。目前,还有许多方法也在不断优化和探索中,有科研团队利用亚胺培南/雷巴坦改良Carba NP试验检测肠杆菌中的A类碳青霉烯酶,改良后检测时间大幅缩短,操作亦十分简单,但对KPC变异体的检测性能未经验证[30]。Huang等[31]提出针对ST11型产KPC-2酶肺炎克雷伯菌的特征峰4 521 m/z用MALDI-TOF MS的方法可以进行早期快速检测。总之,不同方法有各自的优缺点,这些检测方法往往对CAZ/AVI耐药的KPC变异体检出率低,实验室应当根据自身实际情况选择合适的检测方法,并可根据自己的检测目的对常规方法进行适当改进。
4 小结与展望
KPC是全球分布最广的碳青霉烯酶,通过携带多种抗性基因的质粒和可移动元件扩散到不同细菌中,导致泛耐药/全耐药的超级细菌不断出现。CAZ/AVI是治疗产酶菌的最优选择,但近年出现了多种耐药突变体,探索其中的耐药机制对合理用药十分重要。常规碳青霉烯酶检测方法对这种KPC突变体易漏检,且只能确定表型,难以区分出具体的基因型,医务工作者应不断探索新方法,并将其应用于临床检测。长远来看,应尽量延缓耐药性的出现,针对感染的高危因素,采取严格的感染控制措施,并根据患者病情,感染部位,细菌种类以及药敏结果,抗菌药物的临床应用指征,制订合理的治疗方案,才能取得疗效并控制产KPC酶细菌的播散。

