多重数字PCR平台检测cfDNA突变在NSCLC患者中的应用评估*
周小匀,彭颖斐,周琰,陈馨宁,潘柏申,王蓓丽,郭玮
(复旦大学附属中山医院检验科,上海 200032)
肺癌是世界范围内最常见、死亡率最高的癌症之一,其中非小细胞肺癌(non-small-cell lung cancer, NSCLC)约占85%[1],超过70%的患者在确诊时已处于晚期[2],手术切除可能性小,临床预后差。上皮生长因子受体(epidermal growth factor receptor,EGFR)是亚裔NSCLC人群中常见的驱动基因,临床使用上皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKIs)进行靶向治疗能显著提高患者的无进展生存率和总生存率[3-4]。多数患者使用EGFR-TKIs治疗后会发生获得性耐药,有学者推荐检测外周血循环肿瘤DNA(circulating tumor DNA,ctDNA)中EGFR基因突变状态[5],据此及时调整治疗方案[6]。
目前用于检测外周血EGFR基因突变的常用方法包括超级扩增阻滞突变系统(super amplification refractory mutation system, Super-ARMS)、下一代测序(next-generation sequencing, NGS)和数字PCR(digital PCR,dPCR)等。其中,dPCR快速、灵敏度高、成本较低,便于临床推广。本研究旨在建立并评价一种新的多重dPCR检测平台检测NSCLC患者血浆游离DNA(circulating cell-free DNA,cfDNA)标本中EGFR基因突变情况,为其进一步的临床应用提供数据支持,以期帮助患者进行靶向用药筛选以及动态监测疗效。
1 材料与方法
1.1研究对象 收集2019年6月至2020年11月于复旦大学附属中山医院呼吸科就诊的49例NSCLC患者,男13例,女35例,年龄(65.4±11.2)岁。所有患者均根据其病理组织学检测结果确诊为NSCLC,且均有Super-ARMS法(由检验科提供)检测结果。纳入标准:(1)病理组织学明确诊断,病理分期参考美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)发布的非小细胞肺癌诊断标准[5];(2)年龄≥18岁;(3)未行抗贫血及任何抗肿瘤治疗。排除标准:(1)小细胞肺癌患者;(2)合并其他恶性肿瘤,严重心血管、肝、肾功能不全的患者;(3)接受EGFR-TKIs治疗患者;(4)临床病理资料缺失或失访患者。本研究获得复旦大学附属中山医院伦理委员会审核批准(批准文号:B2019-255R),所有研究对象均知情同意。
1.2主要仪器与试剂 Naica微滴芯片式数字PCR系统及Naica Geode热循环仪(法国Stilla Technologies公司),Qubit 3.0荧光定量仪(美国Thermo Fisher公司),安捷伦Agilent 2100 生物分析仪(美国Agilent公司),荧光定量PCR仪(瑞士Roche公司)。游离核酸提取试剂盒(德国Qiagen公司),QubitTM双链DNA高灵敏度荧光定量试剂盒(美国Ivitrogen公司),人类EGFR突变基因检测试剂盒(厦门艾德生物医药科技股份有限公司),人类EGFR基因突变检测试剂盒(数字PCR法),定制的EGFRL858R、19Del和T790M突变质粒(苏州艾普拜生物科技有限公司),EGFR基因多重参考品HD802(gDNA,美国Horizon公司)。
1.3方法
1.3.1性能验证
1.3.1.1检测精密度(批内精密度和批间精密度) 将L858R、19Del、T790M突变型质粒分别用野生型样本稀释,配制高(10%)、中(5%)、低(1%)3个丰度的标准品,每种突变类型的3个丰度重复检测3次,计算标准差(standard debiation,SD)与变异系数(coefficient of variation,CV)[7],以CV<15%为达到厂商声明,验证通过。
1.3.1.2检测灵敏度(检测限) 依据检测系统的预估检测限,将L858R、19Del、T790M突变型质粒分别用野生型样本稀释,配制检测限以上(0.5%)、预估检测限(0.1%)、检测限以下(0.05%)的标准质粒,每种突变类型的每个丰度重复检测10次,对检测限及以上的标准质粒均检出为验证通过。
1.3.1.3空白限 在2个独立试验中对空白样本(纯水)进行20次重复检测,最终将空白限设置为重复测试空白样本时可测得的最高突变浓度。
1.3.1.4检测线性 将定制已知等位基因携带突变L858R、19Del、T790M突变质粒与野生型样本按照以下比例混合得到梯度突变比例样本:L1(10%)、L2(1%)、L3(0.5%)、L4(0.1%)与L5(0.05%)。对各样本进行3次重复检测,计算均值并得到线性关系,分析实际检测结果与预期值的相关性以确认检测线性。
1.3.2临床评估 将本次实验结果与用于血浆EGFR检测的Super-ARMS法检测结果对比,计算方法符合率,包括阳性符合率、阴性符合率和总符合率(阳性符合率=两方法均阳性结果数/参比方法阳性结果数×100%;阴性符合率=两方法均阴性结果数/参比方法阴性结果数×100%;总符合率=两方法一致结果数/总结果数×100%),并使用Pearson卡方检验比较两种方法所得结果的差异。
1.4EGFR突变检测 采用分离胶型真空管在患者接受治疗前采集20 mL乙二胺四乙酸二钾(EDTA-K2)抗凝全血,2~8 ℃、10 000×g离心10 min,吸取上层血浆置于1.5 mL尖底离心管中,再以20 000×g离心10 min,分离血浆于2 mL圆底离心管中。取9 mL血浆,按照游离核酸提取试剂盒说明书操作抽提cfDNA。按照QubitTM双链DNA高灵敏度荧光定量试剂盒说明书定量检测cfDNA浓度及混合测序(pooling)文库DNA浓度,要求文库DNA浓度>0.5 ng/μL。使用Agilent 2100生物分析仪对cfDNA和文库DNA进行片段长度分析,要求临床样本cfDNA在160~180 bp处有典型的峰,且在3 000 bp处无基因组DNA污染峰,pooling文库DNA在600~1 300 bp处有典型的峰[8]。
使用Naica微滴芯片式数字PCR系统(蓝宝石芯片)及人类EGFR基因突变检测试剂盒(数字PCR法)检测EGFR突变。每个试管中加入25 μL反应混合物,包括dPCR Mix1和dPCR Mix2(分别为5 μL和1.5 μL)、引物和探针的多重混合物1 μL、无核酸酶水7.5 μL以及待测样本10 μL(不足10 μL时用无核酸酶水补足体积)。另设立空白对照品(纯水)、阳性对照品。将芯片装入Naica Geode热循环仪,以分隔液滴并进行PCR反应。PCR循环参数:95 ℃ 5 min;95 ℃ 20 s,60 ℃ 30 s,共45个循环。使用Naica Prism3阅读器对蓝宝石芯片进行成像。依据泊松分布原理,使用Crystal Miner软件(法国Stilla Technologies公司)根据公式NDual=N×(1-e-λc1)×(1-e-λc2)[9]分析dPCR的原始数据。
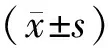
2 结果
2.1性能验证
2.1.1检测精密度 精密度试验结果见表1。新平台对于3种突变百分比在高、中、低3个丰度(10%、5%和1%)的CV均小于15%,检测精密度高,达到厂商声明标准。

表1 精密度试验结果
2.1.2检测灵敏度与空白限 灵敏度试验结果见表2。新平台对于3种常见突变位点的高于、等于及低于预估检测限的检测结果均成功报告阳性,初步认为新平台对于此3种突变的检测灵敏度极高。根据实际检测结果和空白限计算公式:LoB=Meanblank+1.645×SDblank,可得L858R、19Del、T790M的检测空白限分别为0.038 2、0.000和0.053。
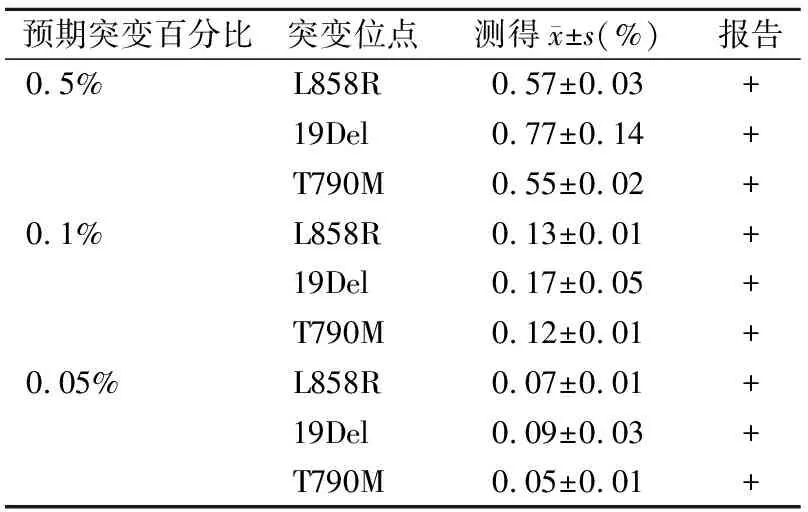
表2 灵敏度试验结果
2.1.3检测线性 线性试验结果见图1。T790M、19Del、L858R突变百分比在0.05%~10%(0.05%、0.1%、0.5%、1%、10%)时,实测值与预期百分比的线性回归方程分别为:Y=0.974X+0.002(R2=0.997 7,P<0.01)、Y=0.915 6X+0.184(R2=0.995 4,P<0.01)、Y=0.917X+0.019(R2=0.998 4,P<0.01),五点回归线斜率接近1,相关性显著。

注:A,T790M线性图,X轴为期望突变丰度Log值,Y轴为实测突变丰度Log值;B,外显子19Del线性图,X轴为期望突变丰度Log值,Y轴为实测突变丰度Log值;C,L858R线性图,X轴为期望突变丰度Log值,Y轴为实测突变丰度Log值。
2.2临床评估结果 分别使用dPCR平台和Super-ARMS平台检测49例临床标本的EGFR基因突变情况,两种方法的结果比对见图2。

图2 dPCR法与Super-ARMS法检测临床标本结果
两种方法的符合率如表3所示,基于多重dPCR的新平台与Super-ARMS检测S768I、G719X、19Del、T790M、20ins、L858R突变的方法总符合率分别为100%、100%、100%、97.96%、93.62%和89.80%。两种方法对突变位点的检测结果进行卡方检验,P均>0.05(表4),dPCR新平台的检测结果与Super-ARMS法检测结果差异无统计学意义。
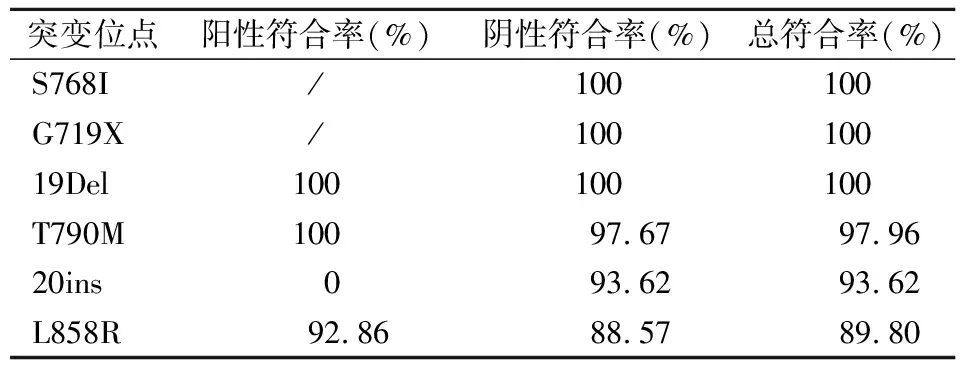
表3 49例临床样本的dPCR法与Super-ARMS法检测方法符合率

表4 Pearson卡方检验结果
3 讨论
研究表明,携带EGFR基因敏感突变的NSCLC患者使用EGFE-TKIs治疗后可有效改善其预后[4-5]。外周血中的ctDNA因其取材安全无创与不易受肿瘤异质性影响,在实施动态监测NSCLC晚期患者中具有较大优势,但其丰度极低且高度片段化,易受高浓度野生型血浆游离DNA的干扰,需要灵敏度极高的方法才能对血浆EGFR基因突变进行检测。
本研究评估的多重dPCR平台在检测精密度、灵敏度、空白限及线性的性能验证结果良好,能够满足临床检测需求。与同类检测平台相比,Wang等[10]使用微滴式dPCR QX200TM系统检测ctDNA的检测限达0.02%;刘晓蕾[11]构建了基于TaqMan-MGB双探针荧光定量PCR技术的微流控芯片数字PCR检测体系用于检测外周血EGFR基因突变,在104copies/μL内呈现良好的线性关系,灵敏度可达0.01%~0.001%。本研究的多重dPCR平台检测性能与上述同类平台性能基本相当。此外,构建的多重dPCR新平台还具备加样量少,能同时检出39种EGFR位点突变等优点,其中新增加的C797S位点是最新报道的EGFE-TKIs治疗后关键突变[12]。
多重dPCR新平台结合组织病理结果、影像学结果能为NSCLC患者靶向药物治疗效果提供全面的评估依据。本研究发现多例突变丰度极低的cfDNAEGFR突变标本,拷贝数在10-3数量级。这些标本用dPCR新平台检测结果为阳性,但是可能受限于Super-ARMS方法检测灵敏度低而被漏检。已有研究表明EGFR的突变丰度与治疗反应等关联密切[13],多重dPCR新平台能够利用血浆中DNA丰度较低的优势使其检测结果更加准确,可以辅助靶向治疗。本研究的不足之处在于临床评估样本例数较少,且由于时间与样本资源比较紧张,未对患者进行长期随访研究,与之相匹配的病理结果等临床资料欠缺。
在未来的研究中,EGFR、ALK、ROS1基因和其他癌基因的评估有望在同一dPCR平台上得以简化整合,并有望获取到临床信息更全面、留有组织活检结果、包含罕见突变的样本进行深入分析研究。尽管NGS可以并行分析多种突变,包括未知突变,但dPCR因其灵敏度高、结果易解读、检测时间较短、成本较低仍然是临床检测中合适的方法。本研究初步表明dPCR平台具有良好的检测性能和成本效益,能够很好地辅助NSCLC患者的临床诊断和靶向治疗。

