外泌体通过HMGB1抑制骨关节炎软骨细胞凋亡和炎症
蒋智荣,沈鹏程,朱立帆,杨 峰,汪晚怡
(1苏州市第九人民医院骨科,苏州 215200;2苏州市第九人民医院关节骨科;*通讯作者,E-mail:shenpengchen_1980@163.com)
骨关节炎(osteoarthritis,OA)是一种关节软骨的慢性退行性疾病,常伴有关节疼痛和功能障碍。随着人口老龄化和肥胖患病率的增加,OA的发病率呈上升趋势[1]。迄今为止,OA的发病机制仍不清楚,缺乏有效的策略来减缓、预防甚至逆转中老年人群的疼痛和残疾进程。因此,研究OA的分子机制至关重要。既往研究表明,许多炎症介质参与OA的进展,尤其是关节内白细胞介素(interleukin,IL-1β)的增加及其受体IL-1R之间的相互作用,在OA的发病机制中起重要作用[2]。此外,OA患者软骨细胞的退变和凋亡与关节破坏相关,在OA的发展中起着至关重要的作用[3,4]。关于外泌体在OA发病机制中的作用已有多项报道[5,6]。外泌体由多种细胞、组织和滑膜成纤维细胞释放。滑膜成纤维细胞中的外泌体可将微小RNA(microRNA,miRNA)和炎症蛋白转运到组织中,是滑膜成纤维细胞和软骨细胞介导的关节局部炎症的重要调节因子。有研究表明,高迁移率族蛋白B1(high mobility group box 1,HMGB1)参与了OA患者骨和软骨的破坏,并在OA的发病机制中起关键作用[7]。在IL-1β处理的OA组织和软骨细胞中,HMGB1水平升高。过表达miR-140-5p通过下调HMGB1可抑制IL-1β诱导的软骨细胞的凋亡和炎症[8]。然而关节滑液中的外泌体是否通过分泌HMGB1参与OA的发生发展尚不清楚。在本研究中,我们探讨了滑膜成纤维细胞来源的外泌体HMGB1对OA软骨细胞进展的影响,主要聚集在HMGB1对OA软骨细胞的增殖、凋亡和炎症反应等方面的作用。
1 材料与方法
1.1 材料
软骨细胞系HC-A细胞购自上海通派生物科技有限公司;PrimeScript RT试剂盒购自上海金畔生物科技有限公司;SYBR Green试剂盒购自上海俊晟生物科技有限公司;BCA蛋白浓度测定试剂盒购自武汉博士德生物工程有限公司;HMGB1、CD63及CD81一抗抗体均购自英国Abcam公司;膜联蛋白Ⅴ-异硫氰酸荧光素(Annexin Ⅴ-FITC)/碘化丙锭(PI)细胞凋亡检测试剂盒购自上海雅吉生物科技有限公司。紫外分光光度计购自上海元析仪器有限公司;流式细胞仪购自美国BD公司。
1.2 方法
1.2.1 滑膜成纤维细胞分离和培养 滑膜组织来源于我院接受治疗的骨关节患者,患者均已签署知情同意书。本研究经苏州市第九人民医院伦理审查委员会批准通过(批准号:SZJY2023058)。将来自骨关节炎患者的滑膜组织分别用0.25%胰蛋白酶和0.02% EDTA处理1 h,然后切成0.5~1 mm3的小块,在室温条件下用0.2%胶原酶Ⅱ处理4 h。在成纤维细胞解离后,离心5 min,收集细胞,将细胞悬浮于含10%胎牛血清的DMEM培养基中,在5% CO2的潮湿条件下孵育,将滑膜成纤维细胞培养至融合率达到80%,用于后续实验。
1.2.2 HMGB1沉默滑膜成纤维细胞株的构建 将滑膜成纤维细胞按5×104个细胞/孔接种至6孔板中培养,待细胞生长至融合度达30%时,将HMGB1沉默的慢病毒感染细胞,感染根据厂商说明书进行处理。在感染48 h后,去除病毒,采用2 μg/ml嘌呤霉素筛选稳转细胞株。
1.2.3 滑膜成纤维细胞外泌体的分离与鉴定 将获得的HMGB1沉默稳转滑膜成纤维细胞以2×105个/孔的密度接种于6孔板,加入不含外泌体的血清继续培养48 h,收集细胞上清液(cell组)。然后,根据ExoQuick-TC试剂盒的说明从上清液中提取外泌体(Exo组),在磷酸盐缓冲液(PBS)中重悬。通过Western blotting检测外泌体特异性标志物CD63及CD81蛋白的表达。
1.2.4 滑膜成纤维细胞来源的外泌体与软骨细胞共培养 将软骨细胞系HC-A细胞以5×104/孔的密度接种到含有10%胎牛血清的DMEM中的24孔板中,并培养24 h,待软骨细胞融合至约60%,将软骨细胞HC-A分为空白对照组、IL-1β组、IL-1β+Exo组、IL-1β+Exo+NC-siRNA组、IL-1β+Exo+HMGB1-siRNA组。空白对照组不作处理;IL-1β组软骨细胞使用100 pg/ml IL-1β进行干预;IL-1β+Exo组在IL-1β组的基础上中使用50 μg/ml未进行病毒转染的滑膜成纤维细胞来源的外泌体干预;IL-1β+Exo+NC-siRNA组在IL-1β组的基础上使用转染NC-siRNA的滑膜成纤维细胞来源外泌体干预;IL-1β+Exo+HMGB1-siRNA组在IL-1β组的基础上使用转染HMGB1-siRNA的滑膜成纤维细胞来源外泌体干预。孵育24 h后,从软骨细胞中提取总RNA和蛋白用于后续实验。
1.2.5 实时定量PCR实验检测IL-6、TNF-α、MMP-1、MMP-13、COL2A1 mRNA的表达水平 采用Trizol提取软骨细胞总RNA。然后使用紫外分光光度计测定260 nm/280 nm的吸光度比值计算RNA的浓度和纯度。用PrimeScript RT试剂盒将1 μg总RNA逆转录合成cDNA。然后使用SYBR Green试剂盒与real-time PCR系统进行qRT-PCR反应。引物序列见表1。以GAPDH作为标准化对照,使用2-ΔΔCt方法用于评估目的基因的相对表达量。分别检测空白对照组、IL-1β组和IL-1β+Exo组IL-6、TNF-α、MMP-1、MMP-13、COL2A1 mRNA,以及IL-1β组、IL-1β+Exo组、IL-1β+Exo+NC-siRNA组和IL-1β+Exo+HMGB1-siRNA组MMP-1、MMP-13、COL2A1 mRNA的表达水平。

表1 引物序列
1.2.6 Western blotting法检测外泌体HMGB1、CD63及CD81蛋白的表达 为鉴定滑膜成纤维细胞来源的外泌体,通过Western blotting实验检测滑膜成纤维细胞提取物中外泌体标志物蛋白HMGB1、CD63及CD81的表达。使用RIPA裂解缓冲液和磷酸蛋白酶抑制剂裂解外泌体,收集蛋白样品,之后使用BCA法进行蛋白浓度定量。然后使用12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,随后转移到聚偏二氟乙烯(PVDF)膜上。将PVDF膜采用5%的脱脂牛奶阻断后,在4 ℃下与抗HMGB1、CD63及CD81单克隆抗体(1∶1 000)孵育过夜。然后在辣根过氧化物酶结合的二抗中孵育。用化学发光蛋白印迹检测系统检测蛋白条带,将获得的蛋白条带采用Image J软件进行定量,分析目的蛋白的表达。
1.2.7 CCK-8实验检测细胞增殖能力 分别收集IL-1β组、IL-1β+Exo组、IL-1β+Exo+NC-siRNA组和IL-1β+Exo+HMGB1-siRNA组共培养后的HC-A细胞(5×103/孔)添加至96孔板中,分别在0,24,48,72 h每孔加入10 μl CCK-8溶液,在细胞培养箱中孵育2 h,之后使用微孔板读数器评估450 nm处的吸光度值。实验独立重复3次。
1.2.8 流式细胞术检测细胞凋亡 采用膜联蛋白Ⅴ-异硫氰酸荧光素(Annexin Ⅴ-FITC)/碘化丙锭(PI)细胞凋亡检测试剂盒检测IL-1β组、IL-1β+Exo组、IL-1β+Exo+NC-siRNA组和IL-1β+Exo+HMGB1-siRNA组软骨细胞凋亡情况。将2×105个/ml细胞在500g下离心5 min,重新悬浮于195 μl结合缓冲液中,随后加入5 μl Annexin Ⅴ-FITC和10 μl PI避光孵育5 min,最后使用流式细胞仪上机检测细胞凋亡率。实验独立重复3次。
1.2.9 统计学分析 采用SPSS 20.0软件进行统计学分析。所有实验均独立重复3次。数据以均数±标准差进行表示。采用Student’st检验或单因素方差分析进行数据分析。当P<0.05时,差异有统计学意义。
2 结果
2.1 滑膜成纤维细胞来源的外泌体中HMGB1蛋白的表达
Western blotting结果显示,与cell组比较,Exo组外泌体标志物CD63、CD81以及HMGB1蛋白表达显著升高(P<0.05,见图1),提示滑膜成纤维细胞来源的外泌体鉴定成功。
2.2 滑膜成纤维细胞来源的外泌体对软骨细胞增殖和凋亡的影响
CCK-8实验和流式细胞术结果显示,与空白对照组比较,IL-1β组软骨细胞增殖能力显著降低,细胞凋亡率显著升高(均P<0.05);与IL-1β组比较,IL-1β+Exo组软骨细胞增殖能力显著升高,细胞凋亡率显著降低(均P<0.05,见图2)。

A.CCK-8检测软骨细胞增殖能力B.流式细胞术检测细胞凋亡
2.3 滑膜成纤维细胞来源的外泌体对软骨细胞炎症反应的影响
实时定量PCR实验结果显示,与空白对照组比较,IL-1β组软骨细胞中IL-6、TNF-α mRNA水平均显著升高(P<0.05);与IL-1β组比较,IL-1β+Exo组软骨细胞中IL-6、TNF-α mRNA水平均显著降低(P<0.05,见图3)。
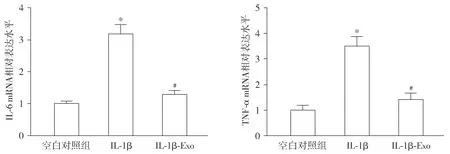
与空白对照组比较,*P<0.05;与IL-1β组比较,#P<0.05
2.4 滑膜成纤维细胞来源的外泌体对软骨降解的影响
实时定量PCR实验结果显示,与空白对照组比较,IL-1β组软骨细胞中MMP-1、MMP-13 mRNA表达水平均显著升高,COL2A1 mRNA表达水平显著降低(均P<0.05);与IL-1β组比较,IL-1β+Exo组软骨细胞中MMP-1、MMP-13 mRNA表达水平均显著降低,COL2A1 mRNA表达水平显著升高(均P<0.05,见图4)。

与空白对照组比较,*P<0.05;与IL-1β组比较,#P<0.05
2.5 滑膜成纤维细胞来源的外泌体HMGB1对软骨细胞增殖、凋亡和炎症的影响
实验结果显示,与IL-1β+Exo+NC-siRNA组比较,IL-1β+Exo+HMGB1-siRNA组软骨细胞中HMGB1蛋白水平显著降低,细胞增殖能力显著降低,细胞凋亡率显著升高,IL-6、TNF-α mRNA水平均显著升高,差异均有统计学意义(P<0.05,见图5)。
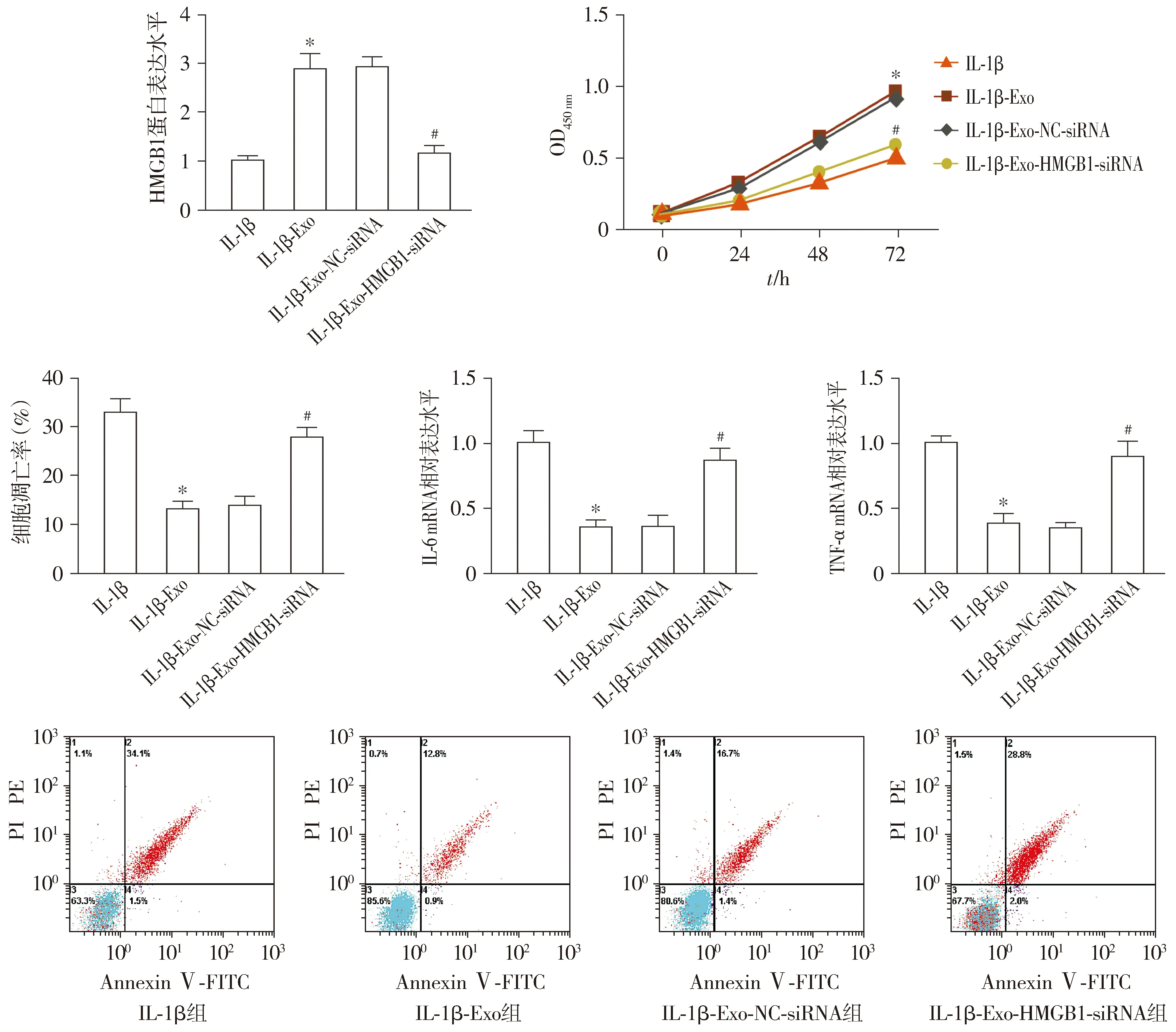
与IL-1β组比较,*P<0.05;与IL-1β+Exo+NC-siRNA组比较,#P<0.05
2.6 滑膜成纤维细胞来源的外泌体HMGB1对软骨降解的影响
实验结果显示,与IL-1β+Exo+NC-siRNA组比较,IL-1β+Exo+HMGB1-siRNA组软骨细胞中MMP-1、MMP-13 mRNA表达水平均显著升高,COL2A1 mRNA表达水平显著降低,差异均有统计学意义(P<0.05,见图6)。

与IL-1β组比较,*P<0.05;与IL-1β+Exo+NC-siRNA组比较,#P<0.05
3 讨论
OA是老年人最常见的退行性关节疾病,其主要特征是关节软骨的进行性破坏和关节炎症,导致身体残疾和生活质量下降。人们广泛研究了OA软骨中细胞外基质(extracellular matrix,ECM)蛋白的变化,如基质金属蛋白酶、胶原蛋白和蛋白多糖,结果显示,正常人群关节软骨中ECM含量远高于OA患者[9,10]。然而,OA的治疗结果和预后并不令人满意。例如,最常用的非甾体抗炎和镇痛药可能只是通过减轻疼痛和炎症来改善生活质量。而关节内注射激素或透明质酸仅适用于缓解OA炎症症状[11]。因此,对OA发病机制的深入研究可能为其治疗提供详细的理论依据。
软骨细胞是关节软骨的主要结构、功能和代谢单位,其死亡会导致细胞外基质降解,从而导致软骨衰竭和关节损伤[12]。了解软骨细胞退变的潜在机制可为OA的治疗提供新的潜在治疗思路。基质金属蛋白酶(matrix metalloproteinase,MMP)家族在OA的病理过程中发挥重要作用。MMP-1作为一种胶原酶,是软骨基质降解的限速酶之一,可降解胶原纤维三螺旋区域的胶原,并诱导其他MMP家族成员的活化,在OA的发生发展中发挥重要作用[13]。MMP-13又称胶原酶3,是新近发现的MMP家族成员,在结缔组织中有表达,在骨关节炎中升高,参与了软骨细胞外基质的降解和重塑[14]。研究还发现多种炎症调节因子在OA组织中异常表达。从OA患者中分离的软骨细胞经IL-1β处理后可诱导炎症反应,包括前列腺素E2(prostaglandin E2,PGE2)、一氧化氮(nitric oxide,NO)和MMPs的产生[15]。因此,IL-1β已被用于研究OA的分子机制和制定体外治疗策略。本研究结果与之前的研究一致,IL-1β处理的OA软骨细胞在细胞活力测定中显示存活率降低,促炎细胞因子水平升高和MMPs的表达增加。本研究从滑膜成纤维细胞中分离外泌体并与IL-1β诱导的软骨细胞共培养,结果发现,滑膜成纤维细胞来源的外泌体可显著促进软骨细胞的增殖能力,抑制细胞凋亡、炎症以及软骨降解,提示滑膜成纤维细胞来源的外泌体可能作为预防和治疗OA的潜在生物标志物。Xu等[16]的研究表明,骨髓间充质干细胞分泌的外泌体通过递送miR-326靶向HDAC3和STAT1/NF-κ B p65抑制软骨细胞焦亡,从而改善OA的进展。本研究结果与这些研究的相同之处在于都表明外泌体可成为调节OA发病机制的新靶点,不同之处在于外泌体的来源细胞各异,不同细胞来源的外泌体有不同的特点和功能,可参与调控多种基本生理过程,如炎症、细胞焦亡和免疫反应。
目前有关外泌体作用机制的研究集中于miRNA,近年来兴起的有关外泌体蛋白组学的研究结果显示,外泌体中能够通过向临近细胞分泌蛋白或与细胞融合后通过其内含的蛋白发挥效应[17]。在炎症的刺激下,核蛋白HMGB1可移位到细胞质并释放到胞外。作为晚期炎症介质,HMGB1参与了OA患者的长期和持续性全身性炎症。与健康人相比,OA患者的软骨组织和滑液中的HMGB1水平显著较高,HMGB1的表达与OA的严重程度相关[18]。miR-103a-3p通过下调HMGB1可促进骨关节炎软骨细胞增殖,减轻细胞凋亡和炎症[19]。HMGB1在OA患者中的高表达以及其增强炎症反应的功能使HMGB1成为开发OA治疗药物的理想靶点。近些年研究报道,肿瘤来源的外泌体HMGB1通过诱导PD1+TAM扩增促进食管鳞状细胞癌进展[20]。此外,外泌体HMGB1可通过JNK/HIF-1α信号通路促进血管生成[21]。但有关HMGB1是以何种形式存在于滑膜液中并且如何发挥效应的研究尚未出现。在本研究中,我们将沉默后的HMGB1转染至滑膜成纤维细胞中,并提取外泌体作用于软骨细胞,结果发现,滑膜成纤维细胞来源的外泌体可能通过上调HMGB1的表达抑制OA的发生发展。与此研究类似,Lai等[22]的研究结果表明,滑膜成纤维细胞外泌体miR-214-3p可改善软骨细胞炎症和软骨组织退变。与之不同之处在于,本研究的结果发现滑膜成纤维细胞来源的外泌体是通过分泌HMGB1参与OA的发生发展。此外,本研究也未从体内实验的角度证明滑膜成纤维细胞来源的外泌体HMGB1对大鼠模型关节软骨组织中炎症和凋亡作用的影响,所以本实验还存在一定的局限性。
综上所述,我们发现了滑膜成纤维细胞来源的外泌体可通过HMGB1介导软骨细胞炎症反应、软骨降解以及细胞凋亡。未来可以进一步深入研究外泌体在调控软骨生物学中的作用机制,以更好地理解其潜在的治疗应用。进一步的研究方向可能包括研究不同来源的外泌体在软骨保护和修复中的作用,以及探索HMGB1相关的潜在药物干预方法。这些工作有望为改善软骨健康和治疗软骨疾病提供新的突破性见解和治疗途径。

