电针联合泮托拉唑对乳腺癌裸鼠免疫功能、病理形态及CYP17/CYP19表达的影响
马 强,于珊珊△,孟 杰,马 跃,张华新
(1.唐山市协和医院,河北 唐山 063000;2.唐山市丰润区中医医院,河北 唐山 063000)
乳腺癌是世界上最常见的恶性肿瘤疾病,家族遗传史、营养因素及环境因素均是乳腺癌产生的危险因素。根据全球2017年世界卫生组织数据显示,乳腺癌多发于经济发达地区,乳腺癌位居英美两个国家发病首位[1]。中国国家癌症数据证实,我国人口基数大,乳腺癌发病率逐年升高,截止到2021年我国乳腺癌发病人数增加100万,因此对该疾病的治疗不容忽视[2]。乳腺癌患者免疫功能处于抑制状态,与正常人相关T淋巴细胞CD3+、CD4+和CD4+/CD8+降低,CD8+升高,但临床治疗后机体自我免疫调节修复,免疫功能有所提高可加快康复[3]。实验室研究证实乳腺癌是一种雌激素依赖性肿瘤,与绝经后女性乳腺癌发生发展密切相关。雌激素所必需的酶如细胞色素P450(CYP17,CYP11,CYP19)的遗传多态性对雌激素物质水平具有决定性作用,可增加乳腺癌疾病的发生风险[4]。CYP17基因可参与雌激素水平转化,其非编码区可产生A1和A2基因可增加乳腺癌发生风险。CYP19为P450芳香化酶,可使雄激素转化为雌激素,芳香化酶可增加乳腺癌组织雌激素水平,并通过靶向抑制就可改善患者临床疗效。
近些年,随着对乳腺癌的研究深入发现质子泵抑制剂可以加快癌细胞凋亡,辅助化疗疗效,并可抑制阴性乳腺癌细胞生长。泮托拉唑属于临床常见的质子泵抑制剂,临床可通过抑制胃酸分泌,但也有研究证实泮托拉唑可以逆转化疗耐药,可以杀伤肿瘤细胞,在结肠癌、乳腺癌及胃癌体外实验中得到证实[5]。穴位电针刺激是我国中医针灸理论下出现的新的治疗方法,具有非药理性、价格低廉及安全性高的特点,具有临床镇痛作用[6]。在乳腺癌的临床治疗中,电针可通过降低疼痛并发症而提高早期生活质量。本研究通过将电针联合泮托拉唑对乳腺癌裸鼠免疫功能、病理形态及CYP17/CYP19的影响,为乳腺癌的治疗提供方法。
1 材料与方法
1.1 实验动物
SPF级SD雌性未孕SD裸鼠购自中国医学科学院医学实验动物研究所,体质量120~140 g,鼠龄4~5周,许可证号:SYXK(京)2020-0024。动物饲养温度23~25℃、湿度45%~55%,自由饮水,进食普通饲料,保持笼内环境清洁,模拟黑白交替无菌饮食2周按照《实验动物管理条例》规定进行实验。
1.2 药物、主要试剂及仪器
泮托拉唑钠(含量>98.0%)购自大连美仑生物科技有限公司;MA-782裸鼠乳腺癌细胞购自上海复祥生物科技有限公司;韩氏穴位神经刺激仪HANS-200购自南京济生医疗科技有限公司;华佗牌针灸针0.30 mm×13 mm购自苏州医疗用品有限公司;多聚甲醛、乙醇购自阿拉丁化学试剂有限公司;0.9%生理盐水购自中国大冢制药有限公司;戊巴比妥钠(注射用水稀释为2%溶液)购自上海上药新亚有限公司;放射免疫法购自北京福瑞润泽生物技术有限公司;苏木精-伊红染色试剂盒购自上海科拉曼试剂有限公司;TUNEL试剂盒购自弗元(上海)生物科技有限公司;TCRαβ抗体购自上海微科生物技术有限公司;CD161a抗体购自上海博湖生物科技有限公司;抗CD3+、CD4+及CD8+抗体购自爱必信(上海)生物科技有限公司;CYP17、CYP19、Bcl-2及Bax抗体均购自Abcam中国;石蜡切片机购自德国徕卡;普通显微镜购自OLympus,Japan;蛋白电泳仪购自北京六一仪器;流式细胞仪购自北京赛泰克科技有限公司。
1.3 乳腺癌裸鼠模型建立
建模标准参考文献[7],将购自广州吉妮欧生物科技有限公司的MA-782裸鼠乳腺癌细胞株复苏,均10%的含有胎牛血清高糖DMEM培养基在37 ℃、体积分数5%的CO2及饱和湿度的培养箱中培养,每隔1日更换培养液,按照1∶3进行传染,生长到90%时,取浓度为1×107个/mL细胞0.2 mL皮下注射于裸鼠左侧腋下。隔日观察肿瘤生长情况,当生长为2 mm×2 mm时建模成功,认为1只建模成功裸鼠麻醉处死采集肿瘤组织,进行HE染色,观察建模情况。36只裸鼠建立乳腺癌动物模型,因感染死亡3只,33例裸鼠成功建立动物模型。
1.4 干预方法
45只裸鼠分为对照组(n=9)、乳腺癌组(n=8)、药物组(n=9)、穴位治疗组(n=8)及联合组(n=8),除对照组外均建立乳腺癌动物模型,建模成功后,药物组及联合组根据人与动物等效计量换算法,将40 mg的泮托拉唑与250 mL生理盐水混匀静脉滴注0.8 mg/kg的泮托拉唑,其余组别注射等体积的生理盐水,1次/d,连续治疗7 d。电针:穴位治疗组及联合组治疗前5 min采用滚筒法固定,穴位选择参考文献[8]裸鼠“百会”“长强”穴位进行针刺。百会穴针尖向后平刺15 mm,长强穴针尖向前平刺15 mm,连接电针仪,百会穴连接正极,长强穴连接负极,选择经针模式,按照频率2/15 Hz,电流0.5 mA,治疗15 min,1次/d,连续治疗7 d。
1.5 血清性激素水平比较
各组裸鼠麻醉后取腹主动脉血1 mL,按照2 000 r/min离心10 min,保留上清液采用放射免疫法检测雌二醇(E2)、孕酮(P)、孕酮受体(PR)、促黄体生成素(LH)及促卵泡成熟素(FSH)。
1.6 流式细胞仪检测外周血NK细胞及T淋巴细胞水平
各组裸鼠0.3%戊巴比妥钠腹腔麻醉(40 mg/kg),取2 mL腹主动脉血液放入试管中,向试管中分别加入TCRαβ-FITC抗体、CD161a-PE抗体、抗CD3+-FITC抗体、抗CD4+-FITC抗体、抗CD8+-FITC抗体及抗CD3+FOXP3+抗体。测试管中加入上述抗体组合,室温下避光孵育30 min,PBS冲洗,加入1 mL的PBS,采用流式细胞仪检测表面抗原。
1.7 瘤体抑制
脱颈处死裸鼠后,剥离肿瘤瘤块,称取各组裸鼠肿瘤质量,记录各组裸鼠肿瘤组织平均质量。
1.8 组织提取及HE染色
采集肿瘤组织,石蜡包埋,10%的甲醛溶液中,固定过夜,自来水冲洗,浸泡于14%的EDTA溶液中脱钙,逐层脱水后石蜡包埋后4 μm切片后备用。组织切片放入37 ℃复温15 min,二甲苯脱蜡后按照100%-95%-85%及75%乙醇进行逐层脱水,苏木精染色10 min,盐酸(1%)处理,伊红复染,100%-95%-85%及75%乙醇脱水,封片后观察组织形态。
1.9 TUNEL法检测各组裸鼠肿瘤组织细胞凋亡率
肿瘤组织4 μm切片,采用新鲜配制的4%的多聚甲醛溶液常温下固定20 min,PBS浸洗30 min,采用0.1% Triton-X-100冰上透膜2 min,再次PBS冲洗2次,后加入50 μL的TUNEL反应混合液,37 ℃下避光孵育60 min,再次采用PBS冲洗,加入滴加Antifade Mountant with DAPI染液再次染色,荧光显微镜下观察肿瘤组织细胞凋亡率,每张切片随机选择5个不重复的视野计算数目,取平均值。
1.10 免疫印迹检测肿瘤组织CYP17、CYP19、bcl-2及bax蛋白
肿瘤织采用1%裂解液,采用BCA检测蛋白,加入样品后,进行SDS-PAGE电泳,转移至PVDF膜,封闭1.5 h,后加入1抗,CYP17(1∶500)、CYP19(1∶500),内参为GAPDH(1∶2 000),过夜加入辣根过氧化酶标记的2抗(1∶2 000),摇匀,采用TBST冲洗膜,最后ECI话化学发光显色,试验重复3次取平均值。
1.11 统计学处理

2 结果
2.1 各组裸鼠血清性激素水平比较
与对照组相比,乳腺癌组裸鼠血清E2、P、PR、LH及FSH水平升高,差异具有统计学意义(P<0.05);与乳腺癌组相比,药物组及穴位治疗组血清E2、P、PR、LH及FSH水平降低,差异具有统计学意义(P<0.05);但药物组和穴位治疗组比较差异无统计学意义(P>0.05);与穴位治疗组相比,联合组裸鼠E2、P、PR、LH及FSH水平降低,差异具有统计学意义(P<0.05)。见表1。

表1 各组裸鼠血清性激素水平比较
2.2 各组裸鼠血清NK细胞及T淋巴细胞受体比较
与对照组相比,乳腺癌组裸鼠血清NK细胞TCRαβ+CD161a+抗体、T淋巴细胞CD3+CD4+及CD3+CD8+降低,CD3+FOXP3+升高,差异具有统计学意义(P<0.05);与乳腺癌组相比,药物组及穴位治疗组血清NK细胞TCRαβ+CD161a+抗体、T淋巴细胞CD3+CD4+及CD3+CD8+升高,CD3+FOXP3+降低,差异具有统计学意义(P<0.05);但药物组与穴位治疗组比较,差异无统计学意义(P>0.05);与穴位治疗组相比,联合组裸鼠血清NK细胞TCRαβ+CD161a+抗体、T淋巴细胞CD3+CD4+及CD3+CD8+升高,CD3+FOXP3+降低,差异具有统计学意义(P<0.05)。见表2、图1~2。

图1 各组裸鼠血清T淋巴细胞受体比较

图2 各组裸鼠血清NK细胞及T淋巴细胞受体比较
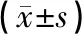
表2 各组裸鼠血清NK细胞及T淋巴细胞受体比较
2.3 HE染色观察各组裸鼠肿瘤组织形态
HE染色结果显示:对照组乳腺组织结果正常,乳腺小叶少,导管腔无扩张;乳腺癌组裸鼠乳腺腺体结构消失,小叶增加且导管出现扩展,腺体出现瘤样改变;与乳腺癌组相比,药物组及穴位治疗组乳腺小叶结构改善,导管增生好转;联合组乳腺导管增生及扩张明显改善,小叶腺泡减小,瘤样变化程度减弱。见图3。

图3 HE染色观察各组裸鼠肿瘤组织形态
2.4 各组裸鼠瘤体抑制比较
对照组、乳腺癌组、药物组、穴位治疗组及联合组的肿瘤质量分别为(0.00±0.00)g、(0.42±0.06)g、(0.30±0.05)g、(0.28±0.06)g及(0.21±0.03)g,多组间比较差异具有统计学意义(F=78.340,P<0.05)。与乳腺癌组相比,药物组、穴位治疗组肿瘤质量降低,差异具有统计学意义(P<0.05);与穴位治疗组相比,联合组肿瘤质量降低,差异具有统计学意义(P<0.05)。见图4。

图4 各组裸鼠瘤体抑制比较
2.5 TUNEL检测各组裸鼠肿瘤组织细胞凋亡率
对照组、乳腺癌组、药物组、穴位治疗组及联合组的肿瘤组织细胞凋亡率分别为(0.00±0.00)%、(3.51±0.71)%、(24.12±5.22)%、(24.28±6.22)%及(45.78±8.44)%,多组间比较差异具有统计学意义(F=106.100,P<0.05)。与乳腺癌组相比,药物组、穴位治疗组细胞凋亡率升高,差异具有统计学意义(P<0.05);与穴位治疗组相比,联合组细胞凋亡率升高,差异具有统计学意义(P<0.05)。见图5。
2.6 免疫印迹检测各组肿瘤组织中CYP17、CYP19、Bcl-2及Bax蛋白水平
与对照组相比,乳腺癌组CYP17、CYP19及Bcl-2蛋白上调,Bax降低;与乳腺癌组相比,药物组、穴位治疗组CYP17、CYP19及Bcl-2降低,Bax升高,差异具有统计学意义(P<0.05);与穴位治疗组相比,联合组CYP17、CYP19及Bcl-2降低,Bax升高,差异具有统计学意义(P<0.05)。见表3、图6。

表3 各组肿瘤组织中CYP17、CYP19、Bcl-2及Bax蛋白水平
3 讨论
乳腺癌是乳腺组织发展而来的癌症,发生发展与多种因素相关可由多基因共同作用导致,其中致癌基因及抑癌基因活性失调是导致正常细胞转化为癌细胞的主要原因。近些年,乳腺癌发生率逐年升高,但是随着医疗技术的进步,乳腺癌的死亡率有所缓解,但是仍有部分患者诊断时已经发展至中晚期,影响患者预后。目前,乳腺癌的临床治疗多以手术或放化疗为主,但是随着中医学的进步及独特优势的体现,将中医治疗与西医治疗相互结合对于提高乳腺癌患者临床治疗效果具有重要意义。本研究通过建立乳腺癌裸鼠模型,观察电针联合泮托拉唑对其免疫功能、病理形态及CYP17、CYP19的影响,为乳腺癌治疗方法选取提供依据。
机体免疫功能与肿瘤发生发展关系密切,当机体免疫功能降低时,机体内突变的细胞不能及时被清除而易发生肿瘤。T细胞是机体免疫系统重要组成之一,可以经血液输送全身进而发挥细胞免疫功能。相关研究表示,肿瘤机体内脾脏中免疫细胞T淋巴细胞占比降低,细胞毒性能力削弱而增加肿瘤的发生风险[9]。NK细胞能够通过调节多种免疫细胞,例如B细胞及T细胞活性而实现免疫调节功能[10]。本研究表示,与乳腺癌组相比,治疗后NK细胞TCRαβ+CD161a+抗体、T淋巴细胞CD3+CD4+及CD3+CD8+升高,CD3+FOXP3+降低,表示将电针联合泮托拉唑可以通过改善裸鼠免疫功能而发挥抗肿瘤作用。在乳腺癌患者血清中CD3+、CD4+及CD8+表达明显降低,导致免疫功能降低。泮托拉唑是第3代质子泵抑制剂,主要发挥改善胃部炎症作用,主要可以特异性作用于细胞而抑制氧化应激反应发挥胃部改善作用[11]。相关研究表示,泮托拉唑生物利用程度较高,不受其他药物影响的同时对肝肾功能无明显副作用,泮托拉唑可有显著改善消化道溃疡出血免疫功能,并加快患者康复进程。在脊椎手术患者术后采用泮托拉唑可以通过降低血清中炎症因子活性,包含TNF-α、IL-6及IL-1等而提高患者胃肠道免疫屏障功能[12]。但是在乳腺癌中还需要进一步研究,但是本研究认为与抗乳腺癌细胞活性相关。在乳腺癌细胞中,泮托拉唑可以上调乳腺癌细胞对阿霉素的摄取,增加化疗药物在细胞内分布而降低细胞扩散能力[13]。中医学将乳腺癌归属为“乳岩”,发病机制与肝脾郁怒,气血亏损相关,治疗应以疏肝解郁、补益气血为主。阴阳消长是人体生理节律的主要形式,调节阳气可以调节机体经络,百会、长强均为督脉经穴,百会为“三阳五会”主阳穴位,长强位于下,属于督脉起始之穴,两者并用可共奏通调督脉之功。电针针刺百会、长强穴位可促阴阳相通和调摄冲任等作用。在乳腺癌患者中采用穴位电针刺激治疗,通过刺激患者穴位经络,帮助患者气血恢复平衡,对患者机体免疫损伤具有保护作用[14-15]。
Bcl-2主要定位在细胞线粒体膜、核膜及内质网上,是细胞凋亡的主要调控信号,属于最早被认知的抗细胞凋亡因子。史文娴等[16]研究发现,在乳腺癌细胞中Bcl-2可以通过抑制线粒体释放色素C抑制其凋亡。Bax是促细胞凋亡因子作用与Bcl-2相关,在乳腺癌细胞中bax表达降低,Bcl-2表达增加延迟细胞死亡,有利于瘤体生长。本研究表明,乳腺癌组裸鼠瘤体质量较大,HE染色发现其腺体瘤样改变,肿瘤细胞凋亡率最低,且肿瘤组织中Bcl-2表达升高,Bax表达降低,经过治疗后瘤体质量降低,肿瘤细胞凋亡率升高,研究机制可能在与电针联合泮托拉唑可以上调Bax水平抑制Bcl-2活性加快肿瘤细胞凋亡相关。乳腺癌细胞代谢旺盛,葡萄糖吸收不能满足其需要,导致癌细胞在有氧环境下需要进行糖酵解。糖酵解过程中会生成大量乳腺,增加乳腺癌细胞酸性值,加快癌细胞恶性发展。泮托拉唑可以通过降低癌细胞外环境中ph值,进而抑制ph分泌提及溶酶体的表达而抑制细胞活性[17]。路振宁[18]研究表示,在B淋巴瘤细胞中采用泮托拉唑抑制后可以增加溶酶体通透性,增加线粒体色素C释放主要通过依赖于Bcl-2/Bax增加肿瘤细胞凋亡,改善疾病。电针百会可以调节Bcl-2/Bax水平表达,但是目前范围主要集中在脑缺血灌注中对神经细胞保护作用,认为电针百会可以抑制Bax激活Bcl-2表达发挥脑保护作用,这与本研究结果相反,但是均证实了调节线粒体信号的作用,不同的原因可能与不同疾病作用存在差异相关。
儿茶酚代谢途径是雌激素在机体代谢经历的主要过程,在细胞色素P450下雌激素指标E2水平表达升高,加快脱嘌呤突变。以往研究表示,乳腺癌裸鼠存在大量氧化还原反应,P、PR水平过高会加快自由基反应而加快乳腺癌发生发展。CYP 17是雌激素合成的关键酶,其基因上存在一个多态位点能够被限制性内切酶MspAl I鉴别而增加雌激素产物水平的作用。Saireudee C等[19]研究表明,乳腺癌患者组织中CYP 17表达升高,且患者血清中雌激素水平也显著升高,两者对于肿瘤发生发展具有促进作用。CYP 19是将雄激素转化为雌激素的关节酶类,通过检测乳腺癌患者发生风险的研究中,证实CYP 19可以提高乳腺癌疾病发生风险的同时可以上调雌激素加快疾病进展[20]。本研究发现,乳腺癌裸鼠血清中E2、P、PR、LH及FSH水平表达升高,经过治疗后,穴位治疗组、药物组及联合组均降低,其中以联合组最佳,说明电针联合泮托拉唑可以有效改善血清雌激素水平而改善病情,研究机制可能与抑制CYP17、CYP19活性相关。电针对于裸鼠的雌激素水平存在调节作用,在周建勇等[21]的研究中认为电针任督脉可以对裸鼠雌激素具有调节作用,主要机制可能通过调节下丘脑-垂体向,通过抑制激素水平而对PCOS 裸鼠疾病具有改善作用。现阶段,电针对于改善乳腺癌或肿瘤疾病仍处于起步阶段,相关的研究机制还需要在今后的工作中阐明。泮托拉唑对于雌激素水平的研究的主要方向为泮托拉唑可能参与胃黏膜保护,促进溃疡修复,研究机制与上调胃部雌激素诱导基因参与胃黏膜的防御屏障相关,但是关于乳腺癌中暂无研究。
本实验存在一定局限性,经济及时间受限,药物及电针对于相关指标的具体机制不够完整,可能对实验结果产生影响,后期本课题组会加强与其他相关研究单位合作,增加样本量,细化实验内容,为乳腺癌的治疗提供参考依据。综上所述,电针联合泮托拉唑可以显著改善乳腺癌裸鼠雌激素水平及免疫功能,降低肿瘤质量改善瘤样改变,研究机制可能与抑制CYP17、CYP19水平相关。

