电针对支气管哮喘小鼠肺功能及孤束核神经元放电的影响
吴昊晟,苏航,朱超,吴生兵,崔帅,周美启,3
(1.安徽中医药大学,合肥 230012;2.新安医学教育部重点实验室,合肥 230012;3.安徽省中医药科学院,合肥 236800)
支气管哮喘(bronchial asthma,BA)简称哮喘,是一种嗜酸性粒细胞炎性疾病[1],以反复发作的喘息、气促、胸闷和(或)咳嗽为主要临床表现[2]。根据2019年中国肺健康研究调查结果[3]显示中国患者总数已有4 570 万,超过20 岁人群哮喘患病率为4.2%,因此哮喘仍然是世界范围内亟待解决的社会公共卫生问题。有研究[4-5]表明针刺能够有效改善BA 的气道高反应性、黏液分泌过多和炎症水平。课题组前期研究[6]发现,针刺肺经五输穴对于BA 有着良好的治疗作用,特别是肺经经穴太渊能够有效改善小鼠肺功能,缓解哮喘症状。
目前,针灸普遍被认为是基于神经系统发挥作用的,特别是从脑神经科学入手研究针刺的作用机制是目前的主要方向[7]。特定的中枢核团在针刺过程中与调节大脑神经功能网络密切相关,课题组前期发现,针刺可以通过调节孤束核的放电频率改变迷走神经活动,从而发挥治疗作用[8]。孤束核(nucleus tractus solitarius,NTS)是内脏初级传入纤维的中继核团,并且与脑组织许多特定区域有着密切的纤维投射,近年来研究[9-10]发现,NTS 存在中枢呼吸化学感受器神经元。但是目前针刺关于肺脑相关的研究较少,尚缺乏针刺通过中枢核团改善肺脏疾病的实验依据。基于这些研究,提出NTS 可能参与电针肺经改善支气管哮喘的科学假说。本研究通过复制小鼠支BA 模型,以探讨NTS 在电针肺经改善BA 中的作用,亦为肺经-肺脏相关与脑联系提供实验依据。
1 材料与方法
1.1 实验动物
BALB/c 雌性小鼠45 只,体质量(20±2)g,在安徽中医药大学科研中心动物饲养中心隔离笼具中适应性饲养 1 周,笼内温度控制在 18~22 ℃,湿度为(55±2)%,固定昼夜时间12 h 照明,自由获得食物和水,保证充足的活动范围。实验小鼠均购自杭州子源实验动物科技有限公司,生产许可证号为SCXK(浙)2019-0004,本实验开展前通过安徽中医药大学实验动物伦理委员会批准(AHUCM-mouse-2022042),实验中严格遵循中华人民共和国科技部2006年颁发的《关于善待实验动物的指导性意见》相关规定对动物进行处理。
1.2 主要试剂与仪器
卵清蛋白(AP0028,Sigma);氢氧化铝(MB0215,美伦生物);异氟烷(R510-22-16,瑞沃德);苏木素(BA4097,贝索试剂);伊红(BA4099,贝索试剂);三溴乙醇(T48402,Sigma);乙酰甲胆碱(C6694,APExBIO,美国);小鼠IL-1β试剂盒(MAN0017504,Thermo Fisher Scientific);超声雾化吸入器(江苏鱼跃);华佗牌SDZ-Ⅳ型电子针灸仪(苏州医疗用品厂有限公司);气麻机(瑞沃德);肺功能分析系统(AniRes2005,北京贝兰博);脑立体定位仪(瑞沃德);微丝电极(plexon);在体多通道信号记录处理系统(plexon)。
1.3 模型制备
将45 只BALB/c 雌性小鼠按随机数字表法分为空白组、模型组和电针组,每组15 只。通过在第0 天和第7 天腹腔注射卵清蛋白(20 μg)和氢氧化铝(2 mg)混合的致敏液0.2 mL,从第14 天开始连续7 d 以1%浓度卵清蛋白生理盐水混合液雾化30 min建立支气管哮喘小鼠模型[6],详见图1。以雾化激发时出现喷嚏咳嗽、呼吸急促和抓耳捞腮等表现,肺组织和支气管HE染色呈现支气管挛缩,肺泡腔塌陷,肺泡隔增厚,上皮细胞部分脱落,肺泡间隙有红细胞渗出和明显炎性细胞浸润为造模成功[6]。

图1 模型制备和干预方式流程图
1.4 干预方法
空白组和模型组,每日正常抓取并以1%异氟烷维持麻醉20 min,不予其他干预,每日1 次,连续7 d。电针组,穴位取太渊和列缺,根据《实验动物常用穴位名称与定位第3 部分:小鼠》[11]定位,太渊位于腕横纹之桡侧凹陷中,列缺位于太渊穴近心端约2 mm 处,详见图2。小鼠以3%异氟烷诱导麻醉后,以1%异氟烷维持,局部皮肤消毒后进行针刺干预,以一次性针灸针于小鼠左右腕部各刺入2根毫针,间隔2 mm,直刺深度1 mm,将针柄与电针仪相连,同侧两根针连接在1 组电极,连续波,频率2 Hz,电流强度1 mA,留针20 min,每日1 次,连续干预7 d。

图2 太渊和列缺穴定位及电针示例图
1.5 指标检测
3 组小鼠在干预结束后随机选取进行指标检测,15 只小鼠中6 只小鼠仅进行肺功能检测,6 只进行电生理检测,电生理信号采集后小鼠与其余存活小鼠5%异氟烷麻醉后处死,取肺组织左上叶进行病理形态检查,取其余肺叶进行免疫因子含量测定。
1.5.1 观察肺组织和支气管病理形态
3 组小鼠5%异氟烷麻醉后处死,取肺组织左上叶保存在4%多聚甲醛溶液中固定,按照苏木素-伊红(hematoxylin-eosin,HE)染色步骤进行常规固定、脱水、透明、石蜡包埋、切片,行HE 染色,在400 倍光学显微镜下观察各组小鼠支气管、肺组织形态学变化,选取相同位置拍片。
1.5.2 测定肺组织中IL-1β含量
3 组小鼠5%异氟烷麻醉处死后取其余肺叶,冰水浴条件下,机械匀浆,制备成 10% 的匀浆液,2 500~3 000 r/min,离心10 min,取上清液,参照酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒指导说明加样、抗体孵育,在酶标仪450 nm 处测量吸光度值(OD 值),绘制标准曲线,并计算各组小鼠肺组织中IL-1β含量。
1.5.3 肺功能检测
3 组小鼠用1.25%三溴乙醇麻醉后钝性分离气管和颈外静脉,进行气管插管和颈外静脉插管并连接呼吸机,待基线稳定后按小鼠体质量依次递增给药,0、10、20、40、80 μg/kg 乙酰甲胆碱(0.0016 g乙酰甲胆碱溶于100 mL 生理盐水中配成16 μg/mL 的溶液,依次取一定量溶液加等量生理盐水稀释,分别配成8、4、2 μg/mL 的药品),每只小鼠每次注射0.1 mL不同浓度激发间隔3 min,使用AniRes2005 动物肺功能分析系统记录激发时的呼吸阻力(resistance of lung,RL)和肺顺应性(dynamic compliance,Cdyn)。
1.5.4 孤束核神经元放电信号的采集与处理
3 组小鼠以1%浓度异氟烷麻醉,小鼠呈俯卧位,调节耳杆将小鼠头颅固定于脑立体定位仪上。头部充分消毒备皮,沿正中头皮剪开,暴露颅骨平面,根据十字缝与人字缝定位前后囟位置,前后调平,再进行左右调平。参照小鼠脑立体定位图谱,详见图3,标记目标核团NTS 坐标,选用合适钻头开骨洞并安装颅骨钉,再于目标核团位置开一个足以容纳微丝电极的骨窗,挑硬脑膜。 安装微丝电极缓慢移至目标区域(Bregam -6.83 mm,LR 1 mm,H 4.5 mm)上方,缓慢以0.02 mm/20 s 速度下电极,至NTS 位置时记录神经元放电情况,再通过Offline Sorter、Neuro Explor等软件统计NTS 神经元的单位时间放电频率和频谱能量。
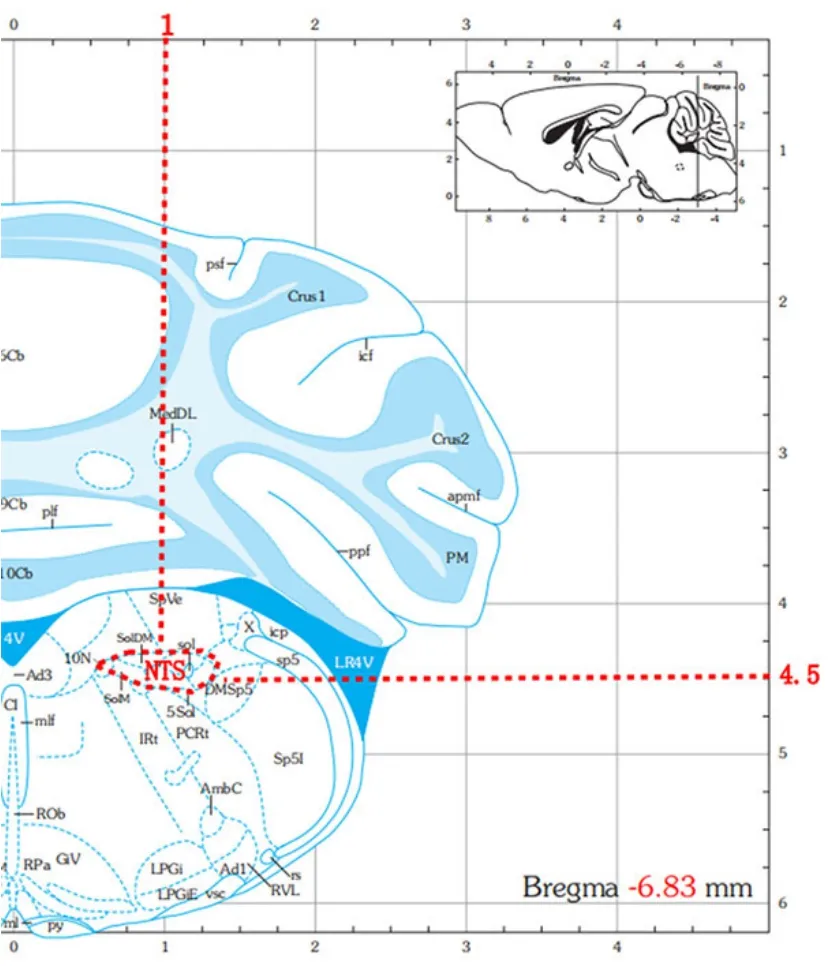
图3 小鼠NTS 脑立体定位图谱
1.6 统计学方法
所有数据采用SPSS26.0 软件进行分析处理,通过Graphpad Prism8.0 软件对分析结果进行统计图表绘制。符合正态分布的计量资料以均数±标准差表示,比较采用one-way ANOVA 和Pearson 相关系数进行统计分析;不符合正态分布的数据比较采用非参数检验。以P<0.05 表示差异有统计学意义。
2 结果
2.1 3 组小鼠行为状态比较
空白组一般生长状况持续保持良好,毛发质感柔顺、色泽明亮,呼吸顺畅,未见喘息哮鸣等呼吸道异样症状。模型组在雾化激发时,较空白组开始出现明显的喷嚏、咳嗽、呼吸急促、抓耳捞腮等表现。电针组较模型组呼吸喘促、喷嚏咳嗽声减轻,精神状态也有显著改善。
2.2 3 组小鼠肺组织和支气管结构比较
通过HE 染色观察显示,空白组肺组织与支气管细胞结构完整,排列整齐,无明显异常表现;模型组较空白组而言,可见支气管挛缩,上皮细胞部分脱落,分泌物增加,肺泡腔塌陷,肺泡隔增厚,肺泡间隙有红细胞渗出和明显炎性细胞浸润;电针组支气管痉挛改善,上皮细胞脱落有所缓解,分泌物减少,肺泡腔塌陷程度较模型组减轻,肺泡隔稍有变薄,肺泡间隙炎性细胞浸润缓解。详见图4。
2.3 3 组小鼠肺组织内IL-1β含量比较
通过ELISA 检测IL-1β含量显示,模型组肺组织内IL-1β表达水平较空白组明显升高(P<0.05);电针组IL-1β表达水平较模型组明显降低(P<0.05)。详见图5。
2.4 3 组小鼠肺功能比较
以浓度递升的乙酰甲胆碱溶液激发时,与空白组比较,模型组各浓度RL 均呈现显著增高(P<0.05),且模型组RL 呈现剂量依赖性增高的趋势;与模型组比较,电针组RL 显著降低(P<0.05)。详见图6。
与空白组比较,模型组各浓度Cdyn 均呈现显著降低(P<0.05),且模型组Cdyn 呈现剂量依赖性降低的趋势;与模型组比较,电针组 Cdyn 均显著改善(P<0.05)。详见图7。
2.5 3 组小鼠NTS 电生理比较
模型组NTS 内神经元平均每秒峰电位放电频率与空白组相比较明显密集(P<0.05);电针组NTS 神经元平均每秒峰电位放电频率与模型组相比较明显降低(P<0.05)。通过频谱能量图显示,与空白组比较,模型组频谱能量图颜色更鲜艳,强度有所增加;与模型组比较,电针组频谱能量强度有所减弱。详见图8。
2.6 NTS 放电频率与IL-1β和RL 呈正相关
将NTS 放电频率与IL-1β水平和RL 进行Pearson相关性分析。结果表明,放电频率与IL-1β水平呈正相关(R=0.5678,P=0.0140<0.05)。放电频率与RL 呈正相关(R=0.7852,P=0.0001<0.05)。详见图9。

图9 NTS 放电频率与IL-1β和RL 呈正相关(±s,n=6)
3 讨论
支气管哮喘(BA)作为一种气道慢性炎症,西医通常使用糖皮质激素、白三烯受体拮抗剂、β2 受体激动剂[12-14]等药物治疗,这些药物长期使用,存在较大不良反应。该病属于中医学“哮证”“喘证”等范畴,中医学认为肺主气、司呼吸。《灵枢·经脉》示“是动则病,肺胀满,膨膨而咳喘”“是主肺所生病者,咳,上气,喘喝”,表明肺经主治喉、胸、肺有关疾病,电针肺经改善支气管哮喘有充足的理论依据。
目前研究[15]表明支气管哮喘的发病机制与炎性细胞浸润、气道高反应性以及神经内分泌网络等关系密切。IL-1β作为支气管哮喘未来恶化风险的预测因子[15],细胞炎症水平和Th2 上游细胞因子均依赖于IL-1β信号的传导[16],发病时会引起IL-1β等炎性因子水平迅速上升。支气管哮喘气道高反应性通常表现为起到对刺激产生较明显的气道收缩反应,导致气道阻力显著增加[17-18],使患者呼吸困难。本研究结果表明,电针肺经太渊、列缺能够有效降低炎性因子IL-1β水平,也可以改善肺功能状况,有效降低呼吸阻力和提高肺顺应性。
经脉脏腑与脑相关是目前针灸研究的热门话题,心脑相关[19-20]已有了许多研究成果,但在肺经-肺脏与脑相关方面研究相对较少。根据目前对于NTS 的研究,有学者[21-22]发现NTS 在咳嗽的发病中发挥着重要作用,BASSI M 等[23]研究证实了NTS 是瘦素促进呼吸反应的作用部位,诸多研究表明NTS 对维持肺脏的结构及功能至关重要,可能与肺脏疾病存在一定的联系。使用在体电生理记录系统可以有效记录指定核团内的群体神经元峰电位活动变化情况,本研究利用该技术记录NTS 内神经元峰电位放电情况,为肺经-肺脏与脑相关提供了一定的神经电生理学的依据。NTS 可能是电针肺经改善支气管哮喘的一个新的关键中枢核团。本实验中,小鼠支气管哮喘后,NTS 神经元平均每秒放电频率上调,相关学者[24]在灵长类动物的研究结果与本研究基本一致,他们发现灵长类动物哮喘模型中NTS 神经元内在兴奋性增加。电针肺经干预后,可降低支气管哮喘所导致的NTS 神经元平均每秒放电频率,促进了肺功能的修复。另外,NTS 神经元平均每秒放电频率与炎症因子IL-1β和呼吸阻力RL 密切相关,NTS 神经元的激活与气道炎症和气道高反应的相互作用,可能对支气管哮喘的发病产生协同作用。因此,笔者推测电针可能通过调节NTS 神经元峰电位放电水平促进支气管哮喘的缓解。
基于以上研究结果,笔者认为NTS 参与电针肺经改善支气管哮喘的过程是一个很重要的研究方向,其机制可能与电针肺经后抑制NTS 神经元活性,从而影响气道炎症和气道高反应性,为肺脑相关提供了一定的实验依据。然而,NTS 能调节自主神经系统平衡[25],负责传递迷走神经的传入和传出[26],迷走神经兴奋会导致支气管痉挛,引起哮喘加重,电针肺经调节孤束核是否能够通过抑制迷走神经兴奋,改善哮喘患者支气管痉挛。NTS 与自主神经系统在电针肺经改善支气管哮喘肺功能方面的相互作用有待进一步的研究,这是目前研究的局限之处,针对这些疑问,将在后续研究中予以进一步证实,以便更好地阐释电针肺经改善支气管哮喘的效应机制。

