基于流式细胞术与基因组Survey 分析白及基因组大小及特征
杨 渊,黄明进*,王大昌,阮宝丽,杨秋悦,杨 洋,罗影子,覃玉强
(1.贵州大学农学院,贵州大学石斛研究院,贵州省药用植物繁育与种植重点实验室,贵州 贵阳 550025;2.贵州创禾源农业科技有限公司,贵州 贵阳 550025)
白及为兰科白及属植物,具收敛止血、消肿生肌的功效[1]。我国产有黄花白及、小白及、华白及、白及[2]。近年来白及的研究逐渐增多[3-7],但由于缺乏基因组序列研究数据,白及的分子生物学研究水平进展缓慢。白及的细胞遗传学研究主要集中在染色体水平上,研究发现白及的染色体为二倍体,其中核型类型有中部(m)、近中部(sm) 和近端 (st) 着丝点,染色体核型有2B 和2C两种[8-9]。
随着二代Illumina 高通量测序技术不断的发展,大量药用植物的全基因组测序也随之开展,基因组组装也由scaffold、contig 及染色体水平发展到目前的端粒到端粒(T2T) 的0 gap 水平[10-11]。在对某个物种进行denovo 基因组测序之前,对于没有参考基因组的物种,通常会对该物种基因组大小,杂合度等信息进行预估,根据基因组大小及复杂度来判断测序数据的深度,组装基因组的难易程度等,从而制定相应的测序和分析策略,一般可通过细胞遗传学[12-13]和基因组survey 测序与K-mer 分析2 种方式[14-15]获取该物种的染色体核型、基因组大小、复杂度及重复序列比例等信息。本研究以白及为材料,尝试采用上述测序技术对白及进行细胞学分析与基因组测序,以期为白及后续精细图阶段的文库构建及全基因组de novo 测序策略奠定基础,同时也为白及分子生物研究的研究提供依据。
1 材料
1.1 药材 白及采自贵州大学农学院石斛研究院白及资源苗圃,经贵州大学赵财副教授鉴定为药用植物白及Bletillastriata(Thunb.) Reichb.f.的干燥块茎。
1.2 试剂 柠檬酸钠 (批号D223BA0020)、MgCl2·6H2O (批号20191114)、碘化丙啶(批号550825)、无水乙醇(批号20220406)、MOPS (批号 0670200911)、RNAase ( 批号 20200318)、Triton X-100 (批号0694070511)、EDTA-2Na (批号20200303),由贵州创禾源农业科技有限公司提供。
1.3 仪器 BD FACSCalibur 流式细胞仪(美国BD 公司); 5810R 离心机(德国Eppendorf 公司);PT-3502C 酶标仪(北京普天新桥技术有限公司);DYY-6C 电泳仪、DYCZ-22A 水平电泳槽、DYCZ-24A 垂直电泳槽(北京六一生物科技有限公司);制冰机 (日本SANYO 公司); C1000TMPCR 仪、Chemi DocTM凝胶成像系统(美国Bio-Rad 公司)。
2 方法
2.1 染色体核型检测 以白及成熟种子作为外植体经组织培养5 个月后,取组培苗根尖作为供试样品。将装有根尖的离心管放置于充气罐内,充入0.9~1.0 MPa N2O,静置处理2 h,将90%预冷冰乙酸加入离心管内,静置处理10 min。完成固定后,将冰乙酸吸出,ddH2O 进行2 次清洗。用刀片将根的根尖白色部分切下,放入装有25 μL 酶液的0.5 mL 离心管中,在37 ℃水浴条件下酶解1 h。酶解结束后,用70%乙醇将根尖清洗3 次,并用解剖针将根尖在剩余酒精中充分破碎和振荡,4 000 r/min 离心,将细胞离心至管底后,晾干。根据根尖数量,在离心管内加入25 ~45 μL 冰乙酸,离心,充分振荡混匀。将载玻片放置在预先湿润的盒子中,室温保持在23 ℃左右,吸取8 μL 细胞悬浮液滴于载玻片正中间,立即盖上盖子,直到细胞散开,载玻片晾干后取出。将染色体标本在显微镜下进行观察,采用双色荧光原位杂交(FISH) 探针制备,使端粒与rDNA 原位杂交,并在高分辨率的荧光显微镜CCD 下拍照,进行染色体核型的精准分析。
2.2 流式细胞检测基因组大小 白及块茎上萌发1 个月的嫩芽,经液氮-80 ℃速冻后保存备用。取嫩芽置预冷的mGb 解离液经刀片切碎,静置10 min,过滤得细胞核悬浮液,加预冷PI 和RNAase置冰上避光染色0.5 ~1 h,CPI、CRNAase分别为50 μg/mL[16-17]。以番茄种子萌发后1 个月长出的嫩叶为内参,在488 nm 波长处蓝光激发检测荧光强度,每次检测收集10 000 个颗粒。变异系数小于5%。
2.3 Survey 分析白及基因组大小 植物白及嫩芽采集后用液氮速冻后使用提取试剂盒Qubit®dsDNA BRassay Kit 进行提取,检测基因组DNA 浓度、纯度、完整性。检测参数为胶浓度1%; 电压150 V; 电泳时间40 min; 以M1λ-Hind Ⅲdigest,M2 D2000 作为Marker。基因测序与K-mer 分析委托深圳华大基因科技有限公司进行Ilumina 双端测序。公式为基因组大小=总碱基数/平均测序深度=总K-mer 数/平均K-mer 深度。
3 结果
3.1 白及染色体核型分析 白及染色体用DAPI荧光染色通常呈蓝色荧光,选取染色体形态清晰、染色程度适中、并分散良好分裂相,通过对不同分裂相观察(图1) 初步确定均白及染色体数目为32 条。利用端粒重复序列探针对染色体双色进行荧光原位杂交,被染色的端粒在荧光显微镜下呈绿色。由图2 可知,以两端都有端粒为一条染色体,白及染色体长度在1.0 ~4.5 μm 之间,根据Levan等[18]的染色体分类方法及Stebbins[19]核型分类的标准分类方法,白及主要为近中部(sm) 或近端部(st) 着丝粒染色体,基因组较小,核型类型为2C。白及18S rDNA 和5S rDNA 在染色体上的定位分析,由于染色体被染成蓝色,经Fluorescein-12-dUTP 标记的18S rDNA 探针与染色体结合后,在显微镜下呈现绿色荧光,而经Texas-Red-5-dUTP标记5 SrDNA 在显微镜下呈现红色荧光。由图3 可知,5S rDNA 在2 条染色体上有显示较强的红色荧光杂交信号,18S rDNA 在2 条染色体显示较强的绿色荧光杂交信号; 根据染色体长度、形状等特征将其进行同源染色体配对,其中5S rDNA 分布在13 号2 个同源染色体的间隙,18S rDNA 分布在2号色体短臂的核仁组织区。同时也证实了白及染色体为二倍体。
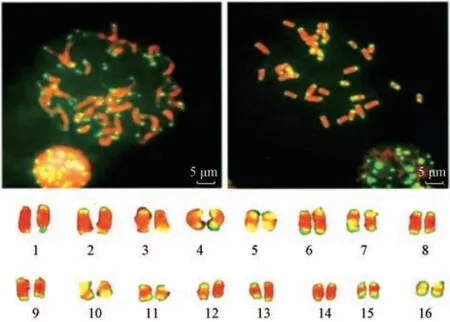
图2 白及染色体端粒FISH 结果Fig.2 FISH results of telomere of Bletillae Rhizoma chromosome

图3 白及染色体的rDNA FISH 结果Fig.3 The rDNA FISH results of Bletillae Rhizoma chromosomes
3.2 白及基因组大小检测
3.2.1 流式细胞检测白及基因组大小 番茄是茄科的模式植物,其全基因组大小为900 Mbp。本研究以番茄为对照,估算白及基因组的大小。由图4可知,粒子团明确、清晰且集中,表明该实验条件下样品可良好区分。结果发现,内参番茄峰的荧光值为18.89,白及峰的荧光值为50.78,根据待测物种C 值计算公式为白及C 值=番茄DNA 含量×白及的荧光强度/番茄样品的荧光强度,测得白及的基因组大小为2.37 Gb,是番茄的2.69 倍。

图4 白及C 值流式细胞分析图Fig.4 C value of Bletillae Rhizoma by flow cytometry analysis
3.2.2 白及基因组Survey 测序与K-mer 分析 采集样品为白及嫩芽,通过试剂盒提取DNA 经琼脂糖凝胶电泳检测得电泳图谱(图5)。电泳图谱主带清晰,无降解、轻度蛋白质污染,且测得DNA总量为1.518 μg,总体积为60 μL,浓度CDNA为25.3 ng/μL,根据《DNA 测序样品质量标准》,白及DNA 样品质量满足建库测序要求,且建库成功率约为97.40%。
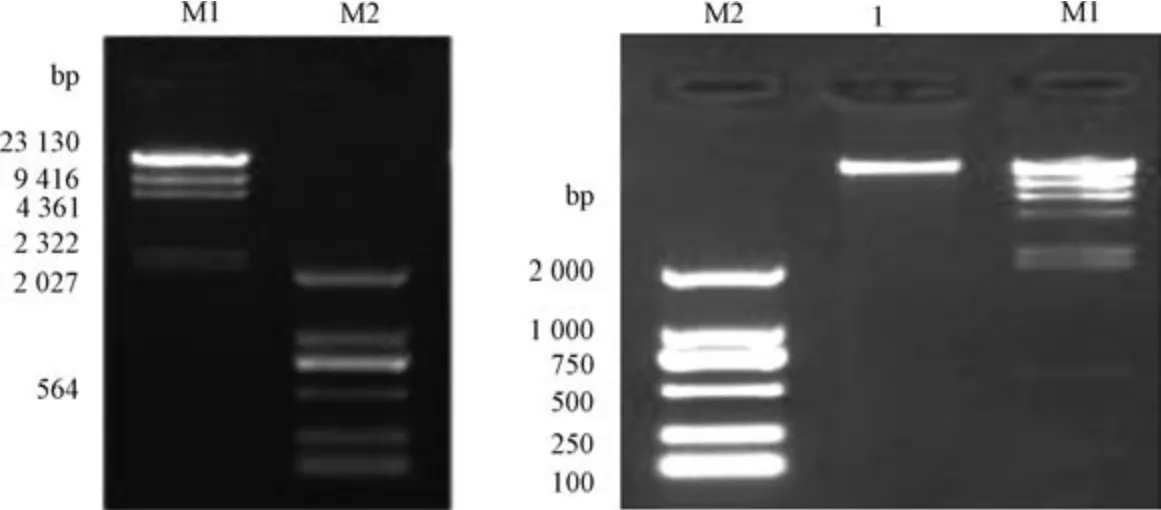
图5 白及DNA 电泳图谱Fig.5 DNA electrophoregram of Bletillae Rhizoma
基因组利用由华大基因在Illumina 两端进行双端测序(PE =150) 得出61.06 Gb 原始数据,使用SOAPnuke (V 1.6.5) 软件对原始数据进行过滤,过滤掉低质量、存在接头污染和重复的数据,得到有效数据共60.1 1Gb,公式为有效数据比例=(有效数据/原始数据) ×100%,有效数据比例越大,表明文库质量越好。白及的有效数据比例约为98.42%,表明白及的基因组DNA 测序质量较优,测序结果整体的可信度高。
基于K-mer 分析原理,选取17~31 K-mer 进行分析。通过GenomeScope 软件对17 ~31 K-mer 的频谱进行拟合,构建k=19 的K-mer 分布图(图6),进行基因组大小、重复序列比率和杂合率的评估。

图6 19-K-mer 分布曲线Fig.6 19-K-mer distribution curve
图6 中,蓝色柱子是K-mer 的观测值; 橙红色拟合线部分对应着深度过低的K-mer,这些K-mer被认为是测序错误引入的; 黑色拟合线是除去被认为是错误的部分(橙红色拟合线部分) 之后剩下的所有K-mer,这些被认为是可靠的K-mer 数据;黄色拟合线被认为来自基因组非重复区域的K-mer分布; 垂直的黑色虚线为预测最低深度峰的整数倍覆盖度。经拟合后发现,19-K-mer 分布曲线为非正常泊松分布,呈现双峰分布,在10 和19 处各有一个峰,估测白及的为二倍体。平均K-mer 深度即主峰对应的K-mer 深度为19,在主峰的前面期望深度的1/2 位置处有明显的杂合峰,说明该基因组有一定杂合度的杂合度,即深度出现在10 附近的K-mer 序列为杂合序列,经过Genomescope 软件进行杂合度分析,得到白及基因组的杂合率约为1.099%。K-mer 深度出现在主峰对应深度2 倍以上的序列为重复序列,即深度大于40 的K-mer 序列为重复序列,重复序列约占67.45%从测序数据中得得到K-mer 数为59 981 133 228 个,去除深度异常的K-mer 后得到25 277 266 个。根据K-mer 深度信息,基因组大小=总K-mer 数目/平均K-mer深度。估计基因组大小约为2.53 Gb,有效测序深度为23.73。
通过对调研图文库测序数据分析,该物种基因组的GC 含量(DNA 中鸟嘌呤和胞嘧啶所占比例)约为36.1%,较为适中,即白及的GC 分布无明显偏向性,不会影响调研图分析的准确性,调研图结果可靠。
4 讨论
本研究发现白及为二倍体,染色体数目32 条,染色体类型主要为sm 和st 型,这前人的研究结果大致相同[8-9]。从核型上看,白及的核型为2C 型,根据Stebbins[19]对染色体核型分类1A ~4D 中,2C型相对其他已发现的2B 型白及种质资源进化程度较高。而相同倍性的不同白及种质资源在核型分类上存在差异,其原因可能是由于不同种质资源为适应不同生长环境而引起的进化或实验等因素而引起的。
高等植物有45S rDNA 和5S rDNA 两类[20]。18S rDNA 是45S rDNA 的一种,其定位位点主要在染色体的次缢痕部位,与随体相连,一般认为物种45S rDNA 的染色体杂交位点数与随体数相同[21],而5S rDNA 通常有位于染色体末端和同源染色体间隙两种位点[22]。研究发现,白及在5S rDNA 和18S rDNA 各有1 对位点,分别位于同源染色体间隙和染色体断臂末端,因此认为白及染色体存在2个随体,且45S rDNA 和5S rDNA 在白及染色体上不存在共定位现象。本研究获得了白及基于5S rDNA 和18S rDNA 荧光原位杂交核型与同源染色体上的2 个随体,可作为白及染色体识别的有效标志。
流式细胞测定结果依赖于内参物种准确性,且难以预判物种复杂程度; Survey 分析则受到会受数据质量、软件及参数设置等测序过程影响。因此在预估基因组大小时往往会结合进行判断,可将物种大小定位在一定的范围内,现已用于地黄[23]、黄芪[24]等药用植物的基因组估测。本研究以流式细胞术与Survey 分析相结合,估测白及的基因组大小范围在2.37~2.53 Gb 之间。流式细胞术测得白及基因组大小略低于Survey 分析,其主要原因可能是流式细胞技术在测定基因组大小时会受到植物的不同部位、内参物质、处理环境与内标植物等因素影响。本研究以番茄为内参,其基因组大小是白及的2.7 倍,差异较大,导致估测结果偏低,这与好好芭[25]、马鞍藤[26]等预测的基因组大小结果相同。另外通过K-mer 分析得出白及基因组杂合度为1.099%,重复序列约67.45%,根据基因组杂合度分类,杂合度大于0.8%为高杂合基因组,重复序列比例大于50%为高重复基因组[27]。因此白及基因组被认为是超高杂合、超高重复基因组。所获得的白及基因组特征信息,既可对白及的物种起源研究和下一步的基因组学研究具有参考价值,同时将为后续白及全基因组测序、组装、去冗余处理及精细图谱绘制等工作提供参考。

