结芋期干旱胁迫对芋叶片生理特性及芋子品质产量的影响
潘 饶,曾荣斌,李慧英,谢金生,吴芳柠,黄佳雨,周庆红,黄英金,朱强龙
(江西农业大学 江西省薯芋生物学重点实验室∕农学院,江西 南昌 330045)
【研究意义】芋(Colocasia esculenta(L.)Schott)为天南星科芋属多年生草本植物,常做1 年生栽培,是世界上最古老的作物之一,也是全球第5 大根茎类作物和第14 大蔬菜作物[1]。芋原产于热带沼泽地区,喜温暖湿润的环境,在我国南方普遍种植,我国常年种植芋面积约10.10 万 hm2,世界排名第四,产量居世界第三,平均单产为18.92 t∕hm2,高出世界水平2.74 倍[2]。我国栽培芋历史悠久,生态条件多种多样,长期以来演变出丰富的芋品种类型,根据水分的需求量,可分为对水分需求量大的水芋和需求量小的旱芋,相比水芋,旱芋叶片和植株较小,在生产中推广面积更广且品种类型更丰富,但相比其他作物,芋的叶片巨大,具有较强的蒸腾作用,但根系均为须根系且分布较浅,吸水能力弱,即使是旱芋,也需要相对其他旱地作物更多的浇水量。芋是一种江西省优势特色作物,以旱芋品种为主,如铅山红芽芋、王桥花果芋、吉安登龙粉芋和吉埠贡芋等,这些芋品种不仅栽培历史悠久,也是省内外闻名的江西省地理标志芋品种[3-6]。芋的生长发育可分为萌芽期(30 d 左右)、幼苗期(30 d 左右)、发棵期(30 d 左右)、结芋期(90 d 左右)和成熟期(20 d 左右)5 个阶段[7],结芋期也称为球茎膨大期,主要集中在7—9月,在芋的整个生长过程中,结芋期对水分的需求量最大,而该时期江西省全年降水量最少[8],水分缺少会导致芋生产面积受限和品质产量下降。【前人研究进展】干旱胁迫下的芋头植株高度、叶片数量、叶面积指数、营养生长指数以及光合作用的相关指标等生理生化指标会有显著的变化,对芋造成不同程度的伤害[9-11],然而结芋期干旱胁迫对芋的根系生长影响、叶片膜脂过氧化及抗氧化酶系统反应情况以及对芋产量和品质的影响等问题,目前却鲜有系统的研究。【本研究切入点】课题组前期从旱芋类型的‘赣芋2 号’(T22)组培后代植株中筛选获得可以稳定遗传的突变体材料‘赣芋4 号’(T24)[12],在田间种植过程中,发现T24 在干旱季节的长势比T22 更加旺盛,表明T24 具有更强的耐旱能力,但其具体抗旱相关的结构特征、生理特性以及分子调控机制均不清楚,故以T24 为试验材料,开展胁迫试验对其进行研究。【拟解决的关键问题】以T22 和T24 为研究材料,利用表型性状测量工具、扫描电镜观察两种芋结构特征的差异,参照不同生理物质的测定方法检测其生理特性的差异。旨在进一步阐明突变体芋抗旱的生理生化特性,从而指导芋高产优质栽培,为芋抗旱性资源筛选和遗传改良提供理论依据。
1 材料与方法
1.1 试验材料
本试验在江西农业大学科技园园艺科研基地进行,供试材料为‘赣芋2号’(T22)及其体细胞组培突变材料‘赣芋4号’(T24),其中赣芋2号为江西农业大学江西省薯芋生物学重点实验室选育的芋新品种。
2022 年3 月中旬选取大小均匀的健康种芋(50 g 左右)埋于草炭基质中进行催芽,待幼芽长至5 cm左右移栽至12 cm×12 cm的黑色营养钵中育苗。
5 月中旬选取T22 和T24 长势一致的健壮幼苗(株高20 cm 左右,2~3 片真叶),移栽至实验基地日光温室中的3 个种植池(长6 m,宽1.5 m)内,底部未封闭,利用两侧抹水泥的砖墙作为防护层,定植前施足底肥,对土壤精耕细作之后,沿长边起两条高垄,按株行距30 cm×60 cm分别将T22(3×18株)和T24(3×18株)定植在2条垄上,统一栽培措施进行管理,保证2种试验材料正常生长。
1 个月之后(6 月中旬)待植株生长进入结芋初期(5~7 片真叶),即子芋萌发初期,进行干旱胁迫处理:根据土壤含水率和干旱程度分级标准,设置第1个种植池为正常灌水组(T22-ck和T24-ck,土壤相对含水量为>20%),第2个种植池为中度胁迫组(T22-t1和T24-t1,12%~15%),第3个种植池为重度胁迫组(T22-t2和T24-t2,5%~8%)。参照测墒补灌的方法[13],每3 d 09:00在各个种植池4个对角及中点挖取0~30 cm 土层土样,对其称量,测定土壤含水量[14-15],当种植池内土壤水分含量不在设置的水分含量范围内时,使用Nadster(型号:85960)灌溉定时器,根据土壤水分含量情况对每天浇水次数、浇水时长进行调节,不同处理间通过改变水流大小控制水分含量,以保证种植池内土壤水分含量保持在处理的水分含量范围内。
干旱处理过程中每30 d 取样并测量叶片相关重要性状1 次,在处理过程中每次取样(7、8、9 月中旬)结束后及时测定各项胁迫相关重要指标(次级代谢物质及相关酶活性),共取样和测定各项胁迫相关重要指标3 次,在第3 次取样和测量结束后,芋进入成熟期,此时恢复全部植株的正常供水,在采收前(11 月中旬)统一停止浇水30 d,12 月中旬进行采挖,并测量芋头产量、品质以及根系情况以观察结芋期干旱处理对芋的影响。
1.2 测定项目与方法
1.2.1 叶片结构相关重要性状的测定与观察 选取完全展开的第2片新叶作为测量对象,利用直尺和卷尺对芋叶片长宽和宽度、最高叶柄长度(代表植株高度)进行测量,统计叶片数量,对叶片进行拍照并利用ImageJ 计算叶片面积。利用无水乙醇(95%)浸提法测定叶片叶绿素含量。用磷酸缓冲盐溶液(PBS)∕戊二醛固定叶片,保存于4 ℃的冰箱内,按要求脱水、干燥后,将样品于镀膜机(JEOLJFC-1600)上喷金镀膜,于扫描电镜(JSM-6360LV)下观察并拍照,观察叶片表面蜡质。采用氯仿加热浸提法测定叶片表面蜡质,参考周小云等[16]对水稻叶片蜡质的测量方法。在植株处理过程中,为了观察不同处理之间气孔变化,在每次取样前后2~3 d,于晴天09:00—10:00 气孔开度最大时,选取芋叶片背面不含大叶脉、较为平整的位置,每片叶片随机选取3 个点,采取指甲油印迹法,参考陈奕凝等[17]对海棠叶表皮气孔的观察,利用无色透明指甲油进行涂抹,每个点3~4 cm2,待指甲油干燥完全后用镊子轻轻撕下,制片后放于显微镜下,观察气孔状况。
1.2.2 叶片中逆境相关次级代谢物质的测定 丙二醛(MDA)含量的测定采用硫代巴比妥酸(TAB)法;脯氨酸(Pro)含量采用磺基水杨酸提取酸性茚三酮法;过氧化氢(H2O2)含量采用南京建成生物工程研究所的试剂盒测定,型号为A064-1-1。
1.2.3 叶片细胞膜保护系统重要相关酶活性测定 超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、抗坏血酸过氧化物酶(APX)、谷胱甘肽还原酶(GR)等5 种酶是细胞膜保护系统重要相关酶,SOD、CAT 和POD 采用南京建成生物工程研究所的试剂盒测定,型号分别为A001-1-1、A007-1-1、A084-3-1。APX 活性参考孙云等[18]对茶叶中APX 活性测定的方法;GR 活性的测定参考Vitória 等[19]对萝卜中GR活性的测定方法。
1.2.4 芋子产量和品质相关性状测定 统一采收所有处理组和对照组的芋子球茎,利用电子秤、直尺、游标卡尺等工具对球茎的平均单球重、横径、纵径、单株产量、根数量、根系直径、根长等进行调查和统计。田间采收后,选取表面光滑、圆润、健康无病害无损伤的球茎,收集芋肉保存在-80 ℃直至使用,对不同处理及对照组球茎的可溶性糖含量、淀粉、还原糖、纤维素、可溶性蛋白、维生素C含量等6种重要营养成分进行测定。
1.3 数据分析
利用Excel 2019 对试验数据进行数据统计和作图,并采用SPSS 19.0 对不同处理间的统计数据进行方差分析。
2 结果与分析
2.1 干旱胁迫对两种芋叶片影响
随着干旱胁迫水平加重和处理时间的延长,如图1和表1所示,两种芋叶片的长度、宽度和叶面积逐渐在变小,重度干旱胁迫90 d 后相比正常对照组,T22 和T24 的叶片面积分别下降了75.9%和67.2%,表明T22 叶片面积的下降幅度要显著大于T24。同时,两种芋植株高度(最高叶柄长度)也在显著缩短,且叶片数量也在减少,但在重度干旱胁迫90 d后,两种芋的叶片数量和最高叶柄长度没有显著差异。随着土壤含水量的下降和处理时间的延长,两种芋叶片中的叶绿素含量呈现先升高后逐渐降低的趋势,但相同处理下两种芋的叶片叶绿素含量没有显著差异。

表1 干旱胁迫下芋叶片的主要特征变化Tab.1 The main characteristic of taro leaves under drought stress

图1 干旱胁迫下两种芋叶片变化情况Fig.1 Changes in leaf of two kinds of taro under drought stress
从图2 可以看出,随着干旱胁迫的加深,两种芋的气孔张开程度均变小,T24 气孔张开程度小于T22,3 种处理下单位面积气孔数T24 大于T22,T24 气孔密度大。如图3 所示,两种芋叶片表面分布有较多的蜡质,中度土壤水分胁迫90 d,两种芋叶片表面的蜡质含量最多,平均值分别为4.34 cm(T24-t1)和3.68 cm(T22-t1),重度土壤水分胁迫下最少,平均值分别为1.86 cm(T24-t2)和1.03 cm(T22-t2),与其他处理组之间差异显著,对照组中T24 叶片表面的蜡质与T22 对照组无显著差异,但T24 处理组中蜡质均高于T22,且从图中可见T24 处理组中的叶表细胞相对饱满,而T22 处理组中的叶表细胞则变得扁平皱缩,表明T24叶片可能具有更强的保水性。
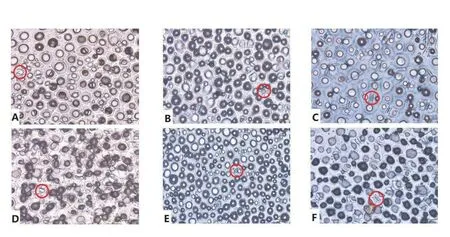
图2 利用指甲油观察气孔形态Fig.2 Stomatal morphology using nail polish
2.2 干旱胁迫下芋叶片MDA、H2O2和Pro含量变化
由图4可知,随着干旱胁迫程度加重和处理时间逐渐增长,两个芋品种叶片的MDA、H2O2和Pro含量在整个干旱处理过程中均表现出上升的趋势,且含量显著高于对照组,表明干旱加剧了MDA 的产生,促使膜系统的损伤和细胞的死亡,其中T22处理组的MDA和H2O2含量的上升幅度显著高于T24处理组,说明干旱胁迫对T22 细胞膜的损害程度更大,Pro 是一种重要的渗透调节物质,T24 处理组中Pro 含量上升幅度显著高于T22处理组,表明Pro可能在T24抗旱性中有着积极作用。

图4 干旱对芋叶片丙二醛(A)、过氧化氢(B)和脯氨酸(C)含量的影响Fig.4 Effects of drought on MDA(A),H2O2(B)and Pro(C)contents in taro leaves
2.3 干旱胁迫下芋叶片细胞膜保护系统重要相关酶活性变化
2.3.1 SOD 活性 SOD 是一种能够清除植物逆境胁迫中产生的活性氧自由基,从而减少其对植物细胞伤害的强氧化性蛋白酶,在植物响应逆境胁迫中增强植物抗逆性具有重要的作用[20]。由图5 可知,随着干旱处理时间增长,同一干旱胁迫水平,芋叶片SOD 活性总体呈现先上升后下降的趋势,同一干旱处理时间,不同干旱胁迫水平,芋叶片的SOD 活性呈现上升趋势,干旱处理组SOD 活性均大于对照组,其中T24叶片中SOD活性上升趋势最明显,且显著高于T22的SOD活性。
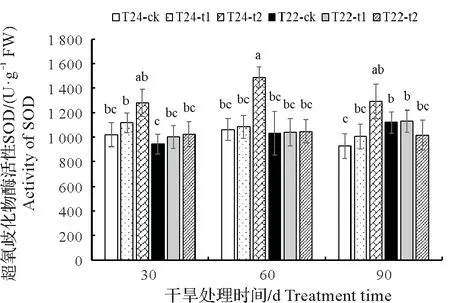
图5 干旱对芋叶片SOD活性的影响Fig.5 Effect of drought on SOD activity in taro leaves
2.3.2 CAT 活性 CAT 是一种酶类清除剂,可以清除体内的过氧化氢,从而使细胞免于遭受H2O2的毒害,是生物防御体系的关键酶之一,其活性与植物抗逆性密切相关[21]。如图6 所示,同一处理时间下,两种芋叶片中的CAT 活性均呈现上升趋势,其中T24 的上升幅度显著高于T22,随着干旱胁迫处理时间的延长,CAT活性在T24叶片中主要呈现先上升后下降的趋势,并在处理60 d时达到峰值,而T22则均表现上升趋势,但值低于T24。
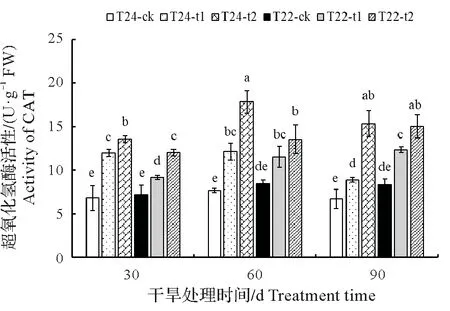
图6 干旱对芋叶片CAT活性的影响Fig.6 Effect of drought on CAT activity in taro leaves
2.3.3 POD 活性 POD 能将H2O2转化为水,加快活性氧的清除,同时氧化还原底物,是一种广泛存在于植物体中的氧化酶,具有提高植物抗性、减少逆境胁迫对植物体伤害的作用[22]。图7结果表明,相同水平的干旱胁迫程度下,随着处理时间的延长,T24处理组叶片的POD活性显著高于对照组,中度干旱T24处理组的POD 活性呈现上升趋势,而T22 处理组叶片的POD 的活性呈现出下降的趋势。中度干旱胁迫和重度干旱胁迫处理下T24叶片中的POD活性均大于T22叶片中的POD活性。
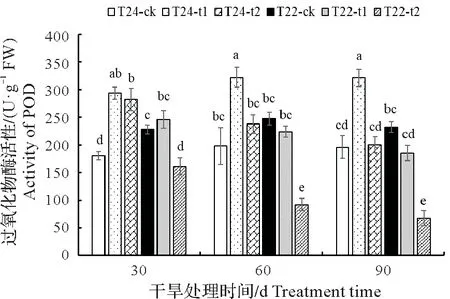
图7 干旱对芋叶片POD活性的影响Fig.7 Effect of drought on POD activity in taro leaves
2.3.4 APX 活性 APX 是植物活性氧代谢的重要抗氧化酶之一,可以清除叶绿体中的H2O2,参与维生素C 代谢,在植物抵御逆境胁迫中发挥着重要作用[23]。由图8可知,随着土壤干旱胁迫程度的增加,两种芋中的APX 的活性都呈现出上升的趋势,随着干旱胁迫处理时间的延长,APX 活性在30 d 达到了最大值,呈现出先上升后下降的趋势。其中T24的APX在土壤重度干旱胁迫才显著上升,而T22在两种土壤干旱胁迫水平都显著上调且高于同处理的T24。
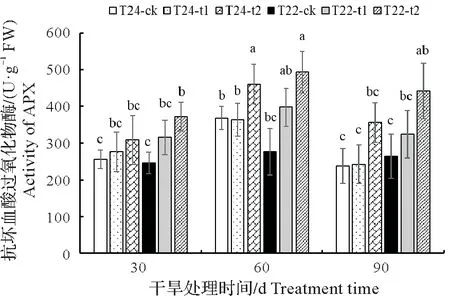
图8 干旱对芋叶片APX活性的影响Fig.8 Effect of drought on APX activity in taro leaves
2.3.5 GR 活性 GR 参与机体的氧化还原反应,是植物体氧化还原体系中最为重要的酶之一,可以清除活性氧,保护植物细胞的膜脂系统,减少逆境胁迫对其的伤害[24]。由图9 可知,同一干旱胁迫处理时间下,随着土壤干旱胁迫程度增强,两种芋叶片中的GR 活性均呈现上升趋势,随着干旱胁迫时间延长,土壤干旱程度越严重,T24 的GR 活性越强,而T22中的GR 活性先缓慢增加在下降,在干旱处理60 d 和90 d 时,T24 的GR 活性显著增加并超过T22的GR活性。

图9 干旱对芋叶片GR活性的影响Fig.9 Effect of drought on GR activity in taro leaves
2.4 干旱胁迫对两种芋采收后球茎产量和品质的影响
两种芋在结芋期受到干旱胁迫处理对其地下根系和球茎均有显著的影响,如图10、表2 所示,两种芋的根系随土壤干旱程度加重发生了不同程度的变化,T24 的根数量没有显著变化但T22的根数量显著减少,T24平均根系直径、平均根长、根长的增长幅度均显著大于T22。

表2 芋成熟期采收球茎产量及根系特征变化Tab.2 Corm yield and root system features changes of taro harvested at maturity

图10 芋成熟期采收后根系和球茎特征情况Fig.10 Root and corm characteristics of taro after harvesting at maturity
随着胁迫加深,芋球茎变得细长,节间变短,其中T22的节间缩短程度明显低于T24。与此同时两种芋在结芋初期受到干旱胁迫后,对成熟期采收的芋头产量和品质也具有不同程度的影响。T24与T22的单株子芋平均总数下降幅度分别为53.4%和52.4%(T24:26 个降低至12 个,T22:21 个降低至10 个),没有显著差异。T24-ck 与T22-ck 的芋子平均单球重量分别为28.81 g 和51.13 g,前者显著低于后者,干旱胁迫之后,T24 和T22 的芋子平均单球重均呈现下降趋势,可T24-t1 和T24-t2 与对照组相比下降幅度不大,在重度胁迫下,T24-t2的芋子平均单球重为20.31 g,仅比对照组少8.5 g,T22-t2的芋子平均单球重为23.55 g,却比对照组少27.58 g,其与对照组相比下降幅度分别为29.5%和53.9%,差异显著。与芋子数量和单球重量密切相关的单株芋子平均产量,在两种芋中均表现显著下降的趋势,但仍是T22下降的幅度最大,重度干旱胁迫处理组的单株产量仅为对照组的21.9%,而T24-t2的为对照组的32.1%。
干旱胁迫后不仅球茎(芋头)产量受到了严重的影响,重要品质营养物质也受到了不同程度的影响。如表3所示,随着干旱胁迫程度加重,两种芋的淀粉含量随干旱处理时间延长呈现显著下降,而纤维素、可溶性总糖、维生素C和可溶性蛋白质含量呈现先上升后降低的趋势。

表3 芋成熟期球茎重要品质变化Tab.3 Important quality changes in taro corms at maturity
3 讨论与结论
水分是限制芋生产的主要因素之一,干旱胁迫严重地制约着芋植株生长发育,影响着芋的产量和品质。叶片是植物光合作用最集中的器官,也是蒸腾作用最大的器官,叶片的大小、形状、表面蜡质等特征与植物本身的抗旱性有显著的相关性,前人研究表明干旱地区的植物降低叶片的叶面积有助于降低蒸腾,提高水分利用效率,从而使自身在高温、干旱的环境下获取稳定的适应能力[25],人为干旱胁迫处理植物后,其根系、株高、茎数、叶片的厚度和大小等重要性状也会受到严重的影响[26-27]。本研究中两种芋在受到干旱胁迫处理后,其叶片面积、叶片数量、植株高度等形态指标均显著下降,芋头成熟采收后节间变短,但根系变得更加发达,表明芋在生长期间受干旱胁迫,严重地限制了芋的茎叶生长,促进根系生长,提高根冠比以适宜干旱胁迫。与Mabhaudhi等[9]和Ganança等[10]研究结论相比,本研究结论进一步系统地研究结芋期受干旱胁迫后的芋根系和叶片的变化。
根是植物最直接、快速感知土壤含水情况的器官,其结构特征在适应干旱环境时会发生变化,本研究试验中,T24 平均根系直径、平均根长大于野生型品种T22,可以看出T24 根系较为发达,深扎于土壤,在耐旱大豆的根系特性研究中也有相似情况[28],表明较为发达的根系能有效利用土壤水分,特别是土壤深处的水分,使T24 能更好地适应土壤干旱环境,从而提升其植株的抗旱能力。植物表皮蜡质层是植物自我防护的第一道屏障,对调控表皮渗透性、减少非气孔性水分丧失等起着重要作用[29]。一般认为,表皮蜡质的含量与厚度影响植物的水分蒸腾,植物的蜡质含量高其耐旱能力也较强[30]。本研究通过扫描电镜分析,发现芋叶片正背面均覆盖着致密的片状蜡晶体,其中背面蜡质分布多于正面,这更有利于叶片锁住水分,也可能通过堵塞气孔降低蒸腾作用。随着土壤干旱胁迫程度增加,蜡质含量先增加后降低,水分胁迫的进一步加剧可能导致芋植株体内相关保护机制遭到破坏,使得中度胁迫组的蜡质含量高于重度胁迫组,这与干旱胁迫处理后的玉簪叶片表面的蜡质含量变化基本相似[30],本研究中突变体T24 叶片的蜡质明显高于野生型T22 叶片的蜡质,表明蜡质含量的适量增加可以使芋植株具有更强的抗旱能力。气孔是植物进行气体交换的主要通道,控制气孔的开闭可以调节蒸腾作用中分水的散失。气孔开张度下降和气孔密度增大是植物对干旱环境响应的典型特征,在一定程度上,可以根据气孔自身的调节能力反映植物对干旱胁迫的抵抗能力[31]。本研究结果表明,随着干旱程度的加深,气孔张开程度逐渐变小,同一视野大小范围内气孔数目增多,其中各处理下T24 气孔张开程度小于T22,气孔密度大于T22,在文冠果不同耐旱种质资源中也有相似的气孔情况差异[32],表明干旱胁迫会引起气孔形态及数量变化。
MDA 是膜脂过氧化作用的产物之一,MDA 不断积累引起酶和细胞膜的破坏。H2O2是氧自由基的催化产物,高浓度的H2O2引起细胞死亡。本研究结果表明,两种芋叶片中的MDA 和H2O2的含量均随土壤干旱胁迫程度呈上升趋势,且含量显著高于对照组,表明干旱加剧了MDA 的产生,促使膜系统的损伤和细胞的死亡,这与干旱胁迫处理后的马铃薯叶片中MDA 和H2O2的含量变化趋势相似[33]。本研究中T22处理组的MDA和H2O2含量的上升幅度显著高于T24处理组,说明干旱胁迫对其细胞膜的损害程度更大。脯氨酸是植物中重要的渗透调节物质之一,在植物抗旱性方面有着积极作用[34],本研究发现T24 处理组中Pro 含量上升幅度显著高于T22 处理组,表明Pro 可能在T24 抗旱性中有着积极作用。SOD、CAT、POD、APX 和GR 是植物中重要的抗氧化酶,植物抗氧化酶相互协同作用可以提高植物抵抗活性氧的毒害和环境胁迫的能力,它们的活性通常与抗旱性呈正相关,本研究结果表明,两个芋品种叶片中的SOD、CAT和GR活性均随土壤干旱胁迫程度加剧呈现上升趋势,并随干旱胁迫处理时间延长呈现类似的先上升后降低或持续上升的趋势,且T24 叶片中SOD、CAT 的活性在干旱处理30 d 及60 d、GR 的活性在干旱处理60 d 及90 d 等时期均高于T22,这与耐旱性强的马铃薯和百合品种受干旱胁迫处理后SOD、CAT 和GR酶活性变化情况类似[34-35],表明芋在受到一定干旱胁迫后通过增加抗氧化酶活性来提高抗干旱能力,高活性的SOD、CAT和GR可能促进T24更加耐旱。
作物生长期间土壤干旱胁迫通常会造成作物的产量和品质下降[13,36],本研究结果表明在结芋期,两种芋受到干旱胁迫后,芋子平均单球重和单株芋子平均产量均显著下降,但耐旱品种T24的芋子平均单球重和单株芋子平均产量的下降趋势显著低于不耐旱的野生型品种T22,这与张海燕等[13]研究抗旱甘薯品种受干旱胁迫后减产幅度小于不抗旱品种的变化趋势基本一致。两种芋的淀粉含量随干旱处理时间延长呈现显著下降趋势,而纤维素、可溶性总糖、维生素C 和可溶性蛋白质含量呈现上升后降低的趋势,这与马铃薯和甘薯受干旱胁迫处理后品质相关代谢物的变化情况类似[15,37],表明适当中度干旱处理能提高芋头的品质,但在结芋期芋受到不同程度的干旱胁迫都会显著地降低芋头的淀粉含量,从而造成显著减产。因此,在芋的生产中,结芋期要注意保障芋生长所需灌水量,并且适当干旱处理有助于促进芋头产量和品质达到最佳平衡状态。
致谢:江西省人力资源和社会保障厅博士后科研择优资助项目(2021KY38)和江西省研究生创新专项资金项目(YC2020-S228)同时对本研究给予了资助,谨致谢意!

