泽陆蛙变态前后身体和器官大小及PHA-P反应的变化
伍 亮,王月妍,李文慧,刘志冲,梁艺博,杨华珍,许 梅,赵艺洋,张志强
泽陆蛙变态前后身体和器官大小及PHA-P反应的变化
伍 亮,王月妍,李文慧,刘志冲,梁艺博,杨华珍,许 梅,赵艺洋,张志强*
(安徽农业大学动物科技学院,合肥 230036)
为探究蝌蚪变态前后形态表型、内脏器官大小和免疫功能与特定生活史阶段的关系,测定了泽陆蛙()从37期蝌蚪发育至46期幼蛙,多个关键生活史阶段身体大小、内脏器官系数及对植物血凝素(phytohemagglutinin,PHA-P)的反应的变化。结果显示:(1)泽陆蛙的体重、体宽、尾长和体全长都从37期至40~41期升高,之后下降,至46期降至最低值(0.05);体长42~43期最高,显著高于37期和46期(0.05)。(2)肝、脂肪体和肾湿重系数都在44~45期最高,38~39期最低(0.05),而鳃或肺湿重系数37期显著高于其他发育阶段(0.05),消化道长度系数37期、38~39期和40~41期都显著高于42~43期、44~45期和46期(0.05),心和脾湿重系数均不随发育阶段而变化(0.05)。(3)对PHA-P的反应的最大反应值37期蝌蚪出现于注射后2 h,38~39和42~43期见于3 h,其他发育阶段见于4 h,42~43期蝌蚪显著高于38~39期蝌蚪和46期幼蛙(0.05)。从水生到陆生,泽陆蛙的形态表型变化先于内脏器官大小,以被延迟和下降的免疫功能为代价,影响其成功登陆。
泽陆蛙;变态发育;形态表型;内脏器官大小;植物血凝素
无尾两栖类的形态表型随变态发育进程而改变,受温度等多种外部环境因素影响,表现出发育可塑性[1-2]。内脏器官系数的变化与各自的功能相关,但因登陆前蝌蚪的个体较小、不易进行解剖操作,虽有一些研究,但多集中于消化器官[3-5],对其他器官的重建或改造过程研究较少[6-7]。近年来,随着蝌蚪采血技术和血涂片制作技术的进步[8-10],以及对植物血凝素(phytohemagglutinin,PHA-P)的反应等免疫刺激类技术的发展[11-12],关于蝌蚪变态前后血液中各型白细胞的百分比[5]及对PHA-P的反应的比较研究,逐渐引起了国内外学者的关注[11, 13-15]。其中,对PHA-P的反应这一指标,可整合性地反映动物体的免疫功能,已成功应用于蝌蚪的水位处理[16-17]、温度效应[18]和微塑料[12,19]处理等实验,是衡量蝌蚪免疫功能的一个良好指标。
泽陆蛙()为中国南方常见蛙类,隶属于无尾目(Anura)蛙科(Ranidae)叉舌蛙亚科(Dicroglossinae)陆蛙属。该蛙一年可多次产卵,其卵和蝌蚪对高温有较强的耐受能力[20]。成体泽陆蛙具有明显的两性异形现象[21],雌、雄性小肠湿重系数性别差异明显,也随季节而变化,但小肠长度系数却只有性别差异,无季节差异[22]。泽陆蛙蝌蚪的生长发育受密度制约,高密度显著降低蝌蚪的变态率,但对变态后的体重影响不明显[23]。本研究选取泽陆蛙变态前后的多个关键生活史阶段,比较了其身体和内脏器官大小及对PHA-P的最大反应值的变化,旨在从整体水平、器官水平和免疫功能变化的角度,为深入了解蝌蚪特定生活史阶段与其健康状态的关系提供基础数据。
1 材料与方法
1.1 蝌蚪采集和分期鉴定
2022年7月上旬,于安徽省合肥市蜀山区大蜀山国家森林公园某一临时性水塘(31°86′ N、117°19′ E)捕获泽陆蛙蝌蚪约200只。3 h内带回安徽农业大学动物科技学院动物生理生态学实验室,使用戈斯纳分期表,分类鉴定泽陆蛙的发育阶段[24],取处于37、38~39、40~41、42~43和44~45期的蝌蚪各8只;将44~45期蝌蚪置于8个10.2 L的玻璃缸(长×宽×高=30 cm×17 cm×20 cm)中饲养,控制水温为(24±1)℃,自然光照,水深为3 cm,使玻璃缸一侧倾斜,露出1/2的陆地环境,便于蝌蚪成功登陆,将登陆后尾部完全消失的幼蛙作为变态完成期幼蛙,即46期幼蛙,取样样本数也为8只。实验期间,每天定时投喂足量商品化饲料(粗蛋白≥42.0%,粗脂肪≥3.0%,赖氨酸≥1.8%,厦门健牌饲料有限公司),但44~45期蝌蚪几乎未见取食,每隔2天更换曝气24 h以上的自来水1次。
1.2 形态表型、对PHA-P的反应和内脏器官大小测量
用电子天平(赛多利斯科学仪器有限公司,± 0.000 1 g)称量37、38~39、40~41、42~43和44~45期蝌蚪及46期幼蛙的体重,瑞士产Tesa数显卡尺(瑞士Shopcal,150 mm,± 0.01 mm)测量其体长(自吻端至肛的长度)、体全长(自吻端至尾末端的长度)、体宽(体两侧的最大宽度)和尾长(自肛至尾末端的长度)。
对PHA-P的反应的测定,采用从注射前(0 h)至注射后9 h内逐小时测定的方法,PHA-P抗原溶液的注射浓度为2.5 g·L-1,注射剂量为20 μL[12]。参照黑斑侧褶蛙蝌蚪和幼蛙的处理方式,用25 μL的微量进样器(上海安享微量进样器厂)在37、38~39和40~41期蝌蚪的尾根部、42~43和44~45期蝌蚪及46期幼蛙的左后肢大腿根部进行PHA-P抗原溶液注射,右后肢大腿根部不注射任何物质,注射前后均用70%医用酒精消毒[15]。每一测量时间点连续测量被注射部位的厚度3次,取3次测量的平均值,该过程始终由同一人完成。PHA-P反应(%)=[某一时间点尾根部或大腿根部被注射部位的厚度(mm)﹣0 h时尾根部或大腿根部的厚度(mm)] × 100/0 h时尾根部或大腿根部的厚度(mm)。
测定完PHA-P反应后,在体视解剖镜下解剖蝌蚪,小心取出心、肝、鳃或肺、脾、脂肪体和肾,测量每个器官的湿重(± 0.000 1 g);取出消化道,测量其长度(± 0.01 mm)。器官湿重系数(%)=器官湿重(g)× 100/体重(g);消化道长度系数(%)=消化道长度(cm)× 100/体全长(cm)。
1.3 统计分析
用统计分析软件SPSS软件包(SPSS 19.0 for windows)进行数据处理。以单因素方差分析(one-way ANOVA)比较不同发育阶段的身体大小、器官湿重系数和消化道长度系数及对PHA-P的反应的最大值的组间差异。以发育阶段为组间因子,注射前后的10个测量时间点(0 h至9 h)为组内因子,用重复测量方差分析(repeated measurement ANOVA)比较发育阶段和时间点对PHA-P的反应的影响,以及同一时间段内不同测量时间点之间对PHA-P的反应的差异。文中数值均以平均值±标准误(Mean±SE)表示,< 0.05为差异显著。
2 结果与分析
2.1 泽陆蛙变态前后身体大小的变化
泽陆蛙蝌蚪的体重(< 0.05,图1(a))、体宽(< 0.05,图1(b))、尾长(< 0.05,图1(c))和体全长(< 0.05,图1(d))的变化趋势相同,都从37期至40~41期升高,之后下降,至46期降至最低值;体长(< 0.05,图1(e))42~43期最高,显著高于37期和46期。
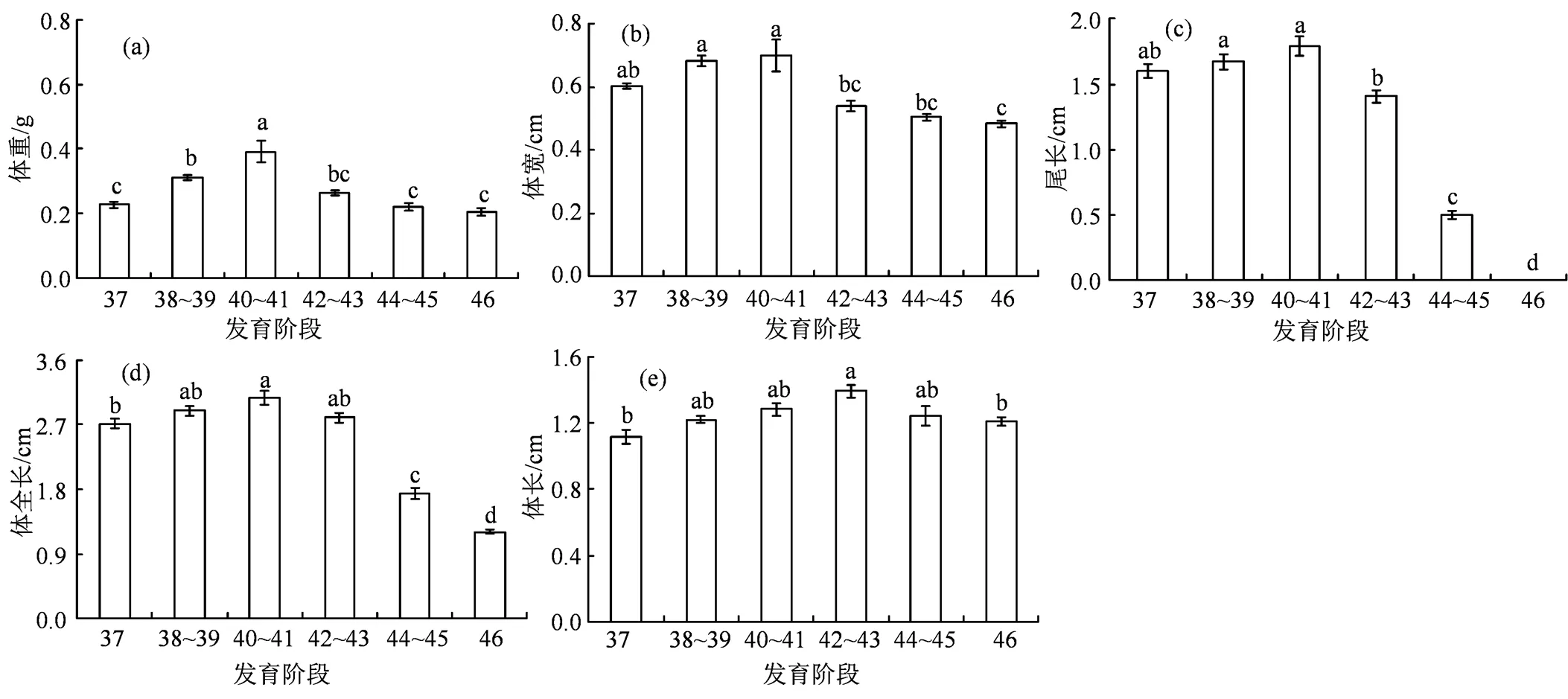
柱形上不同小写字母表示组间差异显著(a>b>c>d)。
Figure 1 Changes of body mass (a), body width (b), tail length (c), total body length (d) and snout to vent length (e) before and after metamorphosis in
2.2 泽陆蛙变态前后内脏器官大小的变化
泽陆蛙变态前后的心(> 0.05,图2(a))和脾脏湿重系数(> 0.05,图2(b))均无显著性差异。肝湿重系数(< 0.05,图2(c))44~45期最高,46期其次,都显著高于38~39期;鳃或肺湿重系数(< 0.05,图2(d))37期显著高于其他发育阶段;肾湿重系数(< 0.05,图2(e))44~45期最高,46期其次,都显著高于37期、38~39期和40~41期;脂肪体湿重系数(< 0.05,图2(f))44~45期最高,显著高于其他发育阶段。消化道长度系数(< 0.05,图2(g))37期、38~39期和40~41期都显著高于42~43期、44~45期和46期。
2.3 泽陆蛙变态前后对PHA-P的反应模式及其最大反应值的变化
37期(图3(a))、38~39期(图3(b))、40~41期(图3(c))、42~43期(图3(d))、44~45期蝌蚪(图3(e))和46期幼蛙(图3(f))对PHA-P的反应模式相似,都呈现出先升后降的趋势,最大反应值分别出现于注射后2 h、3 h、4 h、3 h、4 h和4 h(图3(a)—(f)),42~43期蝌蚪显著高于38~39期蝌蚪和46期幼蛙(< 0.05,图4)。
37期蝌蚪注射后2 h达到最大值,1 h、3 h、4 h和5 h其次,2 h显著高于0 h、6 h、7 h、8 h和9 h(< 0.05,图3(a));38~39期蝌蚪注射后3 h达到最大值,2 h和4 h其次,都显著高于0 h、8 h和9 h(< 0.05,图3(b));40~41期蝌蚪4 h显著高于0 h、8 h和9 h(< 0.05,图3(c));42~43期蝌蚪3 h显著高于0 h、6 h、7 h、8 h和9 h(< 0.05,图3(d));44~45期蝌蚪4 h显著高于0 h、7 h、8 h和9 h(< 0.05,图3(e));46期幼蛙4 h显著高于0 h、6 h、7 h、8 h和9 h(< 0.05,图3(f))。

柱形上不同小写字母表示组间差异显著(a>b>c)。
Figure 2 Changes of internal organ size before and after metamorphosis in
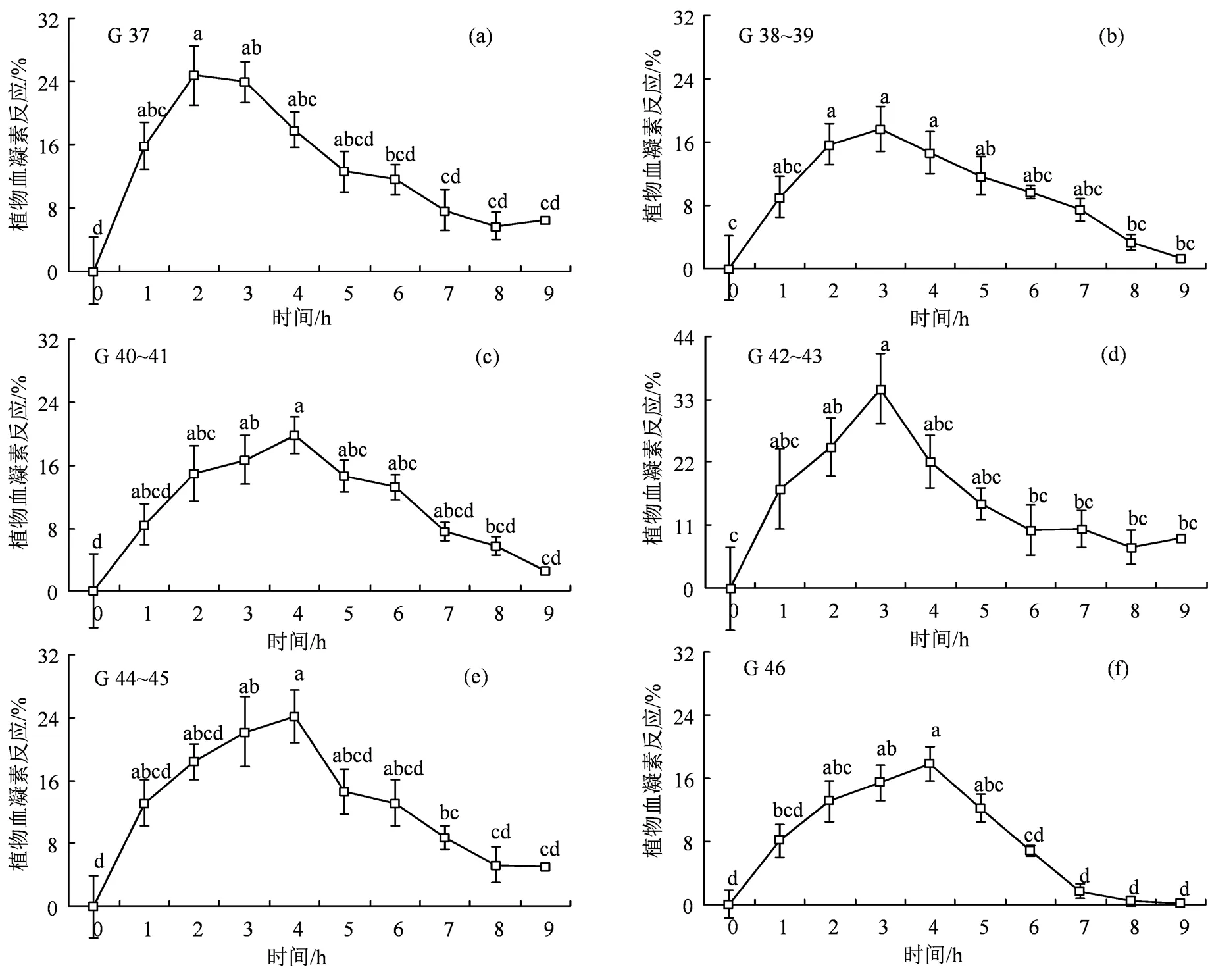
G,戈斯纳蝌蚪分期;不同小写字母表示组间差异显著(a>b>c>d)。
Figure 3 Responsiveness to phytohemagglutinin (PHA-P) before and after metamorphosis in
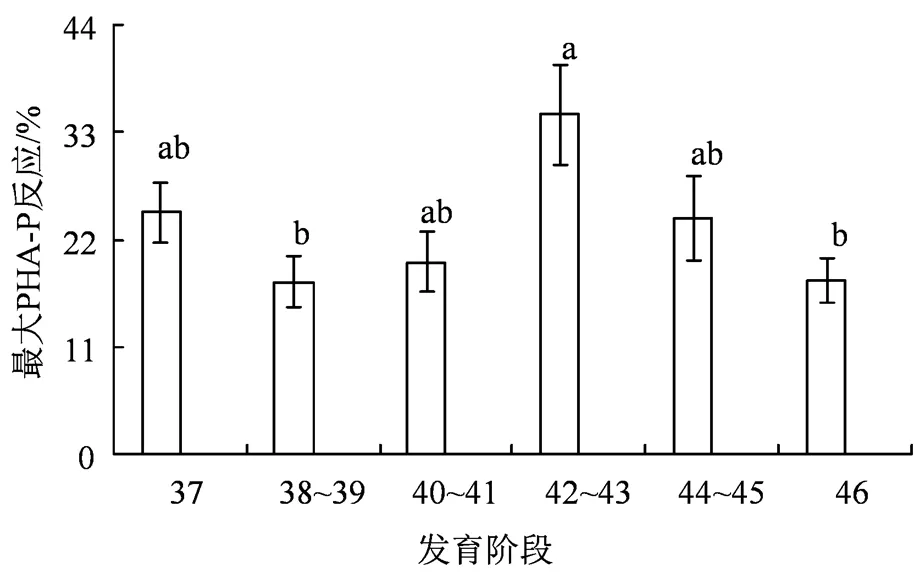
柱形上不同小写字母表示组间差异显著(a>b)。
Figure 4 Comparisons of maximal value of responsiveness to phytohemagglutinin (PHA-P) before and after metamorphosis in
3 讨论
3.1 泽陆蛙变态前后身体和内脏器官大小的适应性改变
无尾两栖类个体发育过程中,因蝌蚪个体较小、不易解剖,关于形态表型的比较研究多侧重于体重、体长和尾长等指标,可部分指示动物体的营养和生理状态[5,7]。通常情况下,无尾两栖类个体的胚后发育包括变态前期(26~37期)、临近变态期(38~39期)、变态高峰期(40~45期)和变态完成期(46期)4个时期[25]。泽陆蛙蝌蚪的体重、体宽、尾长和体全长都从变态前期至变态高峰期的初始阶段(40~41期)逐渐攀升,之后下降,46期时最低;体长在42~43期时最高,显著高于37期和46期。从37至46期,黑斑侧褶蛙的体重无显著差异,体全长、尾长和体长均随发育进程而缩短[15];从28至46期,花背蟾蜍()的体重、体全长和尾长先升后降,而体长则一直呈上升趋 势[5]。尽管身体大小变化不同,但蝌蚪尾部均在变态前期和临近变态期逐渐变长,在变态高峰期迅速萎缩,至变态完成期完全消失;尾部逐渐变大所积累的能量在变态高峰期重新分配给各内脏器官,促进了器官重建或改造过程的完成[6-7]。
从37至46期,泽陆蛙呼吸器官经历了显著的重建过程,由内鳃转变为肺,鳃的湿重系数37期时最高,此后显著下降,46期时出现了雏型的肺,说明内鳃转变为肺可能是从38~39期开始的。消化器官大小改变与变态前后蝌蚪食性转换相关,中华蟾蜍蝌蚪消化道38期最长,但肝湿重系数变化不显著,肝细胞密度显著增大[3];变态发育前后,花背蟾蜍蝌蚪的小肠长度和湿重均在38期最高,而肝湿重从28期至45期逐渐增加,至46期时下降[5]。泽陆蛙消化道长度系数37期、38~39期和40~41期都显著高于42~43期、44~45期和46期,肝湿重系数都在44~45期最高,这与花背蟾蜍的变化趋势相似。一般认为,无尾两栖类蝌蚪时期以脂肪体作为主要脂肪储备器官,肾主要执行渗透压调节和排出代谢废物的功能,泽陆蛙脂肪体和肾湿重系数都在44~45期最高,46期有所下降,提示登陆后能量消耗支出增加,但排泄系统的功能并不与之完全匹配,同时心、脾湿重系数也无明显变化,这可能与泽陆蛙常温下从卵发育至幼蛙约需30~40 d的较短的生活史历程有关,短时间内器官的重建和改造过程可能会损害登陆后幼蛙的健康,并以生理功能下降作为代价。
3.2 泽陆蛙变态前后对PHA-P的最大反应值和反应模式的变化
常用注射PHA-P抗原溶液前(0 h)和注射后不同测量时间点被注射部位皮肤组织的增厚程度来反映脊椎动物细胞介导的免疫能力的高低,后被认为不但能激发嗜中性粒细胞等白细胞的活性,也能激发淋巴细胞的活性,因此被认为是衡量脊椎动物免疫水平的一个整合性指标,具有价格适宜、便于操作和重复性好,以及对动物体伤害较小等优点[26-28]。个体较大的成体两栖动物多以0 h和注射后6 h、12 h、24 h、48 h和72 h为测量时间间隔[13, 29-30],蝌蚪、幼蛙和个体较小的两栖动物成体常以0 h和注射后3 h、6 h、9 h和12 h为测量时间间隔[2, 14],或者针对特定时间段进行细化测量[31];最近,也有研究每间隔1 h测量一次,为更为准确地鉴定反应时间点提供了新的实验证据[12,18,32]。
以3 h为测量时间间隔,黑斑侧褶蛙37~43期蝌蚪对PHA-P反应的最大值都出现于注射后3 h,44~46期都出现于注射后6 h,但各发育阶段之间均无明显的组间差异[2],而花背蟾蜍37、42和44期蝌蚪和46期幼蛙也在注射后3 h达到最大值,但37期蝌蚪显著高于46期幼蛙[14]。然而,以1 h为测量时间间隔,与25℃的对照组相比,在8℃条件下暴露5 d和10 d后,黑斑侧褶蛙46期幼蛙对PHA-P的反应的最大值虽无明显的组间差异,但分别出现于注射后3 h、3 h和4 h,说明随着低温暴露时间的延长,PHA-P反应峰值趋向于延迟出现[18];经聚苯乙烯暴露和清除处理后,暴露浓度增加不抑制黑斑侧褶蛙蝌蚪的免疫功能,但蝌蚪对PHA-P的反应随清水清除时长而变化,具有提前或延迟效应,潜在危害蝌蚪健康[12]。处于不同发育阶段的泽陆蛙也采用了间隔1 h来测定PHA-P反应,发现37期蝌蚪对PHA-P的反应的最大值出现于注射后2 h,38~39和42~43期都出现于3 h,其他发育阶段都出现于4 h,42~43期显著高于38~39期和46期,说明增加测量时间点有助于精准确定PHA-P反应峰值出现的时间点,为更好地应用该指标提供了新的实验证据。泽陆蛙登陆后被延迟发生且下降的PHA-P反应,不利于其适应多变的陆地环境,可能是导致其变态存活率低的主要原因之一。
[1] 刘莉, 李成, 李乃兵, 等. 不同水温条件下中华蟾蜍蝌蚪的表型可塑性研究[J]. 四川动物, 2006, 25(2): 214-217.
[2] 张志强, 王佳慧, 金冰艳, 等. 温度对黑斑侧褶蛙变态时长及PHA-P反应的影响[J]. 生态学杂志, 2021, 40(12): 4029-4033.
[3] 王念, 吴民耀, 王宏元, 等. 中华蟾蜍蝌蚪变态过程中消化系统的重构[J]. 西北农林科技大学学报(自然科学版), 2010, 38(12): 7-12.
[4] 王晓旭, 李丕鹏, 高凤娟, 等. 花背蟾蜍蝌蚪胃的发育形态学观察[J]. 动物学杂志, 2015, 50(6): 875-885.
[5] 连丽燕, 高慧清, 孙嘉珞, 等. 变态前后花背蟾蜍蝌蚪消化器官大小及各型白细胞百分比的适应性变化[J]. 生态学杂志, 2018, 37(4): 1204-1210.
[6] DENVER R J. Proximate mechanisms of phenotypic plasticity in amphibian metamorphosis[J]. Am Zool, 1997, 37(2): 172-184.
[7] PATMANN M D, SHEWADE L H, SCHNEIDER K A, et al. Xenopustadpole tissue harvest[J]. Cold Spring Harb Protoc, 2017, 2017(11): 870-879.
[8] DAVIS A K, MANEY D L, MAERZ J C. The use of leukocyte profiles to measure stress in vertebrates: a review for ecologists[J]. Funct Ecol, 2008, 22(5): 760-772.
[9] DAVIS A K, MANEY D L. The use of glucocorticoid hormones or leucocyte profiles to measure stress in vertebrates: what’s the difference?[J]. Methods Ecol Evol, 2018, 9(6): 1556-1568.
[10] 张志强, 杨雨晴, 陈利, 等. 水温升高对黑斑侧褶蛙蝌蚪变态时长和血液参数的影响[J]. 安徽农业大学学报, 2022, 49(2): 254-258.
[11] ZAMORA-CAMACHO F J. Integrating time progression in ecoimmunology studies: beyond immune response intensity[J]. Curr Zool, 2019, 65(2): 205-212.
[12] 刁迎珠,裴鑫怡,王萍,等.荧光聚苯乙烯微球对蝌蚪应激水平和免疫功能的影响[J].生态学杂志, 2023, 42(5): 1142-1149.
[13] BROWN G P, SHILTON C M, SHINE R. Measuring amphibian immunocompetence: validation of the phytohemagglutinin skin-swelling assay in the cane toad,[J]. Methods Ecol Evol, 2011, 2(4): 341-348.
[14] 高慧清, 张琼文, 孙思琪, 等. 变态期花背蟾蜍蝌蚪对植物血凝素的反应模式及其生态学意义[J]. 生态学杂志, 2017, 36(9): 2542-2548.
[15] 张志强, 王泽洋, 许洋溢, 等. 黑斑侧褶蛙变态前后身体大小的变化及对植物血凝素的反应模式[J]. 安徽农业大学学报, 2020, 47(4): 519-523.
[16] GERVASI S S, FOUFOPOULOS J. Costs of plasticity: responses to desiccation decrease post-metamorphic immune function in a pond-breeding amphibian[J]. Funct Ecol, 2008, 22(1): 100-108.
[17] 伍亮, 高歌, 史爽, 等. 水位变化影响蝌蚪存活、形态表型和植物血凝素反应[J]. 应用生态学报, 2022, 33(12): 3427-3432.
[18] 李诺,伍亮,张志强.低温对黑斑侧褶蛙变态和植物血凝素反应的影响[J].水产养殖,2023,44(5):41-43.
[19] 刁迎珠, 郭飞燕, 李雅琦, 等. 聚苯乙烯暴露和清除对黑斑侧褶蛙蝌蚪身体大小和脏器系数的影响[J]. 动物学杂志, 2022, 57(3): 429-439.
[20] 费梁, 胡淑琴, 叶昌媛, 等. 中国动物志·两栖纲·下卷·无尾目·蛙科[M]. 北京: 科学出版社, 2009.
[21] 施林强, 毛飞, 马小梅. 密度对泽陆蛙蝌蚪生长发育和变态的影响[J]. 杭州师范大学学报(自然科学版), 2011, 10(5): 429-434.
[22] 王宇, 陈超, 王晓旋, 等. 泽陆蛙消化道系数的性别差异和季节弹性[J]. 浙江师范大学学报(自然科学版), 2019, 42(1): 74-80.
[23] 施林强, 张秀琴, 马小梅. 泽陆蛙()两性异形的个体发育和雌体繁殖[J]. 生态学杂志, 2011, 30(4): 717-723.
[24] GOSNER K. A simplified table for staging anuran embryos and larvae with notes on identification[J]. Herpetologica, 1960, 16: 183-190.
[25] MCDIARMID R W, ALTIG R. Tadpoles: the biology of anuran larvae[M]. Chicago, Ill.: University of Chicago Press, 1999.
[26] BROCK P M, MURDOCK C C, MARTIN L B. The history of ecoimmunology and its integration with disease ecology[J]. Integr Comp Biol, 2014, 54(3): 353-362.
[27] CLULOW S, HARRIS M, MAHONY M J. Optimization, validation and efficacy of the phytohaemagglutinin inflammation assay for use in ecoimmunological studies of amphibians[J]. Conserv Physiol, 2015, 3(1): cov042.
[28] BAKEWELL L, KELEHEAR C, GRAHAM S P. Impacts of temperature on immune performance in a desert anuran ()[J]. J Zool, 2021, 315(1): 49-57.
[29] ZHANG Z Q, JIN C C, QU K S, et al. Immune responsiveness to phytohemagglutinin displays species but not sex differences in three anuran species[J]. PeerJ, 2017, 5: e3181.
[30] 彭兵龙, 张昊滨, 陈可为, 等. 中华蟾蜍足垫部位对植物血凝素的反应及其组织学和血液学变化[J]. 动物学杂志, 2019, 54(1): 87-98.
[31] JOSSERAND R, TROÏANOWSKI M, GROLET O, et al. A phytohaemagglutinin challenge test to assess immune responsiveness of European tree frog[J]. Amphibia-Reptilia, 2015, 36(2): 111-118.
[32] ZAMORA-CAMACHO F J, COMAS M. Early swelling response to phytohemagglutinin is lower in older toads[J]. PeerJ, 2018, 6: e6104.
Variations of body and internal organ size, and responsiveness to phytohemagglutinin before and after metamorphosis in
WU Liang, WANG Yueyan, LI Wenhui, LIU Zhichong, LIANG Yibo,YANG Huazhen, XU Mei, ZHAO Yiyang, ZHANG Zhiqiang
(School of Animal Science and Technology, Anhui Agricultural University, Hefei 230036)
To explore the relationship between morphological phenotypes, internal organ size and immune function and specific life history phases before and after metamorphosis in rice frogs,, tadpoles at different developmental stages from Gosner 37-stage to Gosner 46-stage were sampled, and the variations of body size, internal organ index and the responsiveness to phytohemagglutinin (PHA-P) for multiple key life history phases were measured, respectively. The results were as follows: (1) The body mass, body width, tail length, and total body length was gradually increased from Gosner stage 37 to 40-41 tadpoles, and then declined with a minimum at Gosner stage 46 froglets (< 0.05). The snout to vent length showed the highest value at Gosner stage 42-43 tadpoles, which was significantly higher than that of Gosner stage 37 tadpoles and Gosner stage 46 froglets (< 0.05). (2) The wet mass index of livers, fat bodies and kidneys peaked at Gosner stage 44-45 tadpoles, all showed the minimum value at Gosner stage 38-39 tadpoles (< 0.05); The wet mass index of gill or lungs peaked at Gosner stage 37 tadpoles, which was significantly higher than that of any other developmental stage (< 0.05); The length index of digestive tract was greatly higher at Gosner stage 37, 38-39 and 40-41 tadpoles than that of Gosner stage 42-43 and 44-45 tadpoles and Gosner stage 46 froglets (< 0.05). No significant developmental stage differences were found for the wet mass index of heart and spleen (> 0.05). (3) The maximal value for the PHA-P response of Gosner stage 37, 38-39 and 42-43 tadpoles appeared 2 h, 3 h, and 4 h after injection, respectively, and 4 h after injection for any other developmental stage, which was significantly higher at Gosner stage 42-43 tadpoles than that of Gosner stage 38-39 tadpoles and Gosner stage 46 froglets (< 0.05). From aquatic to terrestrial environments, the variations of morphological phenotype occur prior to dramatic establishments and reconstruction of internal organ sizes in, delayed and decreased immune function may impact on their successful landing as a cost.
; metamorphosis development; morphological phenotype; internal organ size; phytohemagglutinin
S917.4
A
1672-352X (2023)05-0817-06
10.13610/j.cnki.1672-352x.20231030.001
2023-10-30 21:41:18
[URL] https://link.cnki.net/urlid/34.1162.S.20231030.0947.002
2022-08-03
安徽农业大学2021年度省级线下课程项目(2021xxkc039),校级质量工程培育项目一流教材项目(2021auyljc01),安徽农业大学2021年校级创新训练项目(XJDC202110364044)和2022年国家级(202210364096X)大学生创新创业训练项目共同资助。
伍 亮,硕士研究生。E-mail:1031847504@qq.com
张志强,博士,教授。E-mail:zzq-003@163.com

