艾塞那肽减轻卡那霉素加呋塞米诱导的小鼠螺旋神经元损伤*
邬红霞 欧阳曦 范肖霞 戴光炆 赵旭旭 陈弢 康厚墉
螺旋神经元(spiral ganglion neurons,SGNs)是内耳听觉神经元,将毛细胞传递的声音信号传导到脑干中的耳蜗核。人工耳蜗需要一定数量的SGNs才能发挥作用[1],因此预防或减轻感觉上皮细胞丢失后耳蜗神经纤维和SGNs的损伤是至关重要的。既往研究表明,使用渗透泵将外源性神经营养因子直接输送到耳蜗,可以改善因各种损伤引起的SGNs存活率[2];过表达凋亡抑制基因XIAP可以延缓小鼠耳聋的发展和减轻SGNs的损失[3]。这些方法有助于保存SGNs,但还需要进一步的证据来证明其有效性、特异性和安全性,仍然需要寻找理想的方法来防止耳聋后SGNs的变性退化。因此,探索防止SGNs损伤、促进SGNs修复的有效药物可以为听力损失提供新的治疗和预防策略。
高血糖素样肽-1受体(glucagon like peptide-1 receptor,GLP-1R)广泛表达于肺、胰腺、胃、肾、下丘脑和心脏等组织[4]。艾塞那肽(exendin-4)是一种39个氨基酸组成的多肽,它是一种GLP-1R激动剂,目前广泛用于2型糖尿病的临床治疗。越来越多的研究表明,艾塞那肽除了具有降糖作用外,还可能具有神经保护作用。艾塞那肽可以减轻红藻氨酸诱导的小鼠海马神经元死亡[5],减轻缺血缺氧性脑病的小鼠模型的脑组织损伤[6],在帕金森病等神经退行性疾病中具有神经保护作用[7]。然而GLP-1R是否在内耳神经细胞中表达,GLP-1R激动剂艾塞那肽对内耳神经细胞是否有作用尚无相关研究。
因此,本研究使用常见的耳毒性药物卡那霉素加呋塞米诱导小鼠螺旋神经元损伤,探讨艾塞那肽对螺旋神经元损伤的作用。
1 材料与方法
1.1实验动物及分组 实验动物C57BL/6J小鼠30只(8~10周龄,雄性)购于重庆医科大学实验动物中心。所有的动物都没有耳毒性药物损伤或噪声暴露史,都被安置在标准的实验室条件下。将小鼠随机分为3组,每组10只:卡那霉素加呋塞米组小鼠一次性腹腔注射硫酸卡那霉素1 g/kg,30~40 min后予以呋塞米0.4 g/kg腹腔注射;艾塞那肽组在卡那霉素和呋塞米注射前3 d开始给与腹腔注射艾塞那肽400 μg/kg,每天1次,直到给卡那霉素和呋塞米后第7 d,在给药后30天处死小鼠并进行下一步处理。空白对照组腹腔注射等量生理盐水。所有动物护理和实验方案均经重庆医科大学伦理委员会批准(伦理审批号:2022-K211)。
1.2主要试剂 硫酸卡那霉素购自北京酷来搏科技有限公司;艾塞那肽(exendin-4)购自美国MCE公司;呋塞米购自阿拉丁控股集团有限公司;GLP-1R抗体购自美国Abcam公司;Neurofilament-H抗体购自美国CST公司;HRP标记山羊抗鼠二抗、HRP标记山羊抗兔二抗购自北京正能生物技术公司;Alexa Fluor 594标记山羊抗兔二抗、Alexa Fluor488标记山羊抗鼠二抗购自北京中杉金桥生物技术有限公司;BCA试剂盒购自上海碧云天生物技术有限公司;胎牛血清购自美国GIBCO公司。
1.3实验方法
1.3.1验证GLP-1R在SGNs的表达
1.3.1.1SGNs的原代培养 生后3~5 d的C57BL/6J小鼠用75%的乙醇消毒处理后,从枕骨大孔根部处死小鼠,沿头颅矢状缝剪开,去除大脑组织。随后显微镜下在预先冷却的磷酸盐缓冲溶液(PBS)中进行以下步骤:挑开听泡,取出内耳,分离出蜗轴,在37℃下用0.25%胰酶消化30 min,1 000 rpm/min离心5 min后,将细胞悬液放入包被聚-L-赖氨酸的35 mm细胞培养板中。细胞在添加10%胎牛血清、2%青霉素的DMEM/F12培养液中维持,并将其置于37℃、5%CO2和95%空气中的培养箱中。
1.3.1.2免疫荧光染色 SGNs原代培养3 d后,接种至24孔板中继续培养2 d,接种密度约为75%。用磷酸盐缓冲液(PBS)清洗细胞2次,在室温下用4%多聚甲醛固定15 min。用0.25%Triton X-100处理15 min,然后用10%正常山羊血清封闭30 min。细胞与GLP-1R抗体(1∶200)、Neurofilament-H抗体(1∶200)在4℃孵育过夜。对照组使用PBS代替一抗。用PBS洗涤三次后,用Alexa Fluor 594标记山羊抗兔IgG二抗(1∶500)、Alexa Fluor488标记山羊抗鼠IgG二抗(1∶500)室温下孵育1 h。用含DAPI抗荧光淬灭封片液封片后,使用ZEISS荧光显微镜观察GLP-1R在SGN的表达。
1.3.1.3小鼠耳蜗切片及免疫组化染色 使用成年的C57BL/6J小鼠2只,使用戊巴比妥麻醉后处死,取下颞骨组织,使用EDTA脱钙液脱钙7 d后,用石蜡包埋组织后切片。切片放置在60℃烤箱3 h后,在二甲苯溶液中浸泡两次,每次15 min,依次在95%乙醇、85%乙醇、75%乙醇、50%乙醇中浸泡5 min。滴加4%过氧化氢孵育10 min。使用10%正常山羊血清封闭30 min。滴加GLP-1R(1∶100稀释)一抗,在4℃孵育过夜。用PBS洗涤切片三次后,用HRP标记的山羊抗兔二抗(1∶200稀释)在室温下孵育1 h。用苏木素复染5 min,盐酸酒精分化2 s,氨水反蓝2 min,依次在75%、85%、95%酒精中浸泡5 min,在二甲苯溶液中浸泡两次,每次15 min,使用中性树脂封片液封片。使用ZEISS显微镜经行观察GLP-1R在SGN的表达并拍照。
1.3.2小鼠耳蜗切片及HE染色 三组实验小鼠使用戊巴比妥麻醉后处死,取下颞骨组织,使用EDTA脱钙液脱钙7 d后,用石蜡包埋组织后切片。切片放置在60℃烤箱3 h后,在二甲苯溶液中浸泡两次,每次15 min,依次在95%乙醇、85%乙醇、75%乙醇、50%乙醇中浸泡5 min。苏木素染色8 min,PBS洗涤3次,使用盐酸酒精分化3 s,PBS洗涤后,使用氨水反蓝1 min。PBS洗涤后,85%酒精浸泡1 min,伊红染色2 min。依次在75%酒精、85%酒精、95%酒精中浸泡5 min,在二甲苯溶液中浸泡两次,每次15 min,使用中性树脂封片液封片。使用ZEISS显微镜经行观察各组SGN的形态变化并拍照。对耳蜗切片中回SGNs进行计数,随机选取3个相同大小区域计算SGNs平均数量。
1.3.3免疫印迹实验(Western blot) 耳蜗组织蛋白提取:将耳蜗置于PBS中漂洗两次,弃去 PBS后加入裂解液将其置于冷冻高速研磨机中研磨,使用配好的RIPA+PMSF溶液在冰上裂解30 min,每5 min混匀一次,12 000 rpm/min,4℃离心15 min,取上清,使用BCA试剂盒检测蛋白质浓度。加入上样缓冲液后,100℃煮15 min,冷却后冻存备用。免疫印迹实验:取蛋白样品进行电泳,电泳结束后将分离好的蛋白条带转移至NC膜。用快速封闭液室温封闭30 min,然后加入一抗在4℃摇床过夜。第2日使用TBST缓冲液漂洗蛋白条带,加入二抗,室温孵育1 h,TBST漂洗后,用ECL试剂盒显像,采集图像后,ImageJ软件分析各组GLP-1R及凋亡相关蛋白Cleaved-caspase-3、Bax及Bcl-2的表达灰度值,使用β-actin作为内参蛋白。
1.4统计学方法 数据采用单因素方差分析(ANOVA),使用ImageJ软件分析进行灰度值分析,使用用SPSS13.0软件包进行统计计算。P<0.05为差异有统计学意义。
2 结果
2.1GLP-1R在SGNs的表达 免疫荧光检测SGNs是否表达GLP-1R,结果显示,DAPI标记的细胞核在紫外光下呈现蓝色,Neurofilament-H标记的SGNs在蓝光下呈现绿色。表达GLP-1R的细胞在绿光下呈现红色荧光。在同一视野下,分别用绿光、蓝光、紫外光激发后,可见GLP-1R表达于SGNs(图1)。
小鼠耳蜗切片免疫组化染色观察,进一步验证了GLP-1R在SGNs上的表达(图2)。
2.2艾塞那肽对SGNs损伤的保护作用 各组小鼠耳蜗石蜡切片HE染色可见:对照组SGNs排列紧密,卡那霉素加呋塞米组SGNs细胞密度下降,细胞质肿胀,部分细胞边界不清,艾塞那肽组SGNs细胞密度有所恢复(图3)。对照组、卡那霉素加呋噻米组、艾塞那肽组SGNs计数分别为11.6±0.58、5.0±1.0、9.33±1.52个,与对照组相比,卡那霉素加呋塞米组耳蜗SGNs数量下降(P<0.05),艾塞那肽组SGNs细胞数量有所恢复(P<0.05)。
2.3各组耳蜗组织的Western blot结果 与对照组相比较,卡那霉素加呋塞米组GLP-1R蛋白表达降低,促凋亡蛋白Cleaved-caspase-3、Bax蛋白水平升高,抗凋亡蛋白Bcl-2表达水平下降;艾塞那肽组GLP-1R蛋白表达较卡那霉素加呋塞米组升高,Cleaved-caspase-3、Bax表达降低,Bcl-2表达升高(图4、表1)。

图4 各组耳蜗组织GLP-1R、Cleaved-caspase-3,Bax以及Bcl-2蛋白表达 a. 与对照组相比,卡那霉素加呋塞米组GLP-1R表达水平下降,艾塞那肽组GLP-1R表达水平较卡那霉素加呋塞米组升高; b. 与对照组相比,卡那霉素加呋塞米组Cleaved-caspase-3、Bax蛋白水平升高,Bcl-2表达水平下降,艾塞那肽组Cleaved-caspase-3、Bax表达较卡那霉素加呋塞米组降低,Bcl-2表达升高
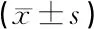
表1 各组耳蜗组织中GLP-1R、Cleaved-caspase-3、Bax、Bcl-2与β-actin蛋白灰度值比值比较
3 讨论
袢利尿剂呋塞米可以造成蜗管外壁血管纹缺血缺氧,导致内耳血-迷路屏障破坏,同时使用卡那霉素可以使药物经暂时开放的蜗管外壁进入耳蜗淋巴液,导致内耳毛细胞和耳蜗支持细胞损害,引起SGNs及其神经纤维的退行性改变[8]。单次大剂量注射卡那霉素(1 g/kg)和呋塞米(0.4 g/kg),可以通过破坏耳蜗感觉上皮细胞诱导小鼠SGNs变性死亡[9,10]。故本研究使用卡那霉素加呋塞米造成小鼠SGNs的损伤。结果,小鼠耳蜗切片显示经过卡那霉素加呋塞米处理的小鼠骨螺旋板内SGNs变性、数量减少;而使用艾塞那肽处理的小鼠骨螺旋板内SGNs变性减轻、数量有所增加。但并不清楚艾塞那肽是减轻了SGNs的损伤,还是促进了SGNs损伤后的修复。研究表明,艾塞那肽能改善缺血再灌注的视网膜微血管内皮功能[11],能保护血脑屏障并减少脑缺血引起的脑部炎症[12]。由于GLP-1R表达的广泛性,尽管本文未研究GLP-1R在内耳血管的表达情况,推测艾塞那肽可能通过减轻血管纹的损伤而降低卡那霉素对内耳细胞的伤害。
GLP-1R是GLP-1及其类似物在体内作用的主要靶点,GLP-1R是一种7次跨膜的G蛋白偶联受体,GLP-1及其类似物与GLP-1R结合导致GLP-1R构象转换,从而导致一系列转导因子和下游信号的相互作用[13]。艾塞那肽作为GLP-1的类似物,是GLP-1R完全激动剂,其与GLP-1R亲和力强且不易被内源性GLP-1降解酶DPP-4酶降解[14]。本研究中免疫印迹实验显示卡那霉素加呋塞米组小鼠耳蜗组织GLP-1R蛋白表达降低,而使用艾塞那肽干预后GLP-1R蛋白表达有所提升。艾塞那肽通过介导GLP-1R构象的改变而产生作用[13,15],本研究中GLP-1R表达的变化,可能是由于艾塞那肽减轻了内耳细胞损伤的同时减少了GLP-1R的丢失。
研究报道卡那霉素会诱导SGNs的凋亡[16],而艾塞那肽可以通过降低Bax/Bcl-2比值和抑制细胞色素C的释放来抑制海马神经元的凋亡[7],因此,本研究检测了凋亡相关蛋白在各组耳蜗组织中的表达变化。免疫印迹实验结果显示,卡那霉素加呋塞米组小鼠耳蜗组织促凋亡蛋白Cleaved-caspase-3、Bax表达升高,抑凋亡蛋白Bcl-2表达降低;而使用艾塞那肽干预后部分逆转了这种结果,提示艾塞那肽可能减轻卡那霉素加呋塞米诱导的SGNs损伤,其机制可能与艾塞那肽减轻了SGNs凋亡有关。
综上所述,本研究表明,GLP-1R在SGNs有表达,GLP-1R激动剂艾塞那肽可能通过减轻细胞凋亡,拮抗卡那霉素加呋塞米诱导的螺旋神经元损伤。因此,GLP-1R激动剂有望成为听神经保护的药物,为耳聋的防治提供新的研究方向。然而本研究尚有不足之处:首先,尽管目前已证实艾塞那肽是不同细胞类型GLP-1R的有效激动剂,若能加上GLP-1R拮抗剂处理或者敲除GLP-1R基因,实验结果将更有说服力;其次,艾塞那肽是通过何种途径起作用,以及其对下游通路如何调控,有待进一步研究。

