MRI扫描技术对宫颈癌精准分期及同步放化疗疗效的预测价值分析*
王美华 石德峰 张洁 胡醒
(保定市第一中心医院医学影像二科,河北 保定 071000)
宫颈癌是目前唯一一个病因明确的妇科恶性肿瘤,与人乳头状瘤病毒感染有关,因本病早期症状无明显特异性,在临床诊断时易造成漏诊或误诊,使患者错过最佳治疗时机,随病情发展到晚期会出现阴道出血、全身衰竭等症状[1],严重威胁患者生命健康。同步放化疗作为宫颈癌患者首选的治疗途径,可促进肿瘤细胞的凋亡,增强治疗效果,延长生存期。但在临床治疗中,进展期患者经同步放化疗后仍存在较大的复发、转移风险,导致总体疗效欠佳,预后不良[2]。故早期对宫颈癌患者分期进行评估并准确预测其同步放化疗疗效现已成为临床重点关注热点。以往通过阴道镜下宫颈组织病理活检对宫颈癌进行检查诊断[3],但因该方法创伤性较大,患者接受度不高,使其临床应用受到一定限制。而磁共振成像(Magnetic resonance imaging,MRI)扫描技术具有较高的分辨率和敏感度,可将肿瘤大小、位置及侵袭范围清晰的显示出来,现已成为诊断宫颈癌患者的常用方式之一[4-5]。因此,本研究探讨了MRI扫描技术对宫颈癌精准分期及同步放化疗疗效的预测价值。
1 资料与方法
1.1 一般资料 选取2019年2月—2021年2月我院收治的经病理证实为宫颈癌且未进行同步放化疗的63例患者作为研究对象,年龄31~56岁,平均(43.53±4.42)岁;鳞癌31例,腺癌19例,腺鳞癌13例;经病理学检查T1:24例,T2:19例,T3:12例,T4:8例;N0:29例,N1:21例,N2:13例。纳入标准:①所有患者均符合宫颈癌诊断标准[6],且经病理学检查确诊为宫颈癌。②预计生存时间>6个月。③患者及家属知情并签署知情同意书。排除标准:①存在影像学禁忌者或对同步放化疗药物过敏者。②存在重要脏器病变者。③存在其他恶性肿瘤疾病者。④存在免疫系统疾病者。⑤入组前近一个月接受过手术、药物治疗或放化疗等。本研究经医院伦理委员会审核通过(审批号:20190322)。
1.2 方法
1.2.1 治疗方法 所有患者均采用同步放化疗2个月。①放疗:盆外照射:调强适形放疗,剂量分布情况利用三维治疗计划系统计算,总剂量为45~50 Gy,计量分割1.8~2.0 Gy,计划靶区边缘的处方剂量为45 Gy,1次/d,5次/周,若有淋巴转移者,则加量至50~60 Gy。腔内治疗:采用192Ir高剂量精确放疗系统进行近距离的放疗,参照点为A点(宫颈外口上方及中线旁2 cm处),总剂量为30 Gy,3.0~5.0 Gy/次,1次/d,共5次。对于阴道残端阳性、阴性者总剂量分别为40.0~45.0 Gy、25.0~30.0 Gy。②化疗:在放疗期间同步进行化疗,即在开始放疗时静脉滴注顺铂(生产厂家:齐鲁制药有限公司,批准文号:国药准字H37021357,包装规格:20 mg)25 mg/m2+紫杉醇(生产厂家:哈药集团生物工程有限公司,批准文号:国药准字H20059962,包装规格:5 mL:30 mg)135 mg/m2,1次/周,每三周重复一次,与放疗同时结束。
1.2.2 检查方法 于患者入院次日及同步放化疗2个月后,采用西门子1.5T磁共振扫描仪进行盆腔常规MRI扫描,包括轴位T1WI,轴位、冠状位及矢状位 T2WI。矢状位T2WI扫描条件:视野(Field of View,FOV):32 cm×32 cm,TE:58 ms,TR:3500 ms,层厚:3 mm,层间距:1 mm,层数:20,激励次数:2次;轴位T1WI扫描条件:TR:440 ms,TE:10 ms,层数:20,层厚:5 mm,层间距:1.5 mm,激励次数:1;轴位扩散加权成像(Diffusion weighted imaging,DWI)扫描条件:FOV:260 mm×260 mm,TR:4400 ms,TE:63 ms,激励次数:4,层厚:4 mm,层间距:1 mm;矩阵:192×192,扩散敏感系数(b)为50,800 s/mm2。对比剂为钆特酸葡胺注射液,利用高压注射器注射对比剂,流速设置为3 mL/s,剂量位0.1 mmol/kg ,然后再次行MRI检查,进行常规轴位及冠状位的T1WI增强,TR:5.08 ms,TE:1.66 ms,层厚:5 mm,层间距:1.5 mm,FOV:309 mm×309 mm,矩阵:109×192,无屏气,共进行50期,每期扫描时间为6.3 s,从第3期开始扫描时注入对比剂。将得到的图像利用Tissue 4D 软件进行分析。采用双盲法,由2名经验丰富的影像科医生共同进行阅片分析,若2名医生意见不统一,则通过小组讨论做最后审定。通过View 工作站得到肿瘤扫描原始图像的层面,手动绘制类圆形感兴趣区(Region of interest,ROI),测量3次取其平均值作为 表观扩散系数(Apparent diffusion coefficient,ADC值)。在肿瘤明显强化区选择ROI为 30~50 mm2的,利用 Fast 动脉输入函数获得容量转移常数(Volume transfer constant,Ktrans)、回流速率常数(Flux rate constant,Kep)及容积分数(Fraction volume,Ve值)等参数,均测量3次取其平均值。分期判定:T1:T2WI图像无法显示或可见宫颈中间带低信号环消失或中断但外缘光整;T2:T2WI图像显示为高等信号,肿瘤向下侵犯较低信号的阴道上2/3处,或宫旁及弥漫或局灶性异常信号;T3:向下累及阴道的1/3处见异常高信号,或盆壁肌肉由低信号变为高信号;T4:膀胱或直肠出现异常信号;N0:MRI无明显变化; N1:T1W1等信号,T2W1稍高信号;N2:T2W1高信号,T1W1增强扫描呈轻度强化或环形强化。
1.3 观察指标 ①以病理检查为金标准,分析MRI扫描检查对宫颈癌分期的诊断价值。②于治疗2个月后根据世界卫生组织实体瘤评价标准[7]对患者的疗效进行评估,完全缓解(Complete remission,CR):所有病灶完全消失,肿瘤标志物水平下降至正常;部分缓解(Partial remission,PR):患者临床症状完全改善,病灶直径减少一半;稳定(Stabilization disease,SD):患者临床症状有改善,病灶直径增大<25%或缩小<50%;进展(Progress disease,PD):患者临床症状没有好转甚至加重,有新的病灶出现。总有效率= CR率+PR率。③根据患者疗效情况将其分为缓解组(n=45)和无效组(n=18),其中缓解组=CR+PR;无效组=SD+PD。对比两组肿瘤体积、Ktrans、Kep、Ve值及ADC值的变化情况。

2 结果
2.1 MRI与金标准对宫颈癌患者T分期的一致性分析 MRI检查与金标准对宫颈癌患者T分期的诊断一致性较高(Kappa=0.799,P<0.05)。见表1。
2.2 MRI与金标准对宫颈癌患者N分期的一致性分析 MRI检查与金标准对宫颈癌患者N分期的诊断一致性较高(Kappa=0.823,P<0.05)。见表2。

表2 MRI与金标准对宫颈癌患者N分期的一致性分析(n)
2.3 临床总有效率 经2个月的同步放化疗后,CR19例,PR26例,SD15例,PD3例,其临床总有效率为71.43%(45/63)。
2.4 治疗前后患者肿瘤体积及各参数值对比 治疗后患者的肿瘤体积、Ktrans、Kep、Ve均显著低于治疗前,ADC明显高于治疗前(P<0.05)。见表3、图1。
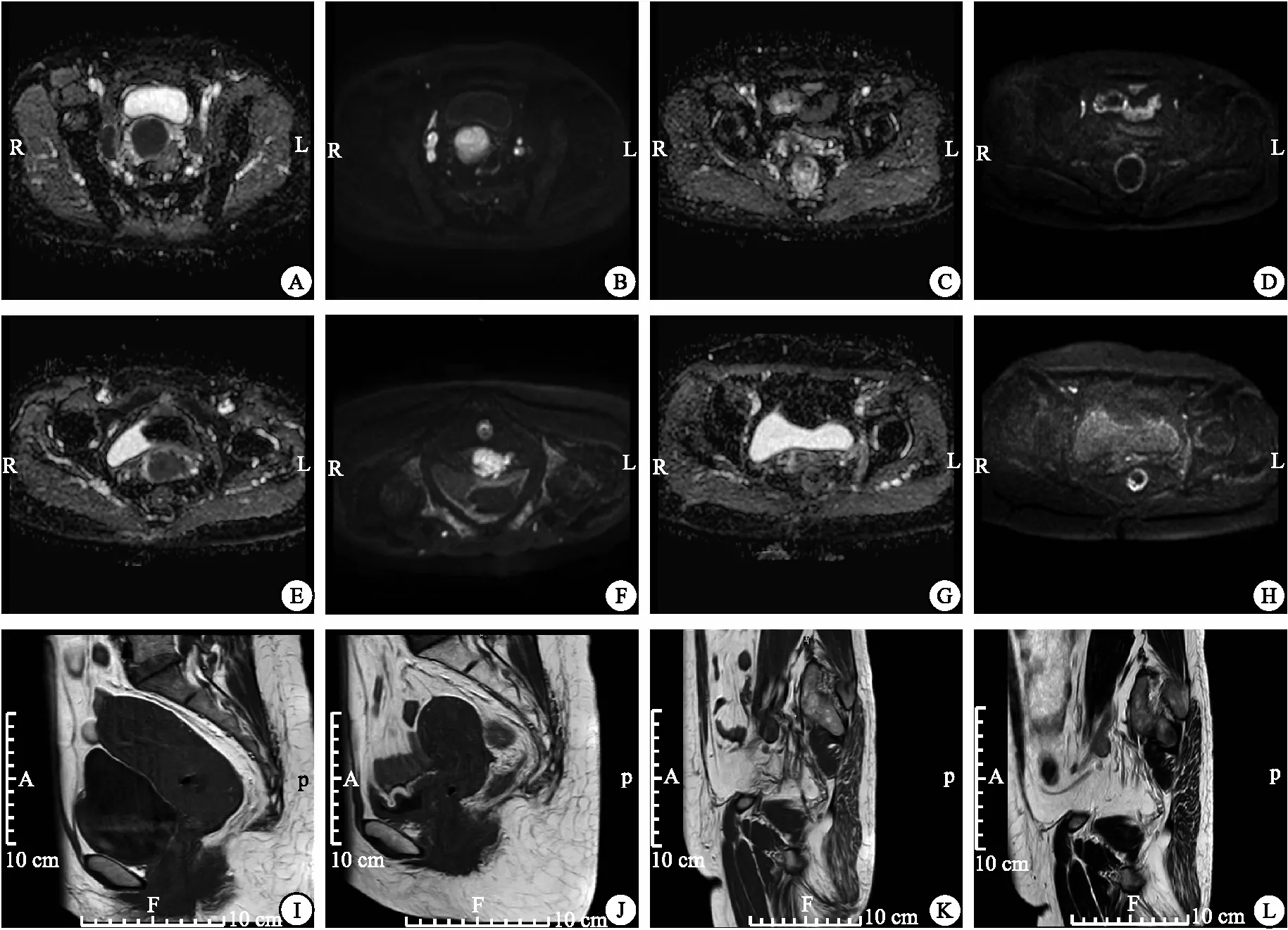
图1 治疗前后患者ADC图像与DWI图像
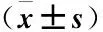
表3 治疗前后患者肿瘤体积及各参数值对比
2.5 治疗前缓解组和无效组肿瘤体积及各参数值对比 治疗前缓解组的肿瘤体积、Ktrans、Kep、Ve均显著低于无效组,ADC明显高于无效组(P<0.05)。见表4。
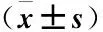
表4 缓解组和无效组患者肿瘤体积及各参数值对比
2.6 治疗前肿瘤体积及各参数值对宫颈癌患者疗效的预测价值 治疗前肿瘤体积、Ktrans、Kep、Ve、ADC及其联合检测在预测宫颈癌患者疗效中的曲线下面积(AUC)分别为0.635、0.696、0.644、0.651、0.742、0.848(P<0.05),具体特征见表5,曲线分析见图2。
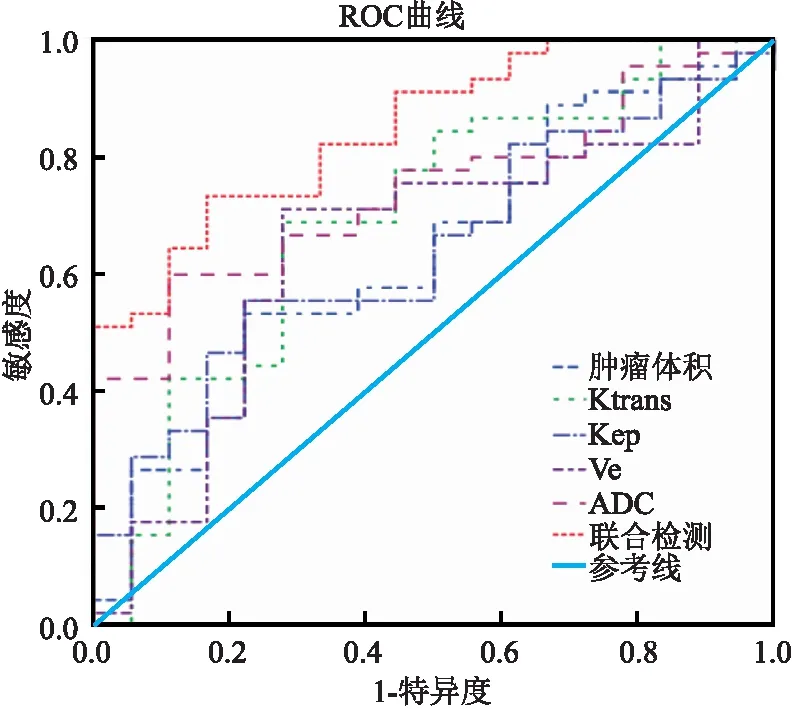
图2 治疗前肿瘤体积及各参数值预测宫颈癌患者疗效的ROC曲线
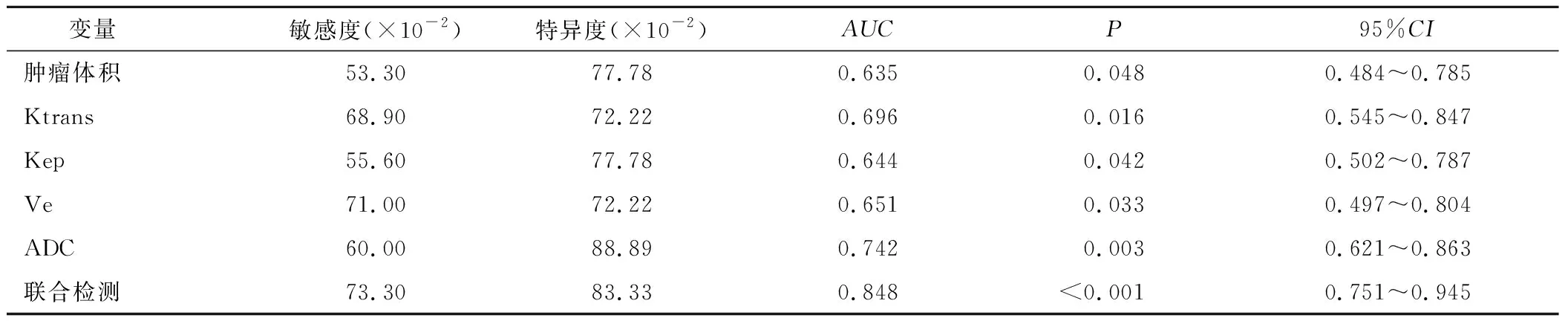
表5 治疗前肿瘤体积及各参数值预测宫颈癌患者疗效的ROC特征
3 讨论
近年来,随生活方式的改变,宫颈癌的发病率不断上升并逐渐趋于年轻化[8]。同步放化疗是治疗宫颈癌有效的手段之一,但患者在治疗期间易发生组织水肿等,且患者对放化疗的敏感性较低,使得疗效评估较为困难[9]。此外,因精准治疗策略的实施,导致宫颈癌术前分期的精准性要求愈发严格。故早期对分期及疗效进行评估对保证患者临床疗效,改善预后有积极作用。本研究中,MRI检查与金标准对宫颈癌患者T、N分期的诊断一致性均较高,这与赵波等[10]研究结果类似,表明MRI扫描技术有利于提高宫颈癌患者精准分期的准确性。可能是由于MRI扫描技术可直接做出成横断面、矢状面、冠状面和各种斜面的体层图像,方便进行解剖结构或病变的立体追踪,对病变组织的诊断提供了较为丰富、准确的信息,有利于快速分辨病灶组织与周边正常组织,提高临床诊断准确率[11-12]。研究显示[13],当宫颈发生癌变时,T2WI序列可将病灶组织与子宫或子宫基底形成清晰的边界,明显的显示出病灶与宫颈的关系。而MRI扫描技术对于软组织的评估具有较高的分辨率,通过多序列的扫描检查可更为精准的了解宫颈侵染范围,有利于提高宫颈癌分期的准确性。此外,白璐等[14]研究也发现,MRI技术用于评价宫颈癌分期及淋巴结转移的效能较高,本研究结果与其相似,说明MRI扫描技术可作用评价宫颈癌术前分期评估的重要手段。
通过MRI动态增强扫描可获得Ktrans、Kep、Ve值等定量药代动力学参数,从而反映出肿瘤微血管数目及血管壁的通透性[15]。MRI的DWI序列可观察到水分子的微观运动,而ADC值作为DWI的参数,不仅可反映肿瘤细胞水分子的扩散能力,还反映了肿瘤构成,其数值变化主要取决于细胞密度及外间隙大小,对评估宫颈癌患者临床疗效有较高的特异度[16-17]。本研究显示,治疗后患者的肿瘤体积、Ktrans、Kep、Ve均显著低于治疗前,ADC明显高于治疗前,这与张宾等[18]研究结果一致。可能是由于治疗前患者组织中不成熟新生血管较多,血管通透性较大,使对比剂更易进入组织间隙中,导致Ktrans、Kep、Ve值升高,且因癌细胞组织的不断增殖分化,肿瘤体积的增加,细胞密度的增大,使外间隙变小,水分子的活动空间受到限制,导致ADC值的降低[19]。同步放化疗后因恶性程度的降低,肿瘤细胞增殖速度的减慢,使肿瘤体积减少,细胞密度发生改变,限制水分子运动的物质减少,从而造成ADC值升高,Ktrans、Kep、Ve值降低,故可用MRI扫描检查来评估患者临床疗效[20]。
本研究结果还显示,治疗前缓解组患者的肿瘤体积、Ktrans、Kep、Ve均显著低于无效组,ADC明显高于无效组,提示不同疗效患者的肿瘤体积、Ktrans、Kep、Ve、ADC值存在差异,利用MRI扫描技术可为疗效评估提供参考。因不同疗效患者的个体性差异较大,故在进行同步放化疗时,对癌细胞的杀灭程度有所不同,易出现疗效较差的患者肿瘤微血管较多的现象,同时癌细胞的不完全杀灭使得细胞外间隙缩小,细胞密度增大,限制了水分子活动场所[21]。因而疗效越差,患者Ktrans、Kep、Ve值越高,ADC值越低。且冯煜森等[22]研究指出,通过MRI动态扫描可有效评估宫颈癌患者临床疗效,本研究结果与其相符,再次证实MRI扫描技术应用于宫颈癌患者疗效评估中有较高的临床价值。本研究中治疗前肿瘤体积、Ktrans、Kep、Ve、ADC及其联合检测在预测宫颈癌患者疗效中的AUC分别为0.635、0.696、0.644、0.651、0.742、0.848,说明MRI扫描技术对评价宫颈癌同步放化疗疗效有一定的价值,临床可根据数值变化及时调整治疗方案,以提高临床疗效,保证预后。
4 结论
MRI扫描技术不仅在宫颈癌精准分期的评估中有显著优势,还对患者同步放化疗的临床疗效有较高的预测价值。

