不同糖代谢异常状态对胃癌根治术患者预后的预测价值分析*
肖海鹏 陆艳军 张凡勇 钟新强 乐逵 刘子君
(1.黄冈市中心医院胃肠外科,湖北 黄冈 438000;2.武汉大学人民医院胃肠外科,湖北 武汉 430000)
胃癌是常见的一种消化系统恶性肿瘤,随着饮食结构和生活方式的变化,其患病率呈不断增长趋势,且病死率较高[1-2]。胃癌早期症状不明显,确诊时大多属中晚期,错失最佳根治时机[3]。胃癌根治术是治疗胃癌的一种重要手段,可提高临床效果,延长患者生存时间。研究报道[4-5]显示,高糖状态可促进肿瘤细胞增殖,在肿瘤发生、发展中具有重要作用。本研究通过探讨不同糖代谢状态对胃癌根治术患者预后的预测价值,以期为改善患者预后提供临床参考价值。
1 对象与方法
1.1 研究对象 选择2017年1月—2019年1月黄冈市中心医院收治的胃癌患者110例,术前依据口服葡萄糖耐量试验(OGTT)分为糖尿病组23例、糖耐量降低组31例与正常血糖组56例。其中男73例,女37例;年龄38~79岁,平均(60.84±6.71)岁。纳入标准:①经术后病理证实胃癌,其中早期胃癌患者病理显示癌肿仅限于黏膜层及黏膜下层的胃癌,而进展期胃癌包括隆起型(病变明显隆起,与周围黏膜界限清楚,隆起表面呈结节状或颗粒状,表面多发红)、局限溃疡型(有溃疡形成,溃疡底高低不平,可覆污秽苔,组织脆,容易出血)、浸润溃疡型(有溃疡形成,溃疡形态不规则,底部凹凸不平,脓苔分布不均匀)和弥漫浸润型(既无明显溃疡形成也无周围浸润结节,特点是胃壁硬化、肥厚,并且病灶与周围黏膜边界不清楚)。②均行胃癌根治术,且为初诊者。③具有完整随访资料。排除标准:①随访时间<6个月。②术前接受新辅助化疗。③合并其他恶性肿瘤者。
1.2 方法 依据《中国2型糖尿病防治指南(2017年版)》[6]中关于口服葡萄糖耐量试验(Oral glucose tolerance test,OGTT)血糖水平分类:①糖尿病:餐后2 h血糖≥11.1 mmol/L,或随机血糖≥11.1 mmol/L,或空腹血糖≥7.0 mmol/L。②糖耐量减低:空腹血糖<7.0 mmol/L,及糖耐量试验中服糖后2 h血糖≥7.8 mmol/L。所有患者均行胃癌根治术,具体方法:术前行X线胸片、心电图等常规检查,术前1 d禁饮禁食,清洁灌肠,给予吸入麻醉药复合全麻,取患者仰卧位,常规消毒铺巾,均由同一组手术医师完成手术;于患者脐下做弧形切口3~4 cm作为观察孔,套管穿刺器置入,建立气腹,维持气压12~14 mmHg;于患者左右腋前线肋缘下做2孔为主操作孔,再于患者脐部两侧平脐水平做2孔为辅操作孔,将无损伤抓钳和分离钳等器械分别置入,对患者腹腔、盆腔常规探查;于胃网膜血管根部结扎动静脉,肿瘤周边淋巴结依次清除;牵引胃和十二指肠,显露肝门区和小网膜,将Treiz韧带20 cm处的系膜和空肠切断,并清除根部淋巴结和肝总动脉;待远端胃组织根治性切除后,将60 mm直线切割器置入,行食管空肠与结肠侧端吻合,重建消化道;放置引流管,检查患者腹腔有无活动性出血,取出远端胃肿瘤组织标本,灭菌水冲洗腹腔后,逐层关腹。所有患者术后接受含铂类规范化疗6个疗程。
1.3 随访 于患者入院开始随访至2022年1月或患者死亡,失访患者剔除。采用门诊、电话等方式随访,记录患者总生存期和无进展生存期,其中以从接受第一次化疗开始,至本次随访末或死亡的时间为总生存期;以患者从术后化疗结束开始,至肿瘤进展或患者本次随访末或死亡的时间为无进展生存期。
1.4 观察指标 ①观察各组患者组织学分型情况。②观察各组患者临床分期情况。③观察各组患者淋巴结转移情况,经影像学CT、超声等观察是否出现淋巴结转移。④观察各组患者生存情况。
2 结果
2.1 各组患者临床特征比较 糖尿病组、糖耐量降低组和正常血糖组性别、年龄、肿瘤直径和BMI比较差异均无统计学意义(P>0.05)。见表1。
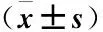
表1 各组患者临床特征比较
2.2 各组患者组织学分型比较 糖尿病组、糖耐量降低组和正常血糖组组织学分型比较差异均无统计学意义(P>0.05)。见表2。
2.3 各组患者临床分期比较 各组TNM分期比较差异无统计学意义(P>0.05)。见表3。

表3 各组患者TNM分期比较[n(×10-2)]
2.4 各组患者淋巴结转移比较 糖尿病组淋巴结转移N1高于糖耐量降低组和正常血糖组,差异均有统计学意义(P<0.05);而糖耐量降低组和正常血糖组淋巴结转移N1比较差异无统计学意义(P>0.05)。见表4。

表4 各组患者淋巴结转移比较[n(×10-2)]
2.5 各组患者生存情况比较 糖尿病组无进展生存期和总生存期短于糖耐量降低组和正常血糖组,差异均有统计学意义(P<0.05);糖耐量降低组与正常血糖组无进展生存期和总生存期比较差异均无统计学意义(P>0.05)。见表5、图1和图2。
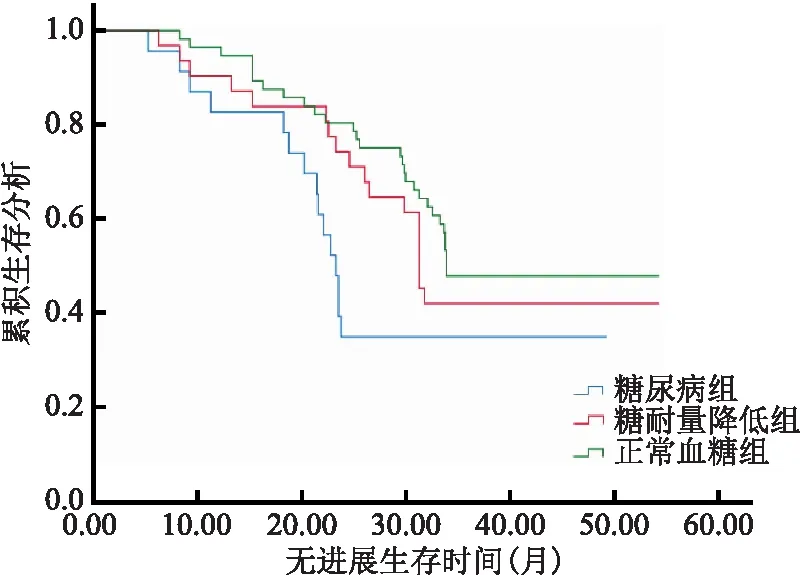
图1 不同糖代谢状态患者无进展生存时间的Kaplan-Meier分析
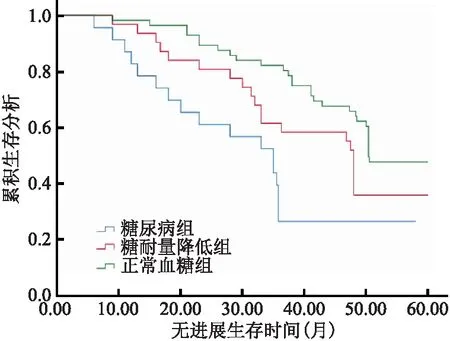
图2 不同糖代谢状态患者总生存时间的Kaplan-Meier分析
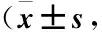
表5 各组患者生存情况比较月)
3 讨论
糖尿病具体发病机制尚未完全阐明[7-10]。多项研究证实,糖尿病对肿瘤手术后死亡及并发症的发生有明显的关系[11-13]。肿瘤生长需大量营养,但相比于正常组织细胞,肿瘤细胞无论在有氧或无氧环境均可更快速的以糖酵解方式供能,有利于肿瘤细胞快速生长繁殖,且可促进肿瘤血管生成、促进肿瘤正常组织细胞凋亡,逃逸抗肿瘤药物杀伤及逃避免疫等作用[14-17]。胃癌根治术是胃癌治疗的唯一有效手段[18]。胃癌根治术的创伤会导致机体代谢水平升高,使营养不良加重,增加感染等并发症发生[19]。胃癌根治术术后代谢呈分解状态,一方面是机体内胰岛素抵抗,对葡萄糖利用率下降,从而导致血糖水平明显上升;另一方面是蛋白质丢失增加,从而导致糖原异生加速[20]。
高血糖状态是胃癌发生的危险因素之一,肿瘤细胞低效的糖酵解需提供葡萄糖摄取率,以此满足高能量消耗需要;同时,化疗药物会使正常胰岛细胞损伤,从而造成异常糖代谢状态发生,导致一系列高血糖并发症,从而使患者预后受到影响,并与肿瘤细胞互相作用,导致胃癌患者病情加重。此外,胃癌合并糖尿病患者,术后营养支持通常需面临更多的问题,术后感染、手术创伤等应激状态会导致体内糖代谢紊乱加重,直接影响患者预后,且会使术后并发症增多[21]。由此可见,高血糖对胃癌的发生、发展具有促进作用,其表现主要为高血糖为肿瘤细胞提供充足的代谢能量,及蛋白质损伤或DNA损伤为表现的“促癌作用”[22-23]。故而,及时控制血糖,对提高疗效、降低并发症及改善预后具有重要意义。本研究表明,糖尿病组淋巴结转移高于糖耐量降低组和正常血糖组,由此可见伴糖尿病的胃癌根治术患者与淋巴结转移密切相关,分析其原因可能是由于高血糖可能促进了胃癌的发展,并具有更高的淋巴结转移性可能;糖尿病组无进展生存期和总生存期短于糖耐量降低组和正常血糖组,表明伴糖尿病的胃癌根治术患者预后更差,分析其原因可能是高血糖状态是引起胃癌发生的危险因素之一,肿瘤细胞低效的糖酵解需提高葡萄糖摄取率以满足高能量消耗需要;化疗药物会损伤正常胰岛细胞,从而造成异常糖代谢状态发生,由此引起一系列高血糖并发症,导致患者预后受到严重影响,并会加重胃癌病情。
4 结论
不同糖代谢状态对胃癌根治术患者预后影响较大,其中伴糖代谢异常患者预后较差。

