miR-155-5p和TRIP13在结直肠癌组织中的表达及与预后的关系
徐阳 李红云 史铭 何波
(解放军总医院第三医学中心肿瘤科,北京 100039)
我国结直肠癌(Colorectal cancer,CRC)发病率位于恶性肿瘤第三位,且死亡率占据恶性肿瘤第二位,近年来其发病率、死亡率仍然有上升的趋势[1]。CRC早期症状不明显,大多数患者在中晚期时才发现患癌,对患者生存及生活质量造成了一定影响。目前,随着分子生物学研究的不断深入,肿瘤标志物已在肿瘤诊断、患者病情的监测或预后判断中广泛地应用[2]。微小RNA(microRNA,miRNA)在病理和生理过程中起重要作用,其中包括细胞的凋亡和代谢过程。miR-155-5p位于染色体21q21上,研究表明miR-155-5p的表达水平与胆囊癌[3]、胃腺癌[4]、宫颈癌[5]、胰腺癌[6]等恶性肿瘤的发生、发展及不良预后有关。另有研究指出,靶向下调miR-155-5p可能对CRC的治疗具有有效的作用[7]。甲状腺激素受体相互作用因子13(Thyroid hormone receptor interactor 13,TRIP13)属于蛋白编码基因,在细胞减数分裂、细胞增殖等过程中扮演着重要的角色[8]。目前,miR-155-5p、TRIP13在多种恶性肿瘤组织中异常表达,但二者是否可共同参与CRC发病及对患者预后的价值尚未清楚。基于此,本研究主要探讨miR-155-5p、TRIP13在CRC发生发展过程中的表达情况及预后的关系,并分析与临床指标、预后的关系,旨在为CRC预后评价、病理机制解析提供参考。
1 资料与方法
1.1 一般资料 收集2015年1月—2017年5月本院确诊的78例CRC患者为研究对象。患者年龄31~72岁,平均(51.33±6.58)岁;男性42例,女性36例;按照《恶性肿瘤TNM分期》进行临床分期[9],其中19例TNM I期患者,38例Ⅱ期患者,21例Ⅲ期患者;肿瘤大小2.3~6.9 cm,平均(4.2±2.1)cm;肿瘤位置:结肠45例,直肠33例;浸润深度:T1患者14例,T2患者15例,T3患者26例,T4患者23例;肿瘤分化程度低、中、高患者分别为19例、46例和13例;无淋巴结转移患者49例,发生淋巴结转移患者29例。纳入标准:①所有患者经手术后诊断为CRC。②接受术后切除或淋巴扫除治疗。③术前未接受化疗、生物治疗等辅助治疗。④患者神志清楚且积极配合研究。⑤患者及家属知情且签署知情同意书。排除标准:①合并其他肿瘤。②全身感染。③合并重要器官病变。本研究经本院医学伦理委员会审核批准(批号:20150326)。
1.2 主要试剂与仪器 Trizol试剂(货号:15596018)购自中国深圳子科生物;miScript SYBR®Green qPCR Kit(货号:330509)购自德国QIAGEN公司;实时荧光定量PCR(Real time fluorescent quantitative PCR,qRT-PCR)仪购自美国Bio-Rad公司;超微量分光光度计购自中国上海昂拉仪器;RNA逆转录试剂盒(货号:P0101)购自吉赛生物;引物由上海生工生物工程有限公司合成;兔抗人TRIP13多克隆抗体(货号:ab204331)购自中国abcam公司;Envision二步法检测试剂盒与二氨基联苯胺(Diaminobenzidine,DAB)显色剂(货号:E-IR-R213)购自武汉伊莱瑞特生物。
1.3 方法
1.3.1 组织样本采集 采集所有患者肿瘤组织和癌旁组织,离体后迅速置于液氮中,然后做好标记并保存于-80 ℃冰箱中。
1.3.2 qRT-PCR检测组织中miR-155-5p、TRIP13 mRNA相对表达水平 将患者组织加入Trizol试剂进行RNA提取,氯仿溶解。采用RNA逆转录试剂盒将RNA转为cDNA,采用miScript SYBR®Green qPCR Kit试剂盒检测miR-155-5p、TRIP13 mRNA的表达水平。PCR反应条件:95 ℃ 2 min,94 ℃ 15 s,55 ℃ 30 s,70 ℃ 34 s,总计40个循环,分别以U6和GAPDH为内参,采用2-ΔΔct计算组织中miR-155-5p、TRIP13 mRNA相对表达水平,序列见表1。以CRC患者miR-155-5p、TRIP13 mRNA平均值为界线,高于平均值为高表达,低于平均值为低表达。
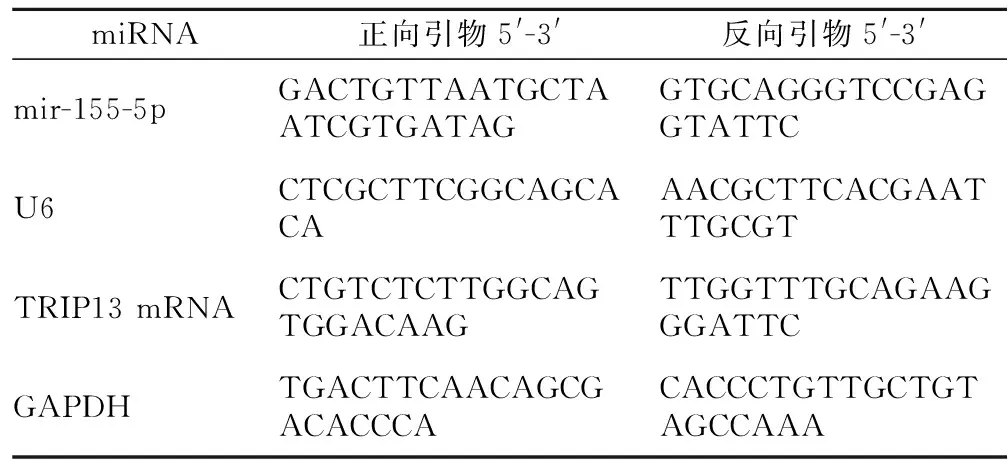
表1 qRT-PCR引物序列
1.3.3 免疫组化法检测组织中TRIP13蛋白表达水平 首先用10%中性甲醛固定CRC组织以及癌旁组织。石蜡包埋之后进行4 μm切片。包埋好的石蜡切片常规脱蜡,修复抗原,室温封闭后,加入兔抗人TRIP13抗体(1∶500)4 ℃过夜,之后添加山羊抗兔lgG(1∶1000)37 ℃孵育1 h,DAB进行染色,苏木素复染,然后用酸酒精进行短暂分化,之后脱水、透明、封片。
1.3.4 结果判定 显微镜下拍照,并对免疫组化结果进行分析评分;评分规则如下,由阳性细胞所占比例和染色强度共同决定,其中染色强度评分:0分(无染色),1分(浅黄色),2分(黄褐色),3分(棕褐色);阳性细胞所占比例评分:<5%(0分)、5%~25%(1分)、26%~50%(2分)、51%~75%(3分)、>75%(4分),染色强度积分与染色面积积分的乘积为总得分,其中0~4分为阴性表达,5~12分为阳性表达[10]。
1.3.5 随访 对所有治疗出院后的患者进行复查或电话随访,随访时间为60个月,在2022年5月31日结束随访,记录CRC患者随访期间生存情况。

2 结果
2.1 miR-155-5p、TRIP13 mRNA在CRC组织及癌旁组织中的表达 CRC组织中miR-155-5p、TRIP13 mRNA表达水平均明显高于癌旁组织(P<0.05),见表2。

表2 CRC组织及癌旁组织miR-155-5p、TRIP13 mRNA表达水平比较
2.2 CRC组织及癌旁组织中TRIP13蛋白表达比较 TRIP13蛋白主要表达于细胞核(图1);CRC组织中TRIP13蛋白的阳性表达率显著高于癌旁组织(P<0.05),见表3。
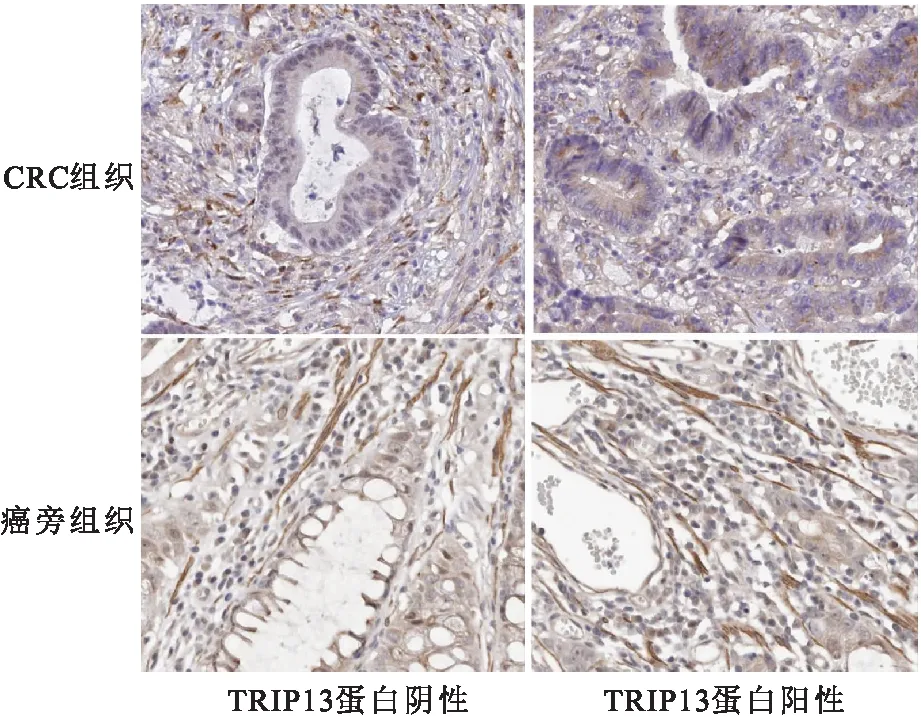
图1 CRC组织及癌旁组织中TRIP13蛋白表达(200×)

表3 CRC组织及癌旁组织中TRIP13蛋白表达比较[n(×10-2) ]
2.3 CRC组织中miR-155-5p与TRIP13 mRNA表达水平的相关性 相关性分析显示,CRC组织中miR-155-5p与TRIP13 mRNA表达水平呈正相关(r=0.491,P<0.001),见图2。

图2 CRC组织中miR-155-5p与TRIP13 mRNA表达水平的相关性
2.4 CRC组织中miR-155-5p、TRIP13蛋白与临床病理特征的相关性 以CRC组织中miR-155-5p表达平均数(5.12)分为高表达组40例,低表达组38例,TRIP13蛋白表达分为阳性表达组46例,阴性表达组32例。结果表明CRC组织中miR-155-5p、TRIP13蛋白表达与患者年龄、性别、肿瘤大小、肿瘤位置、浸润深度无关(P>0.05),与患者TNM分期、肿瘤分化、淋巴结转移有关(P<0.05),见表4。
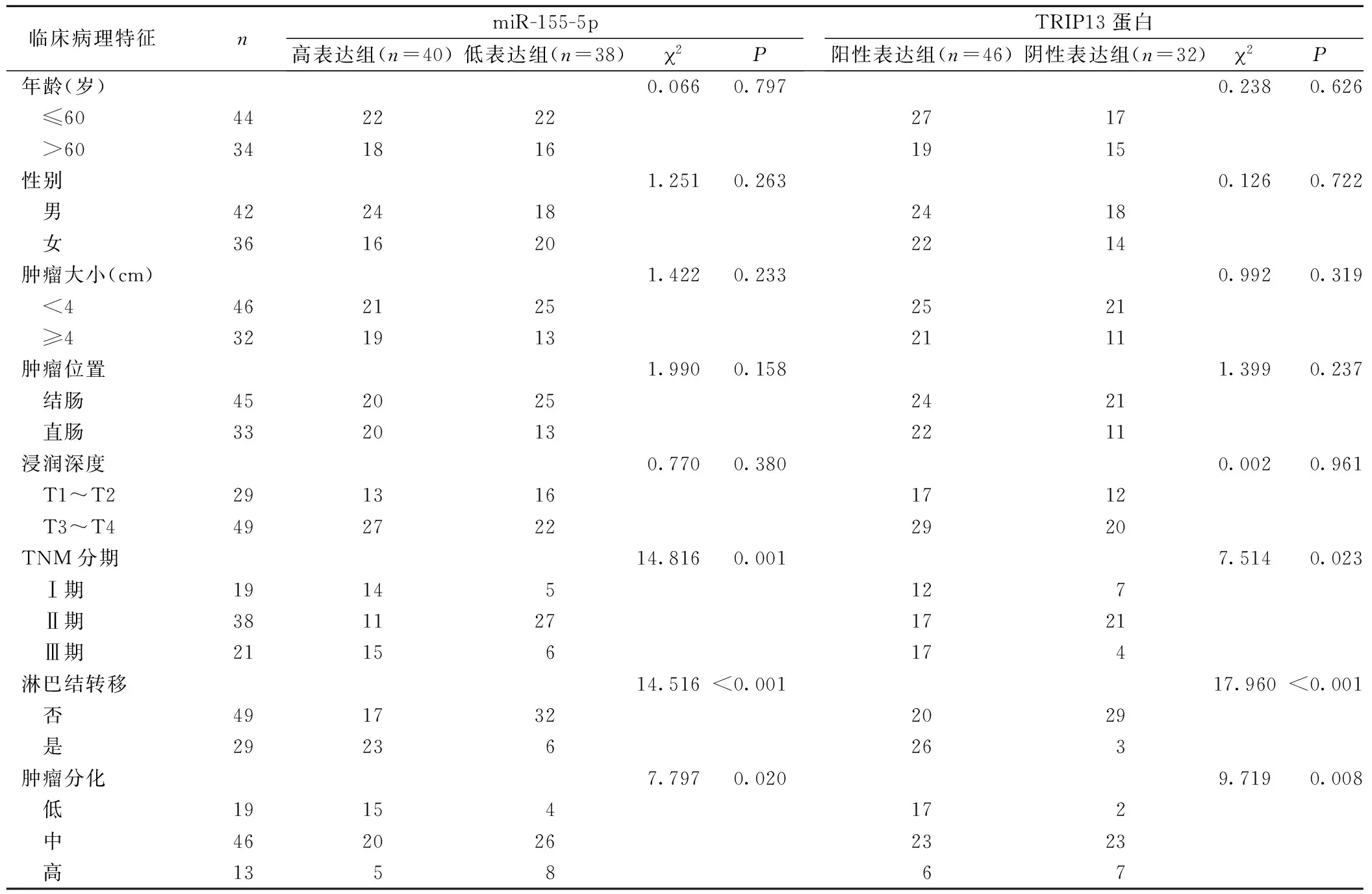
表4 CRC组织中miR-155-5p、TRIP13蛋白与临床病理特征的相关性[n]
2.5 CRC组织中miR-155-5p、TRIP13蛋白表达对患者预后的影响 对CRC患者进行出院后随访,miR-155-5p高表达组5年内生存率(42.50%)低于低表达组(71.05%)(Log Rank2=6.314,P=0.012);TRIP13蛋白阳性组5年内生存率(43.48%)低于阴性组(75.00%)(Log Rank2=7.330,P=0.007),见图3。
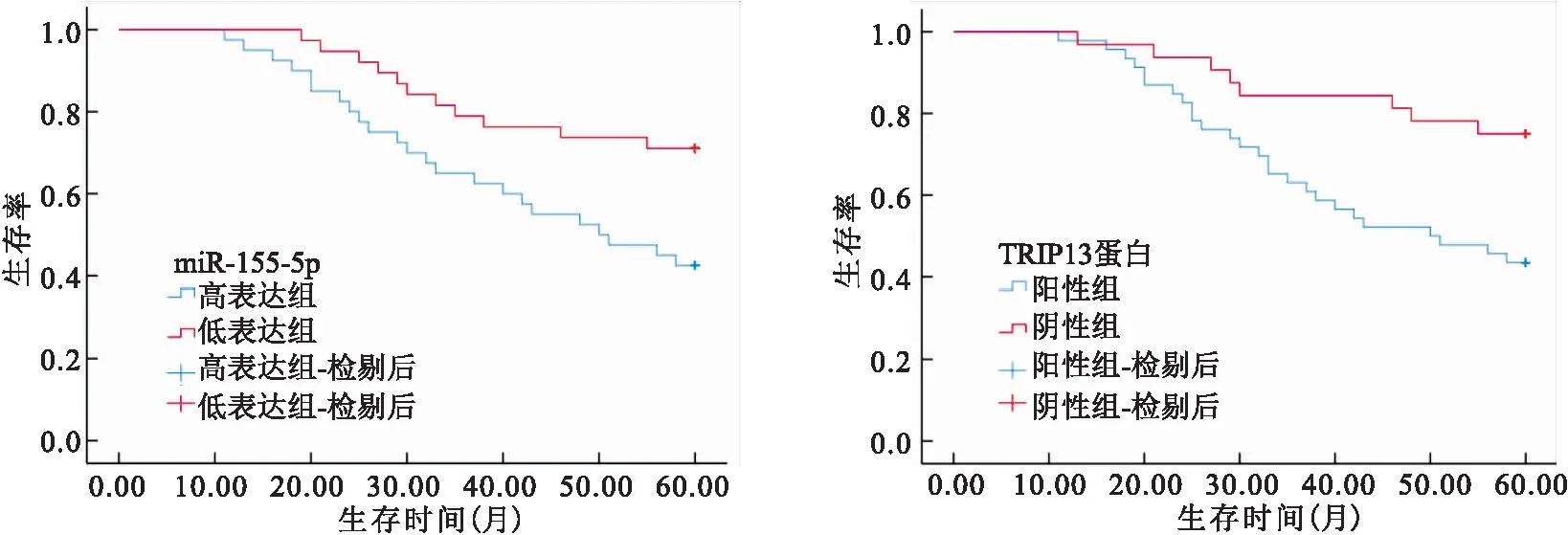
图3 CRC组织中miR-155-5p、TRIP13蛋白表达对患者预后的影响
2.6 CRC患者预后的多因素分析 以单因素分析中差异显著的浸润深度、肿瘤分化程度、miR-155-5p、TNM分期、淋巴结转移、TRIP13为自变量,将预后作为因变量,Cox回归分析显示,肿瘤分化程度、TNM分期、淋巴结转移、miR-155-5p、TRIP13是CRC患者预后的影响因素(P<0.05)。见表5。
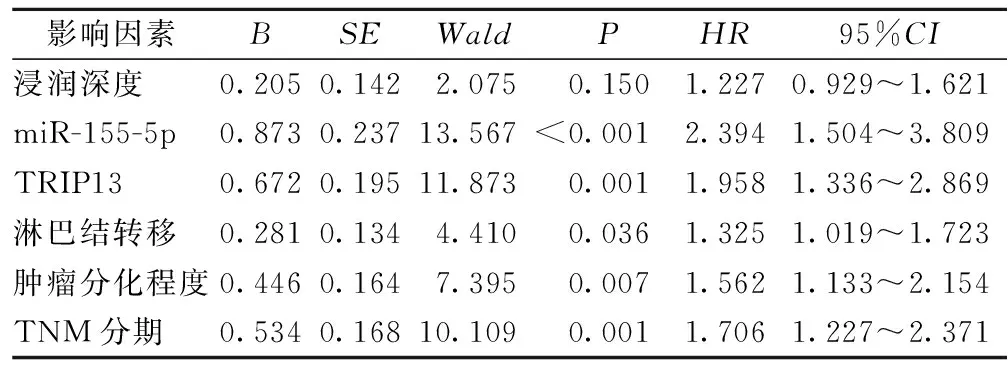
表5 CRC预后的多因素分析
3 讨论
随着生活质量及饮食水平的不断提高,CRC的发生率、死亡率均趋于年轻化,人们的身体健康和生命安全不断受到威胁。目前,手术切除是治疗CRC的首选方法,早期CRC患者在进行手术切除之后,5年生存率高达90%,但是CRC发生远处转移的患者5年生存率只有8.1%[11]。所以,探究与CRC预后相关的因子,对患者生存时间延长、改善患者预后具有十分重要的意义。
miRNA在人体中调控着基因的表达水平,并且参与癌症的发生、发展,miR-155-5p是miRNA家族中具有多功能的基因,在活化的巨噬细胞、单核细胞、T细胞中均表现出显著高表达,目前已经证实miR-155-5p在炎症反应、免疫反应及癌症等多种病理生理过程中起关键作用[12]。有研究表明[13-14],miR-155-5p在口腔鳞状细胞癌、肝细胞癌中明显上调,可促进肿瘤增殖、转移和侵袭。La等[15]研究报道,抑制miR-155-5p的表达有利于增强CRC细胞对化疗药物5-氟尿嘧啶的敏感性。Shi等[16]研究显示,胃癌组织中miR-155-5p的表达水平显著升高,其异常表达与胃癌细胞的增殖和迁移过程有关。本研究结果显示,CRC组织中miR-155-5p表达水平较癌旁组织高,与Shi等[16]研究类似,提示miR-155-5p可能参与CRC的发生。进一步研究显示,CRC组织中miR-155-5p表达率在不同TNM分期、肿瘤分化、淋巴转移患者中均有差异,提示miR-155-5p可能参与CRC的发展对CRC患者进行出院后随访,miR-155-5p高表达组5年内生存率低于低表达组,且miR-155-5p是CRC预后的独立危险因素。进一步说明miR-155-5p不仅参与CRC疾病的发生发展,同时与患者预后也密切相关,可作为评估患者预后的生物学标志物。
TRIP13位于人类染色体的5p15.33上,是一种转录调控因子。同时作为AAA+三磷酸腺苷酶(ATPase)超家族的一员,具有促进DNA-蛋白、蛋白-蛋白复合物形成的功能,参与有丝分裂和减数分裂过程。2014年首次报道TRIP13为头颈癌的致癌基因[17],随后的几项研究表明TRIP13在其他肿瘤中发挥致癌作用[18-19]。Agarwal等[20]研究指出,TRIP13能促进肿瘤生长和转移,并表明它是CRC的治疗靶点。Kurita等[21]研究表明,TRIP13在CRC中表达上调,并且通过下调TRIP13可以降低癌细胞的增殖和侵袭。通过上述研究可知,TRIP13参与CRC的病情进展,但TRIP13与患者预后的关系仍需进行验证。因此,本研究通过qRT-PCR法及免疫组化法分别检测了TRIP13 mRNA及蛋白表达水平,结果显示,CRC组织中TRIP13 mRNA表达水平及蛋白阳性表达率明显高于癌旁组织,与Kurita等[21]研究结果一致,提示TRIP13可能在CRC中可能作为促癌基因,参与CRC的发生。通过分析TRIP13与患者临床病理特征的关系,结果显示,CRC组织中TRIP13蛋白的表达与患者TNM分期、肿瘤分化、淋巴结转移具有显著相关性,提示TRIP13可能与CRC的发生及肿瘤细胞的侵袭与迁移关系密切。生存分析结果显示,TRIP13蛋白阳性组5年内生存率低于阴性组,且TRIP13是CRC预后的影响因素,提示TRIP13水平与CRC预后密切相关,TRIP13水平越高患者预后越差。此外,本研究Pearson检验结果显示,CRC组织中miR-155-5p与TRIP13 mRNA表达水平呈正相关,提示二者可能通过某种调控机制共同参与CRC的发生及发展,从而共同影响患者预后。本研究不足之处在于,关于MiR-155-5p、TRIR13与CRC患者病情及预后的机制未深入分析,且二者在CRC中的相互调节的具体分子机制未进行探讨,今后需增加基础实验(如动物或细胞实验)深入分析;同时由于研究时间及经费有限,本研究仅为单中心小样本回顾性分析,研究结论还需要从多个角度进一步证实。
4 结论
CRC组织中miR-155-5p、TRIP13表达上调,二者均参与CRC的发生发展过程,miR-155-5p、TRIP13表达情况与预后密切相关。

