血清PG-Ⅰ/II联合胃镜检查在高危HP相关性胃癌中的诊断价值*
管小倩 刘旭 张彦 孙吉瑞 王曼
(保定市第一中心医院 1.消化内科;2.病理科;3.检验科,河北 保定 071000)
胃癌是常见消化道恶性肿瘤,近年来,胃癌发病率升高,且趋向年轻化,已成为全球第三大癌症致死的原因,严重威胁人类健康[1]。多数患者早期无明显症状,或出现上腹不适、嗳气等,与胃炎、胃溃疡等症状相似,易被忽略,且当出现危急症状时病变往往已发展至晚期,从而错过了最佳治疗时期,并增加病死率,因此早发现、早治疗对降低病死率至关重要[2]。而幽门螺杆菌 (Helicobacter pylori,HP)是定值于胃黏膜表面的革兰阴性菌。且有研究表明,HP感染与肠道疾病密切相关,HP感染及胃癌诊断意义重大[3]。胃镜检查是目前临床上胃癌及癌前病变的诊断金标准,可在目视下观察胃部病变,但胃镜检查过程复杂,易受人为因素影响,如在早期特征不典型情况下易误判。同时胃镜检查属于侵入性操作,部分患者对其心理上存在抵触,可限制其使用范围[4]。因此探寻有效的胃癌诊断分子标志物具有重要意义。而血清胃蛋白酶原(Pepsinogen,PG)作为一种胃蛋白酶前体,主要包含PGI、PGII,前者主要由胃底腺细胞和主细胞分泌;后者由黏液细胞分泌,当胃黏膜发生病变时,其含量也会随之波动,且其比值(Pepsinogen Ⅰ to pepsinogen Ⅱ ratio,PGR)能够反映胃黏膜功能[5-6]。且有研究表明,血清PG水平的不同预示着胃癌发展程度不同[7]。基于此,本研究将血清PG-Ⅰ/II联合胃镜应用于高危HP胃癌诊断中,旨在为临床提供参考,现报告如下。
1 资料与方法
1.1 一般资料 回顾性分析2020年1月—2022年1月我院收治的并经病理学证实的105例上消化道疾病患者的临床资料,根据组织病理检测结果分为胃癌组(n=30)、浅表性胃炎组(n=40)和萎缩性胃炎组(n=35)。纳入标准:①符合《胃肠道疾病中西医实用手册》[8]中诊断标准,且实施胃黏膜活检确诊。②未实施生物治疗及放化疗。③临床资料完整。④患者及家属知情且签署知情同意书。排除标准:①合并其他恶性肿瘤。②精神疾病、智力低下等。③心肝肾等脏器疾病。④免疫性疾病。⑤3个月内应用过抑酸药、胃黏膜保护剂者。并纳入50例同期来院参加体检的健康志愿者作为对照组。本研究经医院医学伦理委员会审核批准。
1.2 方法
1.2.1 血清PG-Ⅰ、PG-Ⅱ水平检测 所有受试者均空腹抽取静脉血3 mL,3000 r/min离心5~10 min,于-20 ℃下恒温贮存直至检测,采用酶联免疫吸附法(ELISA)检测血清PG-Ⅰ、PG-Ⅱ水平,并计算PGR。血清PG阳性判定[9]:PG-Ⅰ<70 ng/mL且PGR<3.0。
1.2.2 HP检测 于清晨空腹测定,测定前漱口,口服14C尿素胶囊1粒后静坐25 min,向集气瓶内吹气,当瓶内液体由紫红色变为无色时停止吹气,若呼气超过3 min仍未褪色,亦停止吹气,收集完毕后向瓶中滴加4.5 mL稀释闪烁液,于液闪仪中测定。测定结果[10]≥100 dpm/mmol为阳性,<100 dpm/mmol为阴性。
1.2.3 胃镜检查 采用电子胃镜,于受试者胃窦大小弯及胃体前后壁取标本1块,用福尔马林组织固定液固定后送病检[11]。浅表性胃炎:胃固有层出现充血、水肿、糜烂、出血;萎缩性胃炎:固有腺体萎缩、黏膜肌层增厚;胃癌:存在不规则的腺上皮细胞浸润、黏膜固有层间质。

2 结果
2.1 4组一般资料比较 胃癌组:男17例,女13例,年龄50~70岁,平均年龄(60.43±6.77)岁;病程3个月~1年,平均病程(0.85±0.22)年。浅表性胃炎组:男23例,女17例,年龄50~68岁,平均年龄(59.36±6.81)岁;病程3个月~1.1年,平均病程(0.78±0.20)年。萎缩性胃炎组:男20例,女15例,年龄50~70岁,平均年龄(59.69±6.87)岁;病程2个月~1年,平均病程(0.75±0.18)年。对照组:男27例,女23例,年龄20~76岁,平均年龄(59.42±6.88)岁。4组性别、年龄、病程等一般资料比较,差异无统计学意义(P>0.05)。
2.2 4组血清PG-Ⅰ、PG-Ⅱ、PGR水平比较 胃癌组血清PG-Ⅰ、PGR水平低于浅表性胃炎组、萎缩性胃炎组和对照组,PG-Ⅱ水平高于浅表性胃炎组、萎缩性胃炎组和对照组(P<0.05),萎缩性胃炎组血清PG-Ⅰ、PGR水平低于浅表性胃炎组和对照组,PG-Ⅱ水平高于浅表性胃炎组和对照组(P<0.05),而浅表性胃炎组和对照组血清PG-Ⅰ、PG-Ⅱ、PGR水平比较,差异无统计学意义 (P>0.05),见表1。
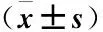
表1 4组血清PG-Ⅰ、PG-Ⅱ、PGR水平比较
2.3 胃癌组、浅表性胃炎组和萎缩性胃炎组的HP阳性率比较 胃癌组HP阳性率高于浅表性胃炎组和萎缩性胃炎组(P<0.05),萎缩性胃炎组和浅表性胃炎组HP阳性率比较无差异(P>0.05),见表2。

表2 胃癌组、浅表性胃炎组和萎缩性胃炎组的Hp阳性率比较[n(×10-2)]
2.4 不同检查方法对高危HP相关性胃癌诊断情况分析 PG-Ⅰ/II将17例阳性诊断为阴性,11例阴性诊断为阳性,诊断高危HP相关性胃癌的准确率为73.33%;胃镜将11例阳性诊断为阴性,13例阴性诊断为阳性,诊断高危HP相关性胃癌的准确率为77.14%;血清PG-Ⅰ/II联合胃镜将2例阳性诊断为阴性,7例阴性诊断为阳性,诊断高危HP相关性胃癌的准确率为91.43%。血清PG-Ⅰ/II联合胃镜诊断高危HP相关性胃癌的准确率高于血清PG-Ⅰ/II和胃镜单独诊断(P<0.05),见表3。
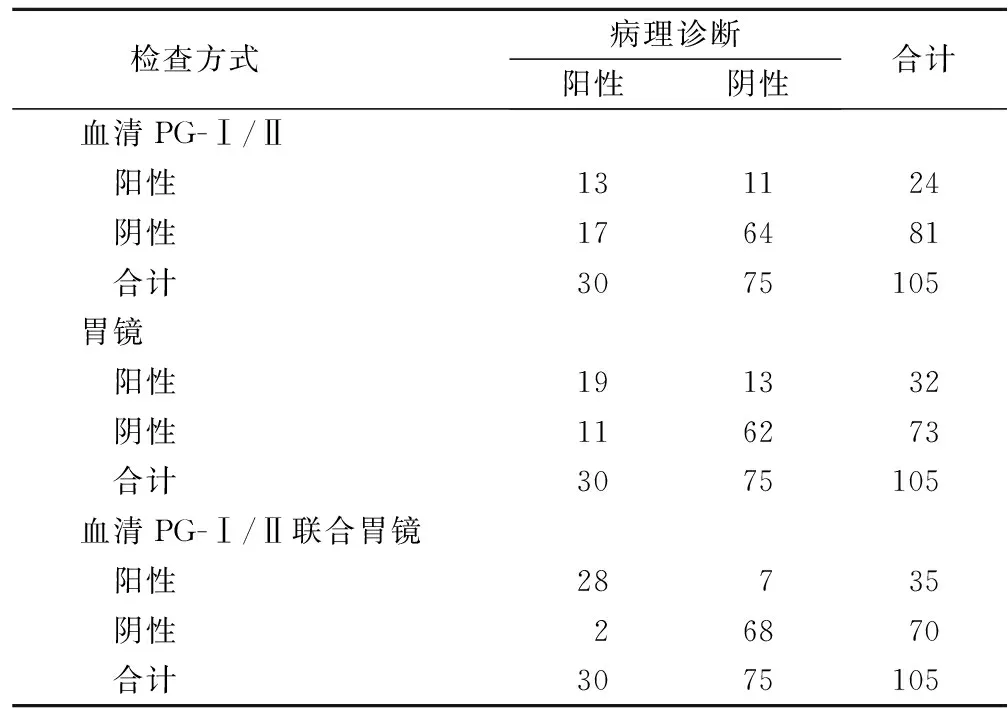
表3 不同检查方法对高危Hp相关性胃癌诊断情况分析(n)
2.5 不同检查方法对高危HP相关性胃癌的诊断价值 血清PG-Ⅰ/II联合胃镜诊断高危HP相关性胃癌的灵敏度、特异度、阳性预测值、阴性预测值均高于血清PG-Ⅰ/II和胃镜单独诊断(P<0.05),见表4。
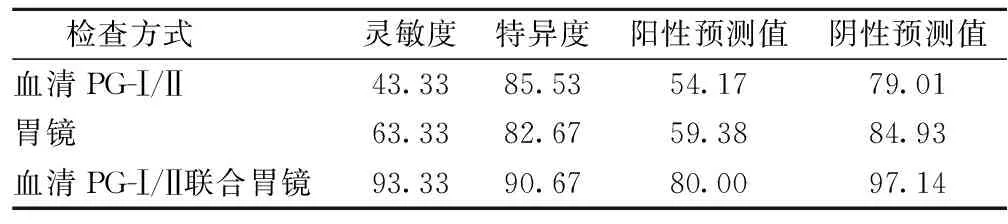
表4 不同检查方法对高危Hp相关性胃癌的诊断价值(×10-2)
2.6 胃恶性肿瘤胃镜检查典型病例 典型病例见图1。

图1 胃恶性肿瘤胃镜检查典型病例
3 讨论
据统计显示,我国胃癌发病率占全球的42.5%,病死率超过50%[12]。早期无明显症状或表现,确诊时往往已处于中晚期,从而错过了最佳治疗时期,严重威胁患者生命安全。研究表明,多数早期胃癌经根治性手术治疗后可改善生存状况,且5年生存率可达90%以上[13]。因此加强对胃癌的早期诊断至关重要。
胃镜检查常用于早期胃癌和高危人群的筛查和诊断,具有一定诊断效果,但胃镜视野有限,无法观察到病理组织全貌,当病变在黏膜下时较难发现,对亚临床患者诊断具有局限性[14]。血清PG是内消化蛋白酶,含有375个氨基酸,根据免疫学和生化差异分为PG-Ⅰ和PG-Ⅱ亚群,其中PG-Ⅰ表达于胃底颈黏液细胞和主细胞;PG-Ⅱ表达于十二指肠所有Brunner腺和胃腺[15-16]。合成后PG大部分分泌入胃腔,且于酸性胃液作用下活化成胃蛋白酶,进入血液循环的PG较稳定,测定血清PG能够反应胃黏膜病变,有利于胃癌早期诊断,且对胃镜较难发现的病变,血清PG-Ⅰ/Ⅱ水平可发生变化,因此两者结合可提高胃癌检出率[17-19]。本研究结果显示,胃癌组血清PG-Ⅰ、PGR水平低于浅表性胃炎组、萎缩性胃炎组和对照组,PG-Ⅱ水平高于浅表性胃炎组、萎缩性胃炎组和对照组,与孔凡立等[20]研究相符,提示血清PG水平与胃癌发病相关,分析与胃黏膜萎缩有关,胃黏膜萎缩时,PG-Ⅰ降低,且随胃炎加重,胃主细胞减少,PG-Ⅰ进行性降低,而PG-Ⅱ相对稳定,从而使PGR降低。且萎缩性胃炎组血清PG-Ⅰ、PGR水平低于浅表性胃炎组和对照组,PG-Ⅱ水平高于浅表性胃炎组和对照组,提示PG-Ⅰ、PGR下降和PG-Ⅱ升高预示着胃部炎症范围进展,进一步说明了PG-Ⅰ、PGR下降和PG-Ⅱ升高提示萎缩性胃炎的发生,分析原因:萎缩性胃炎可致腺体萎缩、主细胞减少,并常伴肠上皮化生,PG-Ⅰ分泌减少,而PG-Ⅱ改变小甚至检测值更高,故萎缩性胃炎时PG-Ⅰ、PGR降低[21]。HP是胃部感染常见病原体,其抗体过表达可导致胃黏膜细胞凋亡,使局部细胞代谢增生,增加基因突变概率,从而导致癌变风险。有研究证实,HP感染是胃癌发生的始动因子[22]。同时临床报道显示,HP可经调控信号通路分泌致病因子,对癌前疾病起到一定作用[23]。基于此,本研究分析胃癌组、浅表性胃炎组和萎缩性胃炎组3组HP阳性率,结果显示,胃癌组HP-IgG阳性率高于浅表性胃炎组和萎缩性胃炎组,萎缩性胃炎组HP-IgG阳性率高于浅表性胃炎组,提示胃癌的发生发展与HP感染有关。进一步比较其诊断效能,血清PG-Ⅰ/Ⅱ联合胃镜诊断高危HP相关性胃癌的准确率、灵敏度、特异度、阳性预测值、阴性预测值均高于血清PG-Ⅰ/Ⅱ和胃镜单独诊断,说明在PG-Ⅰ/Ⅱ阳性患者中序贯进行胃镜检查可提高胃镜检查的针对性,进而提高对高危HP相关性胃癌的检出率[24-25]。
4 结论
随着胃部疾病的加重,血清PG-Ⅰ、PG-Ⅱ、PGR水平均发生明显的变化,且血清PG水平联合胃镜检查可提高高危HP相关性胃癌检出率,可在临床推广应用。

