荒漠草原不同间距灌丛引入对土壤细菌碳源利用和胞外酶活性的影响
苏荣霞,马彦平,王红梅,赵亚楠,李志丽
(宁夏大学农学院,宁夏草牧业工程技术研究中心,西北退化生态系统恢复与重建教育部重点培育实验室,宁夏 银川 750021)
土壤微生物作为全球土壤生化过程的参与者,影响着生物地球化学循环过程和生态系统生产力[1]。有研究指出,微生物多样性与一系列生态系统功能(如养分循环、分解和植物生产力等)呈正相关[2]。而土壤微生物群落功能多样性也可以反映其对环境变化的响应、微生物生态系统功能和土壤有机物质动态变化,对评估土壤生态系统稳定性具有重要作用[3]。水分作为荒漠草原主要制约因素之一[4],通过改变土壤矿质元素离子浓度和土壤元素养分循环,从而进一步对微生物的代谢活动和陆地长期碳吸收产生影响[5],而随着全球气候变化和人类活动的干扰加剧,草原灌丛化伴随一系列生态系统功能与服务的改变,即土壤旱化、饲草产量减少、生物多样性降低、土壤侵蚀加剧以及土壤碳氮稳定性变化等特征[6],对土壤微生物产生直接或间接影响[7]。
土壤微生物数量巨大,在土壤中进行氧化、硝化、氨化、固氮等过程,促进土壤有机质的分解和养分的转化,在生态系统的运作中发挥着重要作用,而灌木的扩张可直接通过分泌物的变化改变土壤微生物群落[6]或通过改变土壤物理性质和化学性质间接改变土壤微生物组成[8]。尤其在干旱半干旱草原,灌木入侵可以改变土壤微生物群落的组成和丰度,刺激或抑制土壤微生物活动,增加或降低土壤中养分循环的速率[9],影响着草原生态系统功能的发挥。于露等[10]对经过灌丛侵占的荒漠草原研究发现,灌丛化通常伴随着草本盖度减少和裸露土壤增加,从而加速水分消耗,微生物代谢和酶活性降低。枯落物是连接植物与土壤养分的载体,对土壤微生物有深远影响[11-12]。例如,Mcculley 等[13]研究指出,在干旱条件下土壤水分减少和枯落物分解的双重影响能够使微生物多样性、生物量降低以及胞外酶对有机质的分解减缓。灌丛化使得凋落物主要以草本为主转向以木本为主,从而通过改变微生物的底物对其产生影响[14]。Cao 等[15]对内蒙古草原向灌丛自然演替梯度的研究发现,固氮灌木通过改变植物输入的化学成分导致土壤微生物多样性降低。Zhou 等[16]对灌木侵占的山地草原研究发现,灌木有潜力支撑远高于草本的叶面积。从细菌到真菌种群的转变可能伴随着从草本到木本的转变,使得微生物生物量能够有效地处理较低的凋落物质量,并因此维持或增加土壤呼吸和矿化[17]。土壤细菌群落功能多样性不但受土壤理化性质及其环境条件空间异质性的影响[18],而且也受地上植物群落结构的影响[19]。有研究表明草地不同植物群落特定的枯落物及植物根际分泌物影响土壤细菌群落功能多样性[20]。Ortiz 等[21]研究表明,土壤细菌在一定程度上可以反映草地微生物活性及生态功能。此外,固氮灌木入侵也会改变微生物群落。例如,Malinich 等[22]研究指出,在美国中西部,固氮灌木秋橄榄(Elaeagnus umbellata)对细菌和古细菌群落的优势类群,尤其是对氨氧化微生物的功能基因有显著影响,并且微生物群落的变化与秋橄榄灌木的邻近程度和局部密度有关,即使秋橄榄在相对较低的密度下存在。对于宁夏东部荒漠草原地区,存在大量的20 世纪七八十年代种植的不同间距旱生灌木锦鸡儿属柠条(Caragana korshinskii) 栽植的灌丛林地,用于沙化草地植被重建与生态修复[23],但随着草原非沙化区域灌木种植面积增加,加速了原生草本退化和土壤水分的消耗,并已出现土壤碳氮下降的趋势,表现出稳定性降低,在这一植被转变过程土壤微生物多样性呈下降趋势[10-11,24-26]。虽然已部分了解了该地区人为加速灌丛化过程中的植被-土壤-微生物的变化,但随着灌丛密度的增加土壤细菌群落功能变化和胞外酶活性还待进一步探究。
基于此,本研究以封育草地为对照,选取近30 年不同间距引入灌丛柠条地(40, 6 和2 m)为研究对象,应用Biolog-ECO 方法对不同间距灌丛引入过程土壤细菌碳源利用和酶活性进行研究,揭示土壤细菌碳源利用特征对不同间距人为灌丛引入荒漠草原的响应,为该地区荒漠草原可持续管理提供理论和数据支持。
1 材料与方法
1.1 试验地概况
试验区位于宁夏回族自治区盐池县东北部十六堡至柳杨堡村(37°43′-37°46′ N, 107°16′-107°17′ E),北接毛乌素沙漠,属于黄土丘陵向鄂尔多斯台地的过渡地带,是典型的农牧交错带。平均海拔1450 m,全年平均气温 8.1 ℃,无霜期155~160 d,年均蒸发量2710 mm,年均降水量360 mm,80%以上的降水量集中在5-9 月,其中7-9 月占59% 以上,全年干旱少雨。试验地土壤类型主要以风沙土和灰钙土为主,植被类型有荒漠草原、沙生植被及大量的人工灌丛。自20 世纪八九十年代起,为防止风沙侵蚀以及草地退化,该区域大量引入锦鸡儿属灌木柠条用于植被重建与生态修复,研究区域荒漠草原自2003 年实施禁牧封育,几十年来该区域植被、土壤的结构和功能发生了巨大变化,形成大量草地-灌丛镶嵌体(表1)。

表1 样地概况Table 1 Sites description
1.2 样品采集
选取有代表性样地封育草地(enclosed grassland, EG),并依据柠条种植(90 年代种植)间距划分为:40 m(shrub interval 40 m, SI40)、6 m (shrub interval 6 m, SI6)和2 m (shrub interval 2 m, SI2)研究样地(表1 植被数据为2019 年调查)。其中封育草地随机设置6 个5 m×5 m 样区,柠条引入样地则在跨越带内(灌丛下方)、带间(灌丛间隔)分别设置3 个10 m×10 m 样区为本试验固定监测样区,由此开展相关试验。
土壤样品采集于2020 年8 月中旬,在封育草地(灌丛地)各样区按草下(灌下)与空斑(灌间)分别随机布设5个采样点,去除地表枯落物后用土钻取0~20 cm 土层土壤,各小区按不同微生境混匀作为一个复合样品,装入无菌袋后低温运回实验室,去除根系与碎屑后分为2 份,一份于4 ℃冰箱保存用于微生物生物量碳、细菌数量、酶活性和土壤细菌群落功能多样性测定,另一份在室温下晾干后研磨过筛(2 mm)进行土壤理化因子分析,各分析项目重复3 次。
1.3 土壤理化因子和微生物酶活性测定
土壤化学指标测定参考鲍士旦[27]《土壤农化分析》,土壤pH 采用(水土比2.5∶1)电位计法;土壤有机碳含量(soil organic carbon, SOC)采用K2Cr2O7容量法;土壤全磷含量(total phosphorus, TP)采用钼锑抗比色法(HClO4-H2SO4消煮);土壤全氮含量(total nitrogen, TN)采用凯氏定氮法测定。采用熏蒸提取法测定土壤微生物生物量碳(microbial biomass carbon, MBC)和土壤微生物生物量氮(microbial biomass nitrogen, MBN)。土壤微生物生物量碳用100 mL 0.5 mol·L-1K2SO4提取,用加热的K2Cr2O7-H2SO4消化法测定,并用校正因子(Kc)为0.45 估算熏蒸和未熏蒸土壤中可萃取有机碳差值;用50 mL 2 mol·L-1KCl 提取微生物生物量氮,与茚三酮反应后,通过570 nm 处吸光度测定,校正因子(Ken)为0.54[28]。
本研究分析了参与 C、N 和 P 降解的6 种土壤胞外酶:纤维二糖水解酶、β-1,4-木糖苷酶、β-1,4-葡萄糖苷酶、β-1,4-N-乙酰基氨基葡萄糖苷酶、亮氨酸氨基肽酶和碱性磷酸酶。6 种土壤胞外酶活性均采用 96 微孔板荧光法,使用多功能酶标仪(Tecan Infinite M200 PRO,瑞士)测定[29]。每个小样方土壤样品设置3 个重复,且每个处理均设置空白管作为对照。
1.4 土壤细菌群落功能多样性
本试验采用Biolog-ECO 微平板分析方法,微生物代谢强度采用平均颜色变化率(average well color development, AWCD) 来描述,是利用单一碳源能力的重要指标[30]。主要步骤:Biolog 生态板和 31 种碳基质,将新鲜土样过0.15 mm 筛,取10.0 g 浸入90 mL 无菌生理盐水(0.85%NaCl, W/V)中,用无菌棉花塞封口。混合物在150 r·min-1下振荡0.5 h,静置15 min 后,用移液枪取10 mL 上清液,加入90 mL 无菌生理盐水,混匀后将稀释1000 倍的溶液接种到Biolog-ECO 培养板上,接种好后放入25 ℃暗培养箱中培养168 h,用多功能酶标仪测定Biolog-ECO 板在590 nm 波长处的吸光值,每24 h 测定一次。
1) AWCD 的计算公式是:
式中:Ci是31 种碳源在590 nm 处吸光值,R是对照孔吸光值,n为碳源数目,(Ci-R)为负值的孔被计算为零。
2) Shannon-Wiener 丰富度指数(H):
式中:Pi表示每种碳源与对照孔的吸光度差值和31 种碳源总差值的比值。
3) Shannon 均匀度指数(E):
式中:S代表已利用碳源的总数,即产生颜色变化的孔的数量。
4) Simpson 优势度指数(D):
5) McIntosh 指数(U):
式中:ni为第i孔的相对吸光度,即ni=Ci-R。
上述指标反映了微生物群落的代谢功能多样性,与一般生态学中多样性指数的测定结果相似。通过各样地AWCD 值与培养时间呈先线性增加后在96 h 平行延伸的变化模式,各多样性指数及作图均选用96 h 平均吸光值计算。
1.5 数据统计与分析
利用Microsoft Excel 2010、Word 2010 和SPSS 22.0 软件对数据进行统计分析。采用单因素方差分析(Oneway ANOVA)和 LSD 法进行多重比较(multiple comparison, a=0.05),比较封育草地和不同间距灌丛地之间土壤特性及土壤酶活性的差异;通过对4 个样地土壤细菌代谢进行主成分分析(principal component analysis, PCA)来解释不同间距灌丛引入土壤微生物功能特征的变化;利用Canoco 5.0 软件对土壤理化特性、微生物特性、土壤酶活性和微生物群落功能多样性指数进行冗余分析(redundancy analysis, RDA),揭示土壤细菌群落功能多样性与解释变量之间的关系。使用蒙特卡罗模拟评估了土壤生化变量对解释微生物多样性指数差异的重要性。图表中样地数据为不同微生境下数据加权平均求得,图形由 Origin 2021 进行绘制。
2 结果与分析
2.1 土壤养分变化
由表2 可知,土壤的有机碳(除灌丛间距40 m 外)、全碳和全磷含量均在灌丛地高于封育草地,其中土壤全碳显著增加26.65%~43.47%(P<0.05);土壤pH 和微生物生物量氮则为封育草地高于灌丛地,不同样地间差异显著(P<0.05)。此外,除了土壤全氮和全磷,所有指标均随灌丛密度增加呈先增加后降低的趋势。

表2 不同间距灌丛引入过程各样地与土壤特性Table 2 Various soil biochemical factors during shrub introduction with different intervals(mean±SE)
2.2 土壤胞外酶活性
由表3 可知,除β-1,4-N-乙酰基氨基葡萄糖苷酶在不同间距灌丛引入地高于封育草地,纤维二糖水解酶、β-1,4-木糖苷酶、β-1,4-葡萄糖苷酶、亮氨酸肽酶和碱性磷酸酶活性均低于封育草地,在灌丛地呈降低趋势(除亮氨酸肽酶);其中纤维二糖水解酶、β-1,4-木糖苷酶和碱性磷酸酶活性均为草地显著高于灌丛地(P<0.05),不同间距间差异显著(P<0.05);并且碱性磷酸酶活性在荒漠草原灌丛人为转变过程中均高于其余5 个胞外酶。

表3 不同间距灌丛引入过程土壤酶活性Table 3 Soil enzyme activity during shrub introduction with different intervals (nmol·g-1·h-1)
2.3 土壤细菌群落的代谢活性
由图1 可知,随培养时间推移各样地Biolog-ECO 板中的平均颜色变化率均呈上升趋势,不同样地0~24 h AWCD 较低,表现出明显的滞后现象,随后快速升高直至趋于平稳;不同间距灌丛引入土壤细菌群落的平均颜色变化率,在168 h 后各样地均发生变化,灌丛地均高于封育草地,培养96 h 后AWCD 值为封育草地<灌丛地(间距2 m<间距6 m<间距40 m)。

图1 不同间距灌丛引入过程土壤细菌群落的平均颜色变化率Fig. 1 Variation in the average well color development change of soil microbial communities during introduction with different intervals
由图1 可知,当培养时间达到96 h 时,不同处理间土壤趋于稳定,因此选取培养96 h 的土壤微生物群落代谢活性吸光值,对不同处理的微生物利用碳源底物情况进行主成分分析。由图2 可知,Biolog 板基质可分为糖类(8 种)、羧酸类(9 种)、氨基酸类(6 种)、胺类(2 种)、聚合物类(4 种)和其他类(2 种)6 大类的土壤微生物基质利用率。对于碳源的利用率,灌丛地大于封育草地,并且随着灌丛密度增加,灌丛地对6 类碳源的相对利用率先增加后降低,其中封育草地土壤细菌对氨基酸类、聚合物类和其他类利用水平显著较高, 40 m 灌丛地土壤细菌对氨基酸类利用水平显著较高,6 m 灌丛地土壤细菌对糖类、氨基酸类和聚合物类利用水平显著较高,2 m 灌丛地土壤细菌对氨基酸类和聚合物类利用水平显著较高,荒漠草原灌丛人为引入过程中,不同间距灌丛地对于糖类、氨基酸类和聚合物类利用水平较高(P<0.05)。

图2 不同间距灌丛引入过程土壤细菌对6类平均颜色变化率Fig. 2 Six types average well color development by soil bacteria during shrub introduction with different intervals
2.4 土壤细菌群落功能多样性分析
各样地土壤细菌群落的Shannon-Wiener 丰富度指数、Shannon 均匀度指数、Simpson 优势度指数、McIntosh 指数如表4 所示,不同间距引入灌丛地土壤细菌群落功能多样性各项指数均高于封育草地,在灌丛地随引入密度增加Shannon-Wiener 丰富度指数、Shannon 均匀度指数和Simpson 优势度指数表现为先升后降,McIntosh 指数则为先降后升的趋势。

表4 不同间距灌丛引入过程土壤细菌多样性指数Table 4 Diversity index of soil bacterial during shrub introduction with different intervals
2.5 土壤细菌群落代谢功能主成分分析
由图3 可知,多变量向量被转换为两个不相关的主成分向量,其中,PC1 方差贡献率45.9%,PC2 方差贡献率23.8%,累计方差贡献率为69.7%,说明PC1和PC2 是微生物群落碳源利用变异的主要来源,可以解释变异的绝大部分信息。在PC1 轴上,间距6 m 与间距40 m 灌丛地分布在正方向上,且灌丛地高于草地,其他微生境分布于负方向,在PC2 轴上,除间距2 m 灌丛地外,其余均分布在正方向上。

图3 不同间距灌丛引入过程土壤细菌碳源利用特征Fig. 3 Variation of soil bacterial carbon use during shrub introduction with different intervals
前3 个主成分中载荷数大于0.60 的碳源类型,载荷分数越高,碳源对主成分的影响越大。由表5 可知,有17 种碳源对PC1 有主要影响,其中糖类、羧酸类和氨基酸类各占总碳源(即PC1 包含的17 个碳源总数)的23.5%,胺类和聚合物类各占11.8%,其他混合物类占5.9%;对PC2 与PC3 产生主要影响的碳源分别为4 和3 种,其中氨基酸类对PC2 产生重要影响,羧酸类对PC3 产生重要影响。从上述碳源分析结果可以看出,不同间距灌丛地微生物细菌利用的碳源主要是糖类、氨基酸类和羧酸类。

表5 Biolog-ECO 板中碳基质利用与前3 个主成分(PC1、PC2 和PC3)之间的相关性Table 5 Correlations between carbon substrate utilization in Biolog-ECO and the first three principal components (PC1, PC2 and PC3)
2.6 土壤细菌群落功能多样性与土壤因子相关性
RDA 结果表明,不同间距灌丛引入土壤因子与土壤细菌多样性指数对不同生境总解释变量为98.6%(图4),前两个轴分别解释了碳利用数据中88.5%和10.1%的变异。不同间距灌丛地与封育草地距离较远,因此可以得出不同间距灌丛地显著改变了土壤细菌功能多样性,多样性指数与TC、TP、SOC和C/N 均呈显著正相关,与TN、pH 和两种与碳相关的土壤胞外酶(CBH、BG)呈显著负相关。
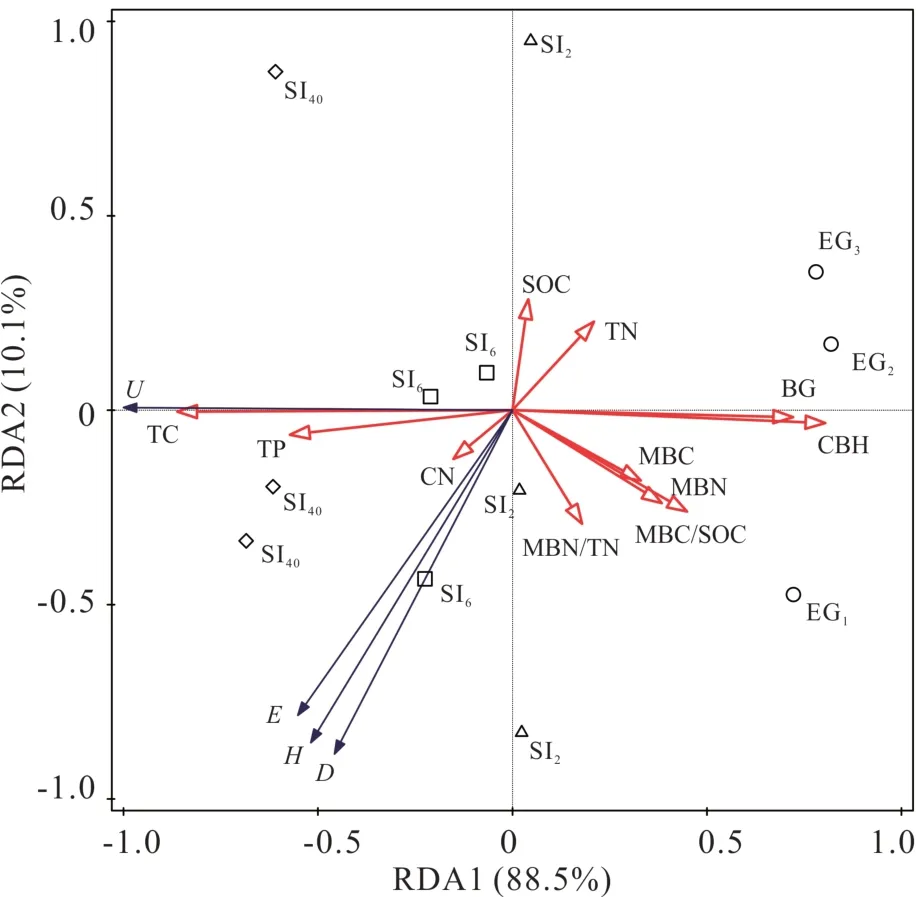
图4 不同间距灌丛引入过程土壤因子与土壤细菌多样性指数的RDA 分析Fig. 4 RDA analysis of soil factors and soil bacterial diversity indexes during shrub introduction with different intervals
3 讨论
3.1 不同间距灌丛引入对土壤理化特性的影响
荒漠草地不同密度柠条引入改变了原生地上植被群落结构和组成,而植被可以通过根系的生长改变土壤结构,植物残体和枯枝落叶被微生物分解为有机物质,改善土壤质量[31]。本研究发现与封育草地相比,灌木引入的土壤全碳和全磷含量显著增加,土壤有机碳虽随引入灌丛密度增加有所提高,但与封育多年草地相比无显著差异,这与Chen 等[32]的研究结果一致。灌木引入形成“沃岛效应”,即灌木下土壤具有较高的养分含量,风沙区适度营造柠条可以改善土壤肥力,起到防风固沙作用,降低风沙区的风力侵蚀[33]。此外,沙化地区适当密度的柠条在一定年限内也能增加沙地植物群落覆盖率和多样性[34]。本研究发现间距6 m 灌丛地的土壤有机碳含量、全碳和碳氮比以及全磷含量相对于其他密度灌丛地显著增强,表明一定年限一定密度下的灌丛生长对土壤具有一定协同性,但随着密度和时间的增加,对土壤水分养分产生负面影响。Mcculley 等[35]研究发现草地向灌木地转变过程中,木质凋落物分解时矿化氮,而草地凋落物倾向于保留氮。柠条锦鸡儿作为固氮植物,在低密度引入时,草地凋落物仍占很大比重,灌木固氮效果大于枯落物矿化速率(即输入大于输出),土壤全氮增加;而随着引入密度增加,灌木枯落物占比增大,其固氮效果小于枯落物矿化速率(即输入小于输出),土壤全氮随之减少。这解释了本研究中土壤全氮的变化规律,与Crofts 等[36]的研究结果一致。相较于封育草地,当引入密度为6 m 间距时长达30 年的生态过程明显变化,达到灌丛引入过程的最适状态,但随着密度的增加,由于水土资源的限制性,出现下降的趋势,其他外来入侵植物也有类似的结果[37]。
土壤微生物在植物养分转运中发挥重要作用并充当一个小型但不稳定的养分库,是植物提供土壤碳和有效养分的重要来源[38]。本研究中,灌木引入导致土壤微生物生物量碳显著增加,并随灌丛密度增加呈先增加后减小的趋势,而微生物生物量氮与封育草地无显著差异。存在于灌丛下方的特定土壤微生物群落或枯落物可能是造成上述结果的原因,因为SOC 中的微生物源碳依赖于微生物量碳和溶解有机碳,细菌残体增加了土壤碳固存,从而影响了微生物量碳的短暂增加[33]。MBC/SOC、MBN/TN 比值用于进一步研究灌木引入对土壤微生物性能的影响,因为这些指标可能反映微生物分解有机物质的效率[39]。本研究表明在灌丛地MBC/SOC 比率随灌丛密度增加先增加后减少,并且间距6 m 灌丛地高于封育草地。这与之前的研究结果一致,封育通过去除放牧压力促进草地的自然恢复,植被、凋落物和根系运输的增加提高了土壤养分的输入,但凋落物的增加在短期内促进了土壤微生物的代谢,增强了土壤酶活性,加快了土壤有机碳的分解代谢[40]。在灌木存在的情况下,有机碳的平均有效性提高,土壤碳库的循环加快[41],对碳素的利用增强。
3.2 不同间距灌丛引入对土壤胞外酶活性的影响
土壤微生物酶活性常被用作评价土壤质量的潜在指标,这主要是因为其对管理和环境因素引起的临时土壤变化反应迅速[42]。土壤酶主要来源于土壤微生物,植物和土壤动物也极易激发土壤胞外酶的分泌,土壤胞外酶可以刺激微生物活性[43]。本研究发现,纤维二糖水解酶、β-1,4-木糖苷酶、β-1,4-葡萄糖苷酶、亮氨酸氨基肽酶和碱性磷酸酶在草地中的活性显著高于灌丛地,并且在灌丛地随引入密度增加而减小,与Chen 等[44]的研究结果相似。主要是灌丛引入近30 年,土壤较封育草地相比,柠条锦鸡儿对深层养分和水分的吸收更多,导致草本植物无法有效与灌木竞争资源,当养分可用性较低时,微生物细菌可以分泌更多酶来满足对养分的需求[45],并且灌木附近枯落物木质化程度高,分解难度大,降低了表层土壤微生物活性,进而使得灌木持续扩张。此外,随灌丛引入密度增加土壤沙化明显,裸露地增加,在沙化风蚀作用下激素有机物质和养分流失,影响了土壤微生物赖以生存的物质基础,反映出部分酶活性较低[46]。土壤养分含量可以通过改变C、N 和P 的化学计量对土壤胞外酶活性产生影响[47]。本研究检测土壤中参与磷循环的酶(即碱性磷酸酶)的活性发现,灌木引入改变了土壤酶活性(表3),这些变化与土壤微生物生物量、土壤养分有关。结果表明,引入灌木对土壤养分的作用强于草本植物,这可能为灌木的继续扩张提供有利条件,并对本地植物产生竞争压力。
3.3 不同间距灌丛引入对土壤细菌碳源利用的影响
在本研究中,AWCD 值在灌丛地显著高于封育草地,随建植密度增加有减小的趋势,说明灌丛引入密度对土壤细菌代谢活性产生差异。并随培养时间推移各样地的平均颜色变化率均呈上升趋势(图2),这与王杰等[48]的研究结果一致,表明灌丛引入极大地改变了土壤微生物对碳基质的利用,碳源开始被大幅度利用,土壤微生物群落代谢增加,活性加强。土壤细菌对6 类碳源利用特征(96 h)表明,封育草地对氨基酸类、聚合物类和其他类碳源利用水平较高,这与敬洁等[49]的研究结果相似。而灌丛地土壤细菌利用的碳源主要是糖类、氨基酸类和聚合物类,说明利用这3 类碳源的土壤细菌最多,且这些土壤细菌的生理代谢活动最强。这可能与植物根系分泌物和土壤养分含量有关。固氮灌木根系分泌物具有丰富的微生物,如根瘤菌属中的细菌在一些微生物作用下可以分解土壤中的氮素养分,同时还能合成氨基酸等物质[50]。而糖类碳源中大部分是植物根系分泌物,比如L-精氨酸、L-苯丙氨酸,说明植物根系分泌物对土壤微生物群落的代谢具有影响,使得微生物对这类碳源产生了一定偏好并提高其利用能力[51],并且土壤微生物与土壤养分显著相关[52],本研究中随建植密度增加,灌丛地土壤有机碳、全碳及微生物量碳表现出低-高-低变化规律。另一方面,碳底物的不同利用将灌丛地与封育草地分开(图3),表明灌丛引入通过改变土壤环境[53],进而显著影响4 个样地土壤细菌代谢能力。因此,随建植密度增加,土壤细菌代谢活性可能也有类似变化规律,这就间接表明建植不同密度灌丛对于草地恢复具有反馈效应。有研究表明微生物群落的分解代谢能力可以被木本植物群落改变[54]。这与本研究观察到的碳利用模式一致。然而,尚不清楚土壤微生物群落水平生理特征的变化和试验地点土壤之间的差异是只能归因于土壤微生物功能的变化,还是归因于群落组成的变化。
3.4 土壤细菌群落功能多样性与土壤因子的关系
本研究发现,土壤细菌群落功能多样性与C/N、SOC、TP、TC 均呈显著正相关,与TN、pH 和纤维二糖水解酶、β-1,4-木糖苷酶呈显著负相关,表明土壤养分、pH 和胞外酶活性可能在解释细菌碳源利用方面较为重要。土壤有机碳作为土壤的重要组成部分,不仅与土壤肥力密切相关,而且对微生物多样性有着重要影响。Li 等[38]在不同植被类型恢复过程对碳源利用影响的研究也发现,土壤有机碳是微生物细菌群落功能多样性变化的关键影响因素,但主要驱动因素也会随不同植被类型而变化,其中土壤pH、有机碳和全氮几乎影响所有类型的微生物群落功能多样性。土壤养分变化引起土壤酶活性差异也会影响土壤微生物功能多样性,土壤酶活性作为微生物活性的指示物,与微生物功能多样性显著相关[29]。本研究不同的酶与细菌碳源利用多样性关系不同,其中与碳相关的纤维二糖水解酶、β-1,4-木糖苷酶活性与土壤微生物多样性负相关,这可能与植被枯落物组分变化有关[55]。灌丛附近较厚的枯落物层木质化程度高,分解难度加大,降低了表层土壤微生物代谢活性,从而降低枯落物的分解作用[56]。同时,灌木可以在禾本科草类无法到达的深度吸收土壤养分和水分,在降水量较少的荒漠草原,草本生长减缓,导致浅层土壤微生物的生长和繁殖受到抑制,其体内胞外酶产出减少,从而降低胞外酶活性[24]。土壤酶活性的高低不但可以反映土壤有机物质的分解与转化过程,还能反映出对碳源利用能力的高低[42]。综上所述,土壤环境因子是影响灌丛地土壤微生物群落功能多样性变化的主要因素。比较本研究中土壤微生物群落的碳利用和土壤因子,结合微生物群落数据,可以从多个方面更全面地评价不同密度的灌木引入土壤中微生物群落的变化。
4 结论
荒漠草原灌丛引入近30 年过程中,0~20 cm 土层土壤全碳和全磷显著增加,土壤有机碳在不同间距处略有升高或减少。纤维二糖水解酶、β-1,4-木糖苷酶和碱性磷酸酶活性随灌丛密度增加被显著抑制。土壤细菌碳源的利用能力和多样性指数均在灌丛地高于封育草地,随灌丛密度增加受到显著抑制,并受到土壤养分和微生物生物量碳的正向调控以及胞外酶的负向调控作用。土壤酶活性与土壤环境因子共同驱动土壤细菌群落功能多样性,且全碳和全磷是影响荒漠草原不同间距灌丛引入土壤细菌群落功能多样性变化的主要因子。综上,不同间距灌丛引入不仅提高了土壤细菌对不同碳源利用程度,也改变了主要碳源利用类型,从草地的氨基酸类、聚合物类和其他类碳源利用为主转向随灌丛密度增加以聚合物类和氨基酸类稳定利用为主。

