N3敏化SrCO3修饰纳米晶TiO2电极的光电化学性质研究
王纪超 , 邓开坊
(河南省化工研究所有限责任公司 , 河南 郑州 450052)
染料敏化纳米晶TiO2太阳能电池(DSSCs)具有成本低、制备工艺简单、转化效率高等优点,引起越来越多研究者的兴趣。经过多年的研究,GRTZEL教授研究小组已经制备并获得了能量转化效率可达11%的染料敏化太阳能电池。纳米晶太阳能电池具有较大的比表面积,可以吸附大量的染料分子,提高电池的光捕获能力,增强对可见光的吸收效率,从而提高了太阳能电池的光电转化效率。但是,由于在半导体电极与电解质之间缺少耗尽层,太阳光照射产生的电子注入到半导体导带中,容易与电解质中的氧化性物质发生电荷复合,导致电子在电池传输过程中过渡损耗,成为染料敏化太阳能电池光电转化效率不高的主要因素[1]。
目前,最常用的一种途径是通过在TiO2电极表面修饰一层绝缘体来改善染料敏化太阳能电池的转化效率,例如MgO、CaCO3,也有采用还原氧化石墨烯等进行表面修饰[2]。修饰层能够隔离注入电子与电解质中的氧化还原电对,有效抑制电极表面的电荷复合,改善电池的光电转化效率。众多研究成果显示,用CaTiO3、硫化物等来修饰TiO2电极,太阳能电池的光电转化效率均有不同程度的提升,取得了非常好的效果[3-5]。本文报道了SrCO3修饰TiO2电极(表示为TiO2/SrCO3)的制备方法,研究了修饰层对太阳能电池光电化学性质的影响。
1 实验部分
1.1 试剂与材料
F-掺杂SnO2导电玻璃,武汉格奥科教仪器有限公司。无水乙醇、硝酸锶、碳酸钠,分析纯,天津化学试剂公司。氢氧化钠、四氯化钛,分析纯,北京化学试剂有限公司。碘,分析纯,天津市永大化学试剂开发中心。丙烯碳酸酯、碘化锂、4-叔丁基吡啶(TBP),分析纯,Acros公司。高氯酸四丁基铵(TBAP)、高氯酸锂、乙腈,分析纯,上海诺泰试剂有限公司。染料Ru[L2(NCS)2](L=2,2′-联吡啶-4,4′-二羧酸)(简称N3),优级纯,Solaronix公司。1-甲基-3-丙基碘化咪唑(PMII)参照文献[6]合成。
1.2 电极的制备
纳米晶TiO2电极:TiO2胶体和薄膜的制备参照文献[7]。使用的导电玻璃为2 cm×4 cm大小,用透明胶带盖住的导电玻璃的两个长边,固定在实验台上,形成一个凹槽。在凹槽上均匀地滴几滴TiO2胶体溶液,用玻璃棒均匀地铺开,制成厚度均匀的TiO2薄膜,红外灯下烤干后在450 ℃下烧结活化30 min[7]。将活化好的TiO2电极在0.05 mol/L的TiCl4溶液中浸泡24 h,用去离子水冲洗3次,干燥后在450 ℃下烧结30 min,得到纳米晶TiO2电极。
SrCO3修饰TiO2电极:SrCO3是一种沉淀物,采用沉淀的方法将SrCO3修饰到TiO2电极表面[8]。将制备好的纳米晶TiO2电极放入饱和Sr(NO3)2溶液中浸泡1 min,取出;去离子水冲洗3次,再放入0.1 mol/L的Na2CO3溶液中浸泡3 min,取出;去离子水冲洗3次,用吹风机吹干。不断重复上面的操作,达到所需的SrCO3修饰层厚度。修饰后的电极在500 ℃下烧结30 min,冷却到室温,得到用SrCO3修饰TiO2电极,用TiO2/SrCO3表示。
制备好的TiO2/SrCO3电极或TiO2电极温度降到80 ℃时,在5×10-4mol/L的N3乙醇溶液中浸泡12 h,取出用无水乙醇冲洗3次,吹风机吹干,即得N3染料敏化TiO2和TiO2/SrCO3电极。
1.3 测试方法
Tensor27型红外光谱仪(德国布鲁克公司)用来测定TiO2/SrCO3电极的红外光谱。岛津UV-1240紫外-可见吸收光谱仪用来测定N3敏化TiO2/SrCO3电极表面吸附染料的吸收光谱,测定前将薄膜上吸附的N3染料在0.1 mol/L碱的醇溶液中进行脱附,测定醇溶液的吸收光谱。在CH800电化学分析仪的三电极体系中测量电极的电化学性质,工作电极、对电极和参比电极分别为TiO2/SrCO3电极或TiO2电极、铂丝电极和饱和Ag/AgCl电极,工作面积为3 cm2。
光谱电化学测试方法参照文献[9]。实验过程中用氮气对电解质溶液进行除气。光电化学性质在二电极体系中测量,N3敏化TiO2/SrCO3或TiO2电极作为光阳极,镀金属铂层的导电玻璃作为光阴极,照射光源为500 W的氙灯,为了防止电极产生热电流以及紫外光激发二氧化钛,在光路上放置一片IRA-25S红外滤光片和GG420截止滤光片,电极的有效照射面积0.196 cm2。电解质为:0.5 mol/L LiI,0.05 mol/L I2,0.5 mol/L TBP和0.3 mol/L 1-甲基-3-丙基碘化咪唑,溶剂是乙腈与丙稀碳酸酯体积比为1∶1的混合溶剂。
2 结果与讨论
2.1 红外光谱
为了验证SrCO3的信息,测定了TiO2电极和TiO2/SrCO3电极的红外光谱,见图1。
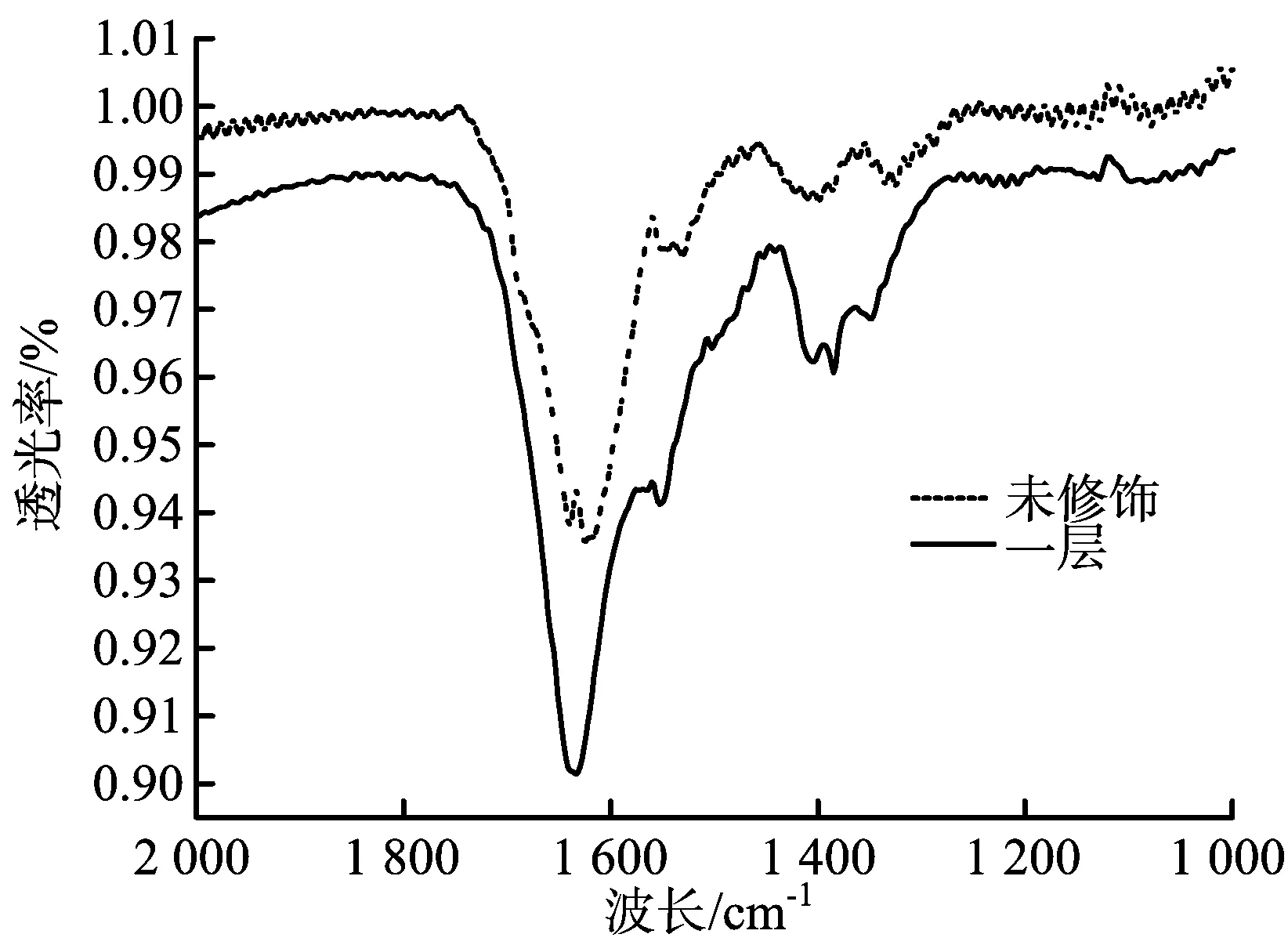
图1 TiO2和TiO2/SrCO3电极的红外光谱
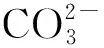
2.2 染料吸附量
电极表面的染料吸附量与DSSCs的光电化学性能密切相关。将N3染料敏化后的TiO2/SrCO3电极在0.1 mol/L的碱性醇溶液中进行脱附,测定脱附后的染料溶液的吸收光谱,来研究SrCO3修饰层对电极表面染料吸附量的影响。图2显示了N3敏化的TiO2电极和TiO2/SrCO3电极的吸收光谱。
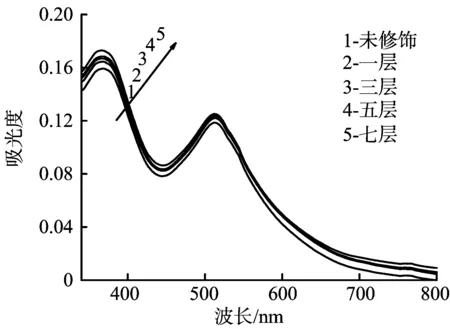
图2 TiO2和TiO2/SrCO3电极的吸收光谱
从图2可以看出,TiO2/SrCO3电极脱附的染料溶液的吸光度在整个可见区内都比未修饰的TiO2电极的吸光度强。说明SrCO3表面修饰后,TiO2电极表面染料的吸附量增加,因为SrCO3修饰层使TiO2电极表面碱性增强,N3分子中的羧基更容易吸附到碱性表面,染料的吸附量会增大[11]。随着SrCO3修饰层厚度的增加,吸光度从0.119 5分别增加到0.122 8、0.123 1、0.124 4和0.125 9。经计算,TiO2和不同修饰层厚度TiO2/SrCO3电极表面的N3染料量分别为8.52×10-8、8.78×10-8、8.83×10-8、8.92×10-8、9.06×10-8mol/cm2。
2.3 平带电势
分别研究了在含有TBAP的电解质溶液和含有LiClO4的电解质溶液中,SrCO3修饰层对TiO2电极的导带位置和陷肼态的影响。
2.3.1含有TBAP的电解质溶液中
为了研究SrCO3修饰层对TiO2电极能带结构的单独影响,通过测定不同厚度的TiO2/SrCO3电极在吸光度为780 nm光波长处的变化,以此得到电极的平带电势,电解质为含有0.2 mol/L TBAP的乙腈溶液,结果见图3。
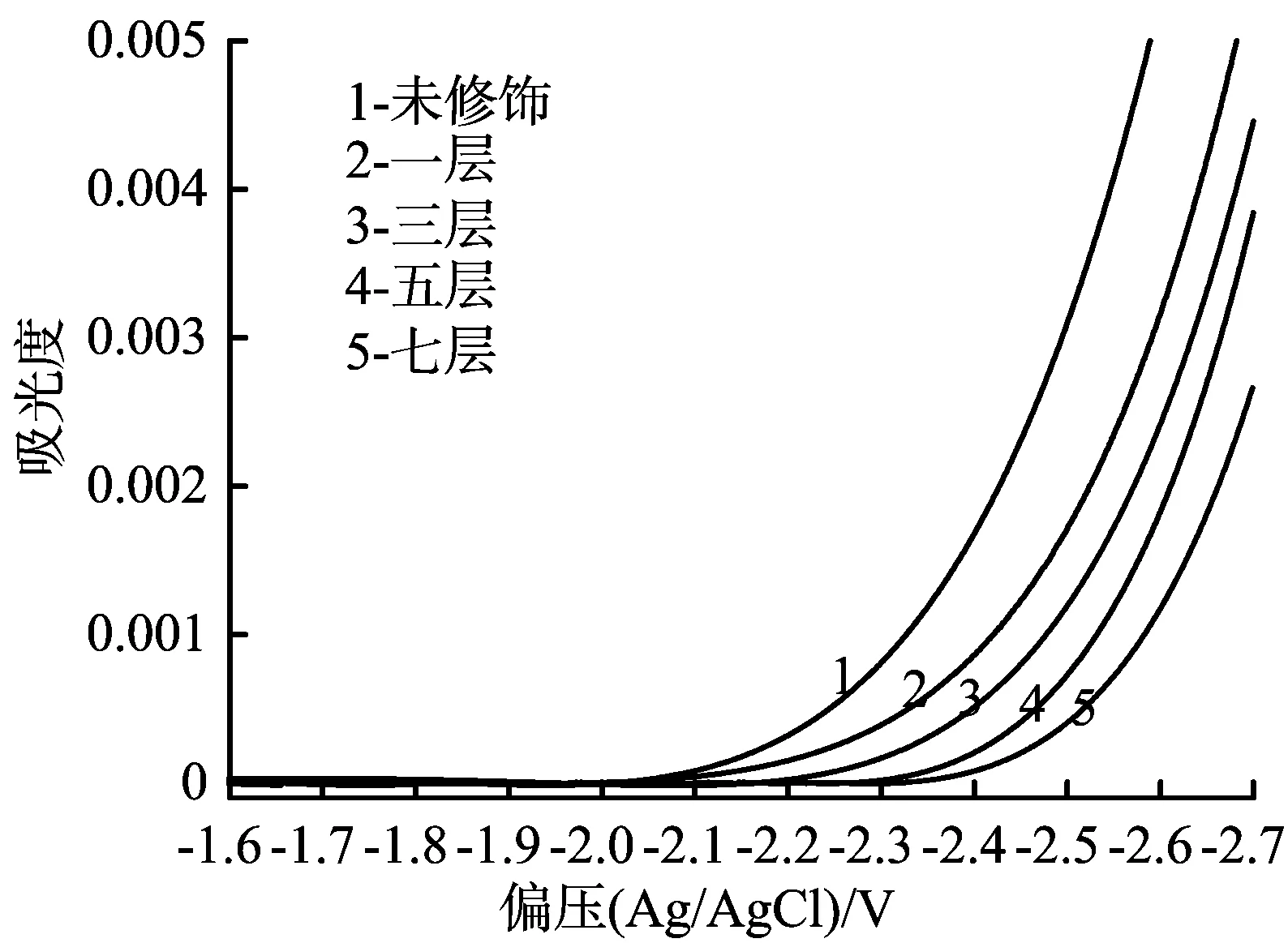
图3 TiO2/SrCO3电极在含有0.2 mol/LTBAP的乙腈溶液中吸光度随偏压的变化关系曲线
从图3可以看出,修饰了0、1、3、5和7层的TiO2/SrCO3电极的平带电势分别为-2.05、-2.06、-2.18、-2.30和-2.35 V。SrCO3修饰层使TiO2电极的Efb发生负移,因为SrCO3修饰层在节点以下有很强的亲和性,可以吸附填充表面的陷阱态,从而改变电荷分布和平带电势的位置[12]。
2.3.2含有LiClO4的电解质溶液中
为了进一步研究SrCO3修饰层和Li+离子对TiO2电极平带电势的协同作用,测定了不同厚度的TiO2/SrCO3电极在吸光度在780 nm光波长处的变化,得到电极的平带电势,电解质为0.2 mol/L LiClO4的乙腈溶液,结果见图4。

图4 TiO2/SrCO3电极在含有0.2 mol/L LiClO4的乙腈溶液中吸光度随偏压的变化关系曲线
从图4可以看出,修饰了0、1、3、5和7层的TiO2/SrCO3电极在0.2 mol/L LiClO4的乙腈溶液中平带电势均为-0.7 V,在0.2 mol/L TBAP的乙腈溶液中平带电势发生正移,这是由于Li+的吸附-嵌入使电极和电解质界面的Efb发生正移[13]。结果表明,在Li+离子的协同作用下,SrCO3修饰层对纳米晶TiO2电极的导带位置影响很小。
2.4 陷阱态
2.4.1含有TBAP的电解质溶液中的电流-时间曲线
为了研究SrCO3修饰层对TiO2电极的陷阱态的单独影响,测定了在0.2 mol/L TBAP的乙腈溶液中,不同厚度的TiO2/SrCO3电极在不同偏压下的电流-时间曲线。图5a显示了未修饰的TiO2电极在0.2 mol/L TBAP的乙腈溶液中的电流-时间曲线。
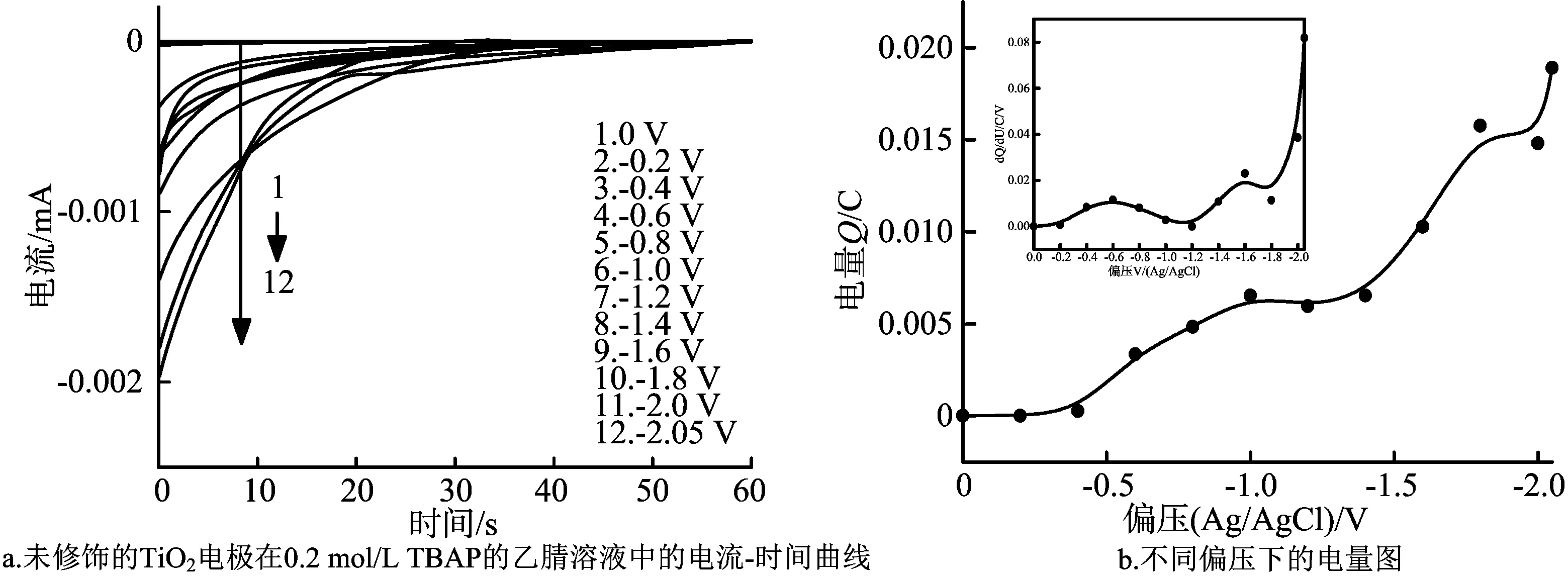
图5 显示dQ/dU对偏压的关系
由图5a可知,当偏压从0到-0.4 V时,电流快速降为0。当偏压为-0.6 V或者更高时,电流下降速率减缓,这是能带隙区陷阱态的填充造成的结果。当偏压<-0.4 V时,电极表面陷阱态密度比较小,态填充的时间比较短,电流衰减的也较快。当偏压>-0.4 V时,电极表面陷阱态密度逐渐增大,态填充所需要的时间逐渐延长,电流衰减的比较慢。陷阱态填充的时间最长是在偏压为-2.0 V时,处于TiO2电极的导带边附近。当进一步施加更高的偏压时,陷阱态的填充时间缩短,这是因为施加更高的偏压时,态填充的驱动力比较大,陷阱态的填充速率提高,填充时间就会缩短,电流衰减的速率变慢。
通过图5a中时间-电流曲线积分计算出电量,得出电量与偏压的关系,如图5b所示。从图5b可以看出,当偏压<-0.4 V时,电量接近于0。当偏压>-0.6 V时,电量Q快速增加,但是当偏压进一步增大时,电量增加开始变得缓慢。电量与态密度存在如下关系[14]:
(1)
式中:Q,电量;Ntrap(U),电势为U时的陷阱态密度;q,电子电量。
式(1)表明陷阱态与dQ/dU成正比,可以用来测量陷阱态的分布。图5b中的插图表明了电极表面陷阱态的分布情况。计算可得,未修饰的TiO2电极陷阱态密度为4.63×1016cm-2。
修饰了1、3、5和7层TiO2/SrCO3电极在0.2 mol/L TBAP的乙腈溶液中的电流-时间曲线和电量-偏压的曲线与未修饰的TiO2电极类似,不再给出。计算可得,修饰了1、3、5和7层的TiO2/SrCO3电极在0.2 mol/L TBAP的乙腈溶液中的陷阱态密度分别为4.04×1016、3.25×1016、3.13×1016、3.06×1016cm-2。陷阱态密度与修饰层厚度的关系曲线见图6。
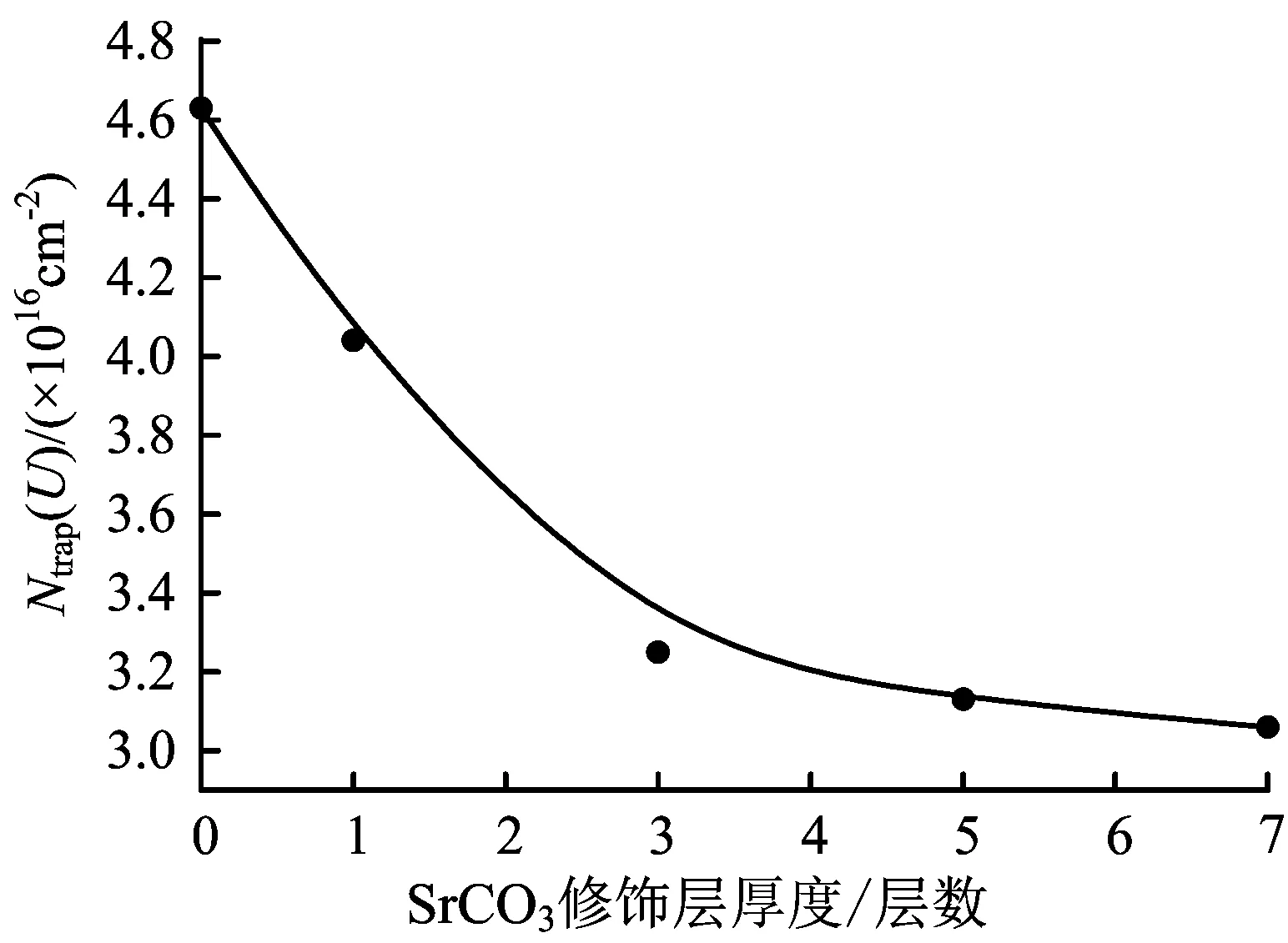
图6 在0.2 mol/L TBAP的乙腈溶液中陷阱态密度与SrCO3层厚度的关系曲线
从图6可以看出,随着SrCO3层厚度的增加,Ntrap(U)不断减小。由于SrCO3修饰层对未配位的陷阱点有很强的亲和力,更易与表面陷阱点结合,改变表面态的能级,从而使电极的陷阱态密度减小。
2.4.2含有LiClO4的电解质溶液中的电流-时间曲线
为了进一步研究SrCO3修饰层和Li+离子对TiO2电极陷阱态的协同作用,测定了不同厚度的TiO2/SrCO3电极在含有0.2 mol/L LiClO4的乙腈溶液中,不同偏压下的电流-时间曲线。图7a显示了未修饰的TiO2电极在0.2 mol/L LiClO4的乙腈溶液中的电流-时间曲线。从图7a可知,当偏压从0到-0.4 V时,电流快速降为0。当偏压为-0.6 V甚至更高时,电流下降速度减缓。这是由于当偏压<-0.6 V时,陷阱态密度较小,填充所需的时间较短,电流衰减的也比较快;当偏压>-0.6 V时,陷阱态密度逐步增大,填充所需要的时间更长,电流衰减的速度变慢。从图7b可以看出,当偏压<-0.4 V时,电量非常小,几乎为0。当偏压>-0.4 V时,电量快速增加。计算可得,未修饰的TiO2电极陷阱态密度为4.90×1015cm-2。
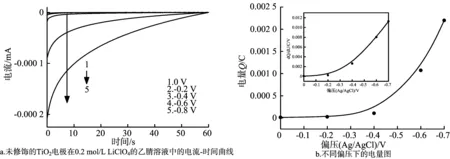
图7 dQ/dU与偏压的关系
修饰了1、3、5和7层SrCO3层的TiO2电极在0.2 mol/L LiClO4的乙腈溶液中的电流-时间曲线和电量-偏压的曲线与未修饰的TiO2电极类似,不再给出。计算可得,修饰了1、3、5和7层的TiO2/SrCO3电极在0.2 mol/L LiClO4的乙腈溶液中的陷阱态密度分别为4.44×1015、4.12×1015、4.06×1015、4.02×1015cm-2。陷阱态密度与修饰层厚度的关系曲线见图8。
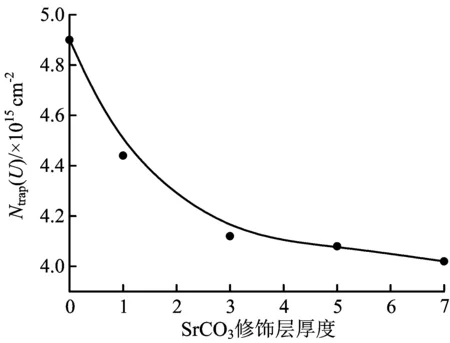
图8 在0.2 mol/L LiClO4的乙腈溶液中陷阱态密度与SrCO3层厚度的关系曲线
从图8可以看出,在Li+离子的协同作用下,TiO2电极的陷阱态密度进一步减小。
2.5 光电转化效率
以上研究可以看出,SrCO3修饰层对TiO2电极的平带电势Efb和陷阱态分布均有非常大的影响;但是在Li+离子的协同作用下,SrCO3修饰层对TiO2电极的平带电势Efb影响不大,对TiO2电极的陷肼态密度影响很大。Efb和陷阱态密度对DSSCs的光电化学性能密切相关,因此研究不同厚度的SrCO3修饰层对TiO2电极的光电转化效率的影响非常重要。不同厚度的TiO2/SrCO3电极在100 mW/cm2光强照射下的光电流-光电压特性曲线见图9。计算得到电池的各项光电转化参数见表1。
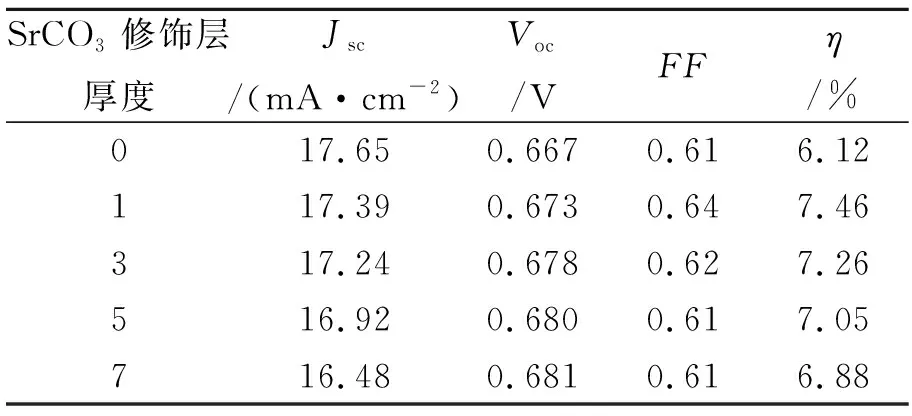
表1 N3敏化TiO2或TiO2/SrCO3太阳能电池的光电参数
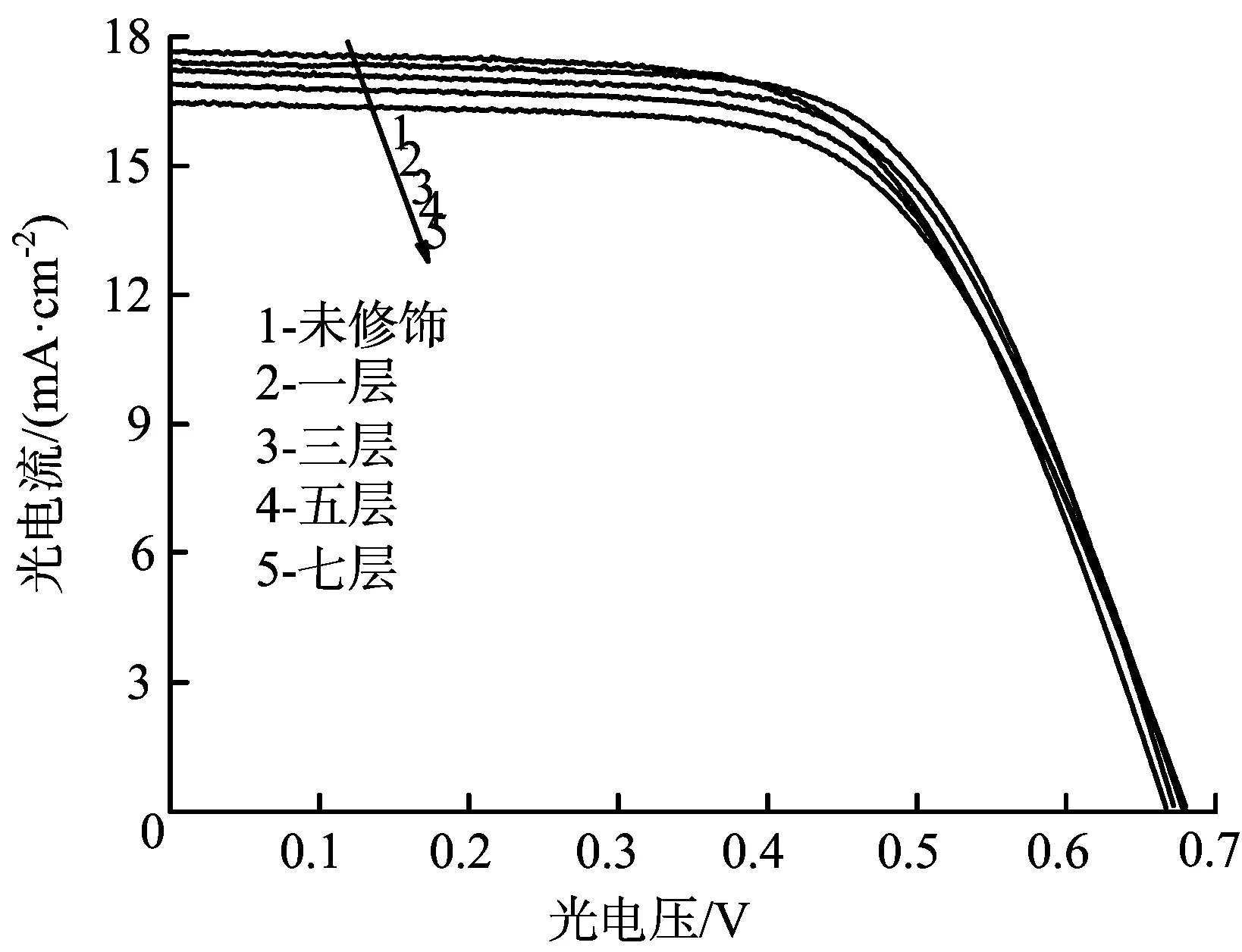
图9 在N3敏化TiO2或TiO2/SrCO3太阳能电池在100 mW·cm-2光强照射下的光电流-光电压特性曲线
从表1可以看出,N3敏化TiO2/SrCO3太阳能电池与未修饰的TiO2电池相比,Voc、FF和η都有所提升,Voc随着修饰层厚度的增加而提高。由于SrCO3修饰层对TiO2电极的导带边的单独影响比较大,与Li+离子协同作用下,对TiO2电极的导带边影响不大,说明TiO2/SrCO3太阳能电池的光电转化效率的提高不是由于导带边移动的影响。修饰SrCO3层后,TiO2电极的陷阱态明显减小,在Li+离子的协同作用下,TiO2电极的陷阱态密度进一步减小,有效地抑制了电极表面的电荷复合,从而改善了电极的光电压Voc。结果显示,修饰一层SrCO3的电池的光电转化效率最大达到7.46%,与未修饰TiO2电极相比增加了21.9%。
3 结论
本文研究了SrCO3修饰层对TiO2电极表现N3染料吸附量及对电极的电化学和光电化学性能的影响。研究发现:①SrCO3修饰后,电极表面的染料吸附量增大;②SrCO3修饰层对TiO2电极的平带电势有明显影响,修饰后使TiO2电极陷阱态密度明显减小;在Li+的协同作用下,SrCO3修饰层对TiO2电极的平带电势影响很小,但是能进一步减少电极的陷阱态密度;③SrCO3修饰层能够有效抑制电极的电荷复合,从而改善了电池的光电压和光电转化效率。结果显示,N3敏化修饰一层SrCO3的TiO2太阳能电池在100 mW/cm2光照射下的光电转化效率值最大,达到7.46%,转化效率提高了21.9%。

