基于网络药理学和分子对接技术探讨蔓荆子防治急性心肌梗死的作用机制
陈礼琴,徐彤彤,吕祥威,武 琦,覃秋语,赵位昆
急性心肌梗死(acute myocardial infarction,AMI)是一种常见的心血管疾病,其主要特征是冠状动脉闭塞后心肌长时间处于缺血状态进而导致心肌细胞发生不可逆性损伤[1]。早期及时的血运重建是目前治疗AMI的主要措施,通常采用经皮冠状动脉介入术或溶栓治疗,这些治疗方法能够迅速恢复血供,但是经再灌注治疗后AMI病人的死亡率仍居高不下[2]。因此,积极研发防治AMI的有效治疗药物具有非常重要的意义。
近年来,随着中医学多靶点、全方位的治疗理念不断推进,中药在心血管领域的重要性不断提升。单纯西药干预治疗存在一定不良反应且治疗效果有限。中药不同于西药,具有多靶点、多通路、多环节的治疗特点,其副作用也相对较轻。蔓荆子是马鞭草科牡荆属植物的干燥成熟果实,具有抗炎、抗菌、抗氧化等药理活性[3]。其成分中含有牡荆子黄酮,即紫花牡荆素,经研究表明,紫花牡荆素可通过多种途径抑制心肌缺血再灌注损伤,对心血管系统疾病有一定的治疗作用,其作用机制可能与抑制炎症反应、氧化反应、细胞凋亡等相关[4]。但是蔓荆子在AMI中的作用尚不清楚,故本研究拟通过网络药理学结合分子对接探讨蔓荆子防治AMI的潜在靶点以及作用机制。
1 资料与方法
1.1 蔓荆子有效成分及其靶点获取
应用中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP,https://tcmsp-e.com/tcmsp.php),以草本名称(herb name)“蔓荆子”进行检索,限定口服利用度(OB)≥30%和类药性(DL)≥18%筛选有效成分并通过TCMSP数据库获得相应化合物对应的靶点。满足筛选条件但是未能在TCMSP数据库获得相应作用靶点的化合物,搜索其CAS号并输入PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)以获取其Canonical SMILES号。通过SwissTargetPrediction平台(http://www.swisstargetprediction.ch),物种选择为“Homo sapiens”,将预测出的靶点取Probability>0的前15位作为补充。应用UniPort数据库(https://www.uniprot.org),以物种为人类且为已验证的基因作为筛选条件,对预测的药物靶点名称进行校正,统一为GeneSymbol。
1.2 AMI疾病靶点收集
以“acute myocardial infarction”为检索词,物种限定为“Homo sapiens”,通过GeneCards数据库(https://www.genecards.org/)、DisGeNET数据库(https://www.disgenet.org/)、TTD数据库(http://db.idrblab.net/ttd/)、OMIM数据库(https://www.omim.org/)进行检索并获得AMI疾病的基因靶点。
1.3 药物-药物化合物-靶点网络图的构建
运用Rstudio 4.1.3软件中的“VennDiagram”程序包绘制韦恩图,获取蔓荆子活性成分与AMI疾病的交集,并将交集靶点作为蔓荆子治疗AMI的潜在靶点。除去蔓荆子与疾病靶点未存在交集的有效成分,将药物有效成分的Mol ID与共有靶点导入Cytoscape 3.9.1[5]软件中构建“药物-药物化合物-靶点”可视化网络图。利用Network Analyzer工具,计算各节点的连接度(Degree)值,节点代表药物、化合物或靶点,节点之间的连接代表其存在相互作用,节点的Degree值代表节点之间相连的数目。
1.4 蛋白-蛋白相互作用(PPI)网络图的构建
将交集靶点输入STRING数据库(https://cn.string-db.org/),筛选条件为物种“Homo sapiens”、最低相互作用得分≥0.4、去除在网络中断开的节点,以TSV格式导出相应结果,将文件导入Cytoscape 3.9.1,构建PPI网络。设置节点的大小、颜色与Degree值成正比,Degree值越大,节点越大,颜色越深。通过Cytohubba插件对PPI网络进行筛选分析,分别以MCC、MNC、Degree、Betweennesss、Radiality计算前20个核心基因,取其交集,获取关键靶点。MCC在Cytohubba中具有更高的可信度[6],故将获得的关键靶点按照MCC降序排列。
1.5 基因本体(gene ontology,GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析
利用Rstudio 4.1.3及Bioconductor数据库的“org.Hs.eg.db”程序包将交集靶点的基因symbols转化为Entrez IDs,随后利用“ClusterProfiler”程序包对网络进行GO富集分析和KEGG富集分析。选取P<0.05的条目分别绘制GO及KEGG富集分析结果图,筛选出交集靶点所涉及的分子功能(molecular function,MF)、细胞组成(cellular component,CC)、生物过程(biological process,BP)以及信号通路的前20项。
1.6 分子对接验证
通过PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)搜索关键靶点对应的化合物并下载其sdf格式的三维结构,利用OpenBabel 3.1.1将sdf格式转化为pdb格式,应用蛋白晶体结构数据库(PDB,https://www.rcsb.org/)搜索关键靶点并下载其三维结构。通过PyMOL 2.4.0和AutoDockTools 1.5.7(ADT)软件对受体和配体进行常规处理,输出pdbqt格式,借助AutoDock Vina对受体和配体进行分子对接[7]。使用Lamarckian(拉马克)遗传算法进行分子对接计算,根据结合自由能评估最终对接结构,靶蛋白受体与化合物配体之间的结合自由能越小,则亲和能力越强。将结果再导入PyMOL 2.4.0进行可视化处理。
2 结 果
2.1 蔓荆子中活性成分及其靶点的筛选
在OB≥30%和DL≥18%的筛选条件下,通过TCMSP数据库收集到27个药物活性成分。获取相应化合物对应的靶点,通过SwissTargetPrediction平台进一步补充,汇总后去除重复值,蔓荆子有效成分对应靶点基因共计226个。详见表1。
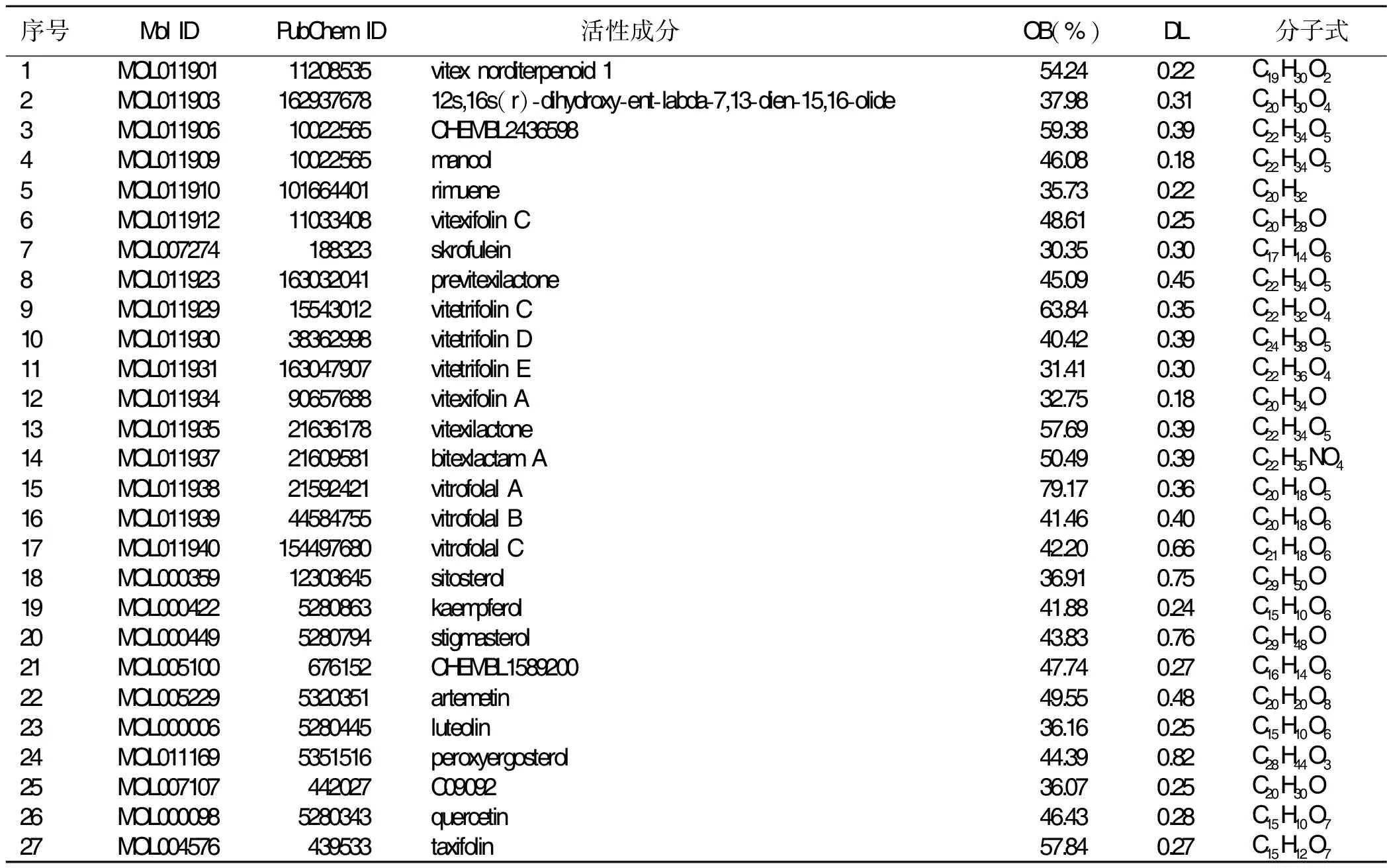
表1 蔓荆子中活性成分
2.2 蔓荆子活性成分与AMI疾病交集基因
通过GeneCards、DisGeNET、TTD、OMIM数据库检索“acute myocardial infarction”,得到靶点基因4 676个,去除重复后最终得到4 184个AMI疾病靶点基因。将226个药物靶点与4 184个疾病靶点取交集得到交集靶点185个,即蔓荆子治疗AMI的潜在靶点。详见图1。
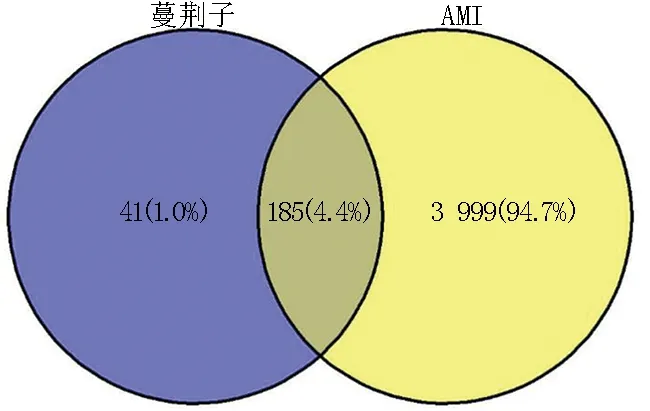
图1 蔓荆子活性成分与AMI疾病交集靶点韦恩图
2.3 “药物-药物化合物-靶点”网络
基于药物与疾病靶点交集的185个靶基因及其有效成分,通过Cytoscape 3.9.1软件,构建蔓荆子抗AMI的药物-药物化合物-靶点网络图。该网络包括212个节点(其中黄色凹四边形代表的是蔓荆子药物,蓝色菱形代表的是药物化合物Mol ID,红色圆形代表交集基因靶点)、415条边,根据各节点的Degree值,排序后发现蔓荆子中最主要的5个活性化合物依次为:槲皮素(quercetin)、木犀草素(luteolin)、山柰酚(kaempferol)、豆甾醇(stigmasterol)、牡荆素C(vitexifolin C)。详见图2。
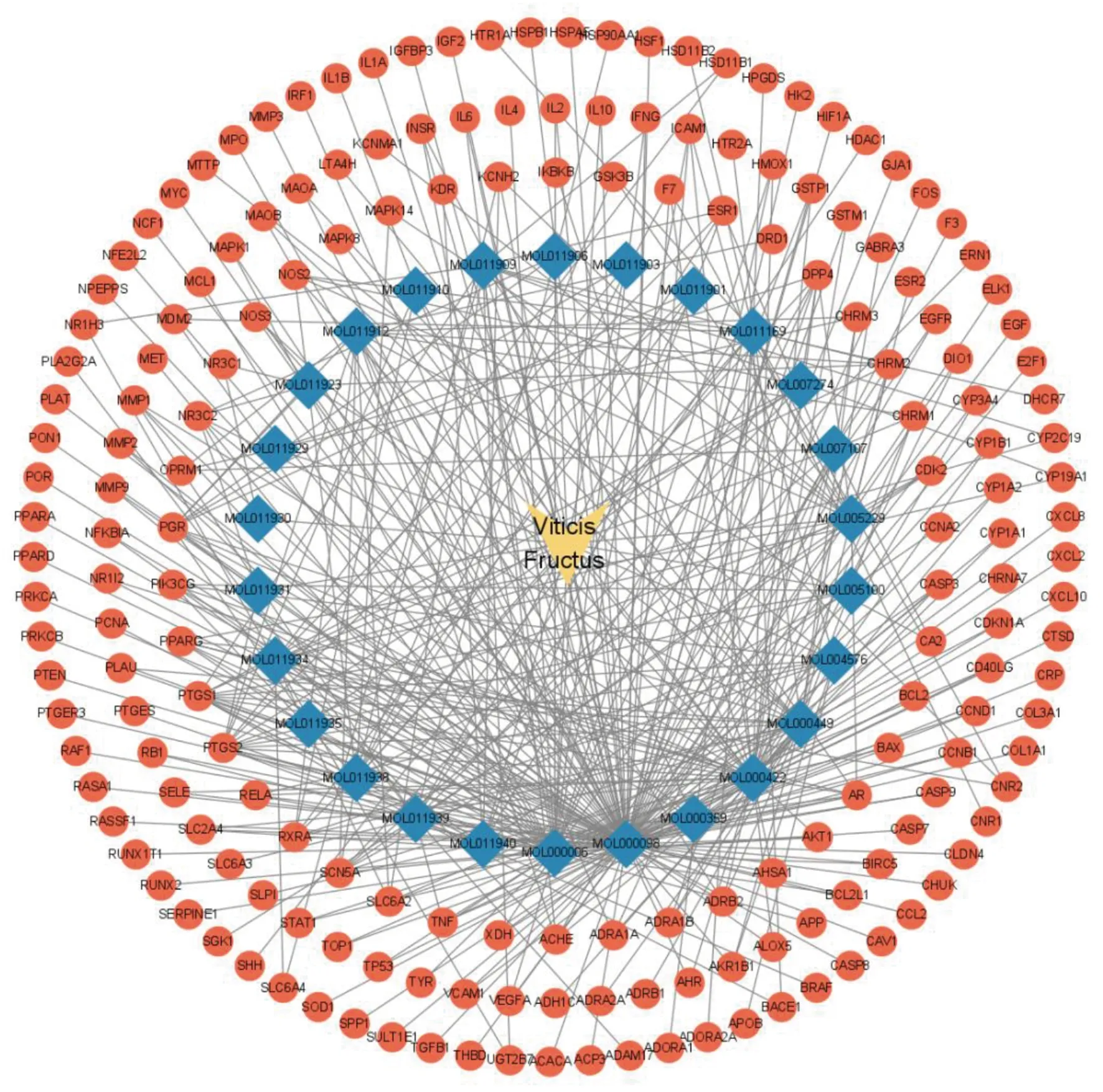
图2 药物-化合物-靶点网络图
2.4 PPI网络构建及关键靶点的选取
将交集靶点导入STRING数据库进行PPI网络分析,保存STRING数据库生成的PPI网络图,每条边代表蛋白质和蛋白质之间的相互作用(见图3)。将输出的TSV格式文件导入Cytoscape 3.9.1软件,构建PPI网络图(见图4),用于后续核心靶点的筛选。网络中显示的线越多,关联度越大,PPI网络中交集靶点的排名也越高。PPI网络图中包含184个节点、3 473条边,通过Degree值进行排列,Degree值越大,节点越大,颜色越深。利用CytoHubba插件对PPI网络图进行分析,分别设置MCC、MNC、Degree、Radiality、Betweennesss计算前20个核心基因,然后通过Rstudio 4.1.6利用“VennDiagram”程序包绘制韦恩图(见图5),取其交集,获得11个关键靶点,按照MCC降序排列,依次为α-丝氨酸/苏氨酸蛋白激酶1(AKT1)、血管内皮生长因子A(VEGFA)、前列腺素G/H合酶2(PTGS2)、半胱氨酸蛋白酶-3(CASP3)、肿瘤坏死因子(TNF)、白细胞介素-6(IL-6)、基质金属蛋白酶9(MMP9)、白细胞介素-1β(IL1B)、细胞肿瘤抗原p53(TP53)、蛋白c-Fos(FOS)、磷酸酶和张力蛋白同源基因(PTEN),详见表2。在PPI网络中提取上述11个关键靶点创建子集以构建PPI核心网络(见图6)。该网络中有11个节点、55条边。按照MCC降序从红到黄变化,颜色越红,意味着其在MCC中排名越靠前。排名最前的为AKT1,排名最末为PTEN。
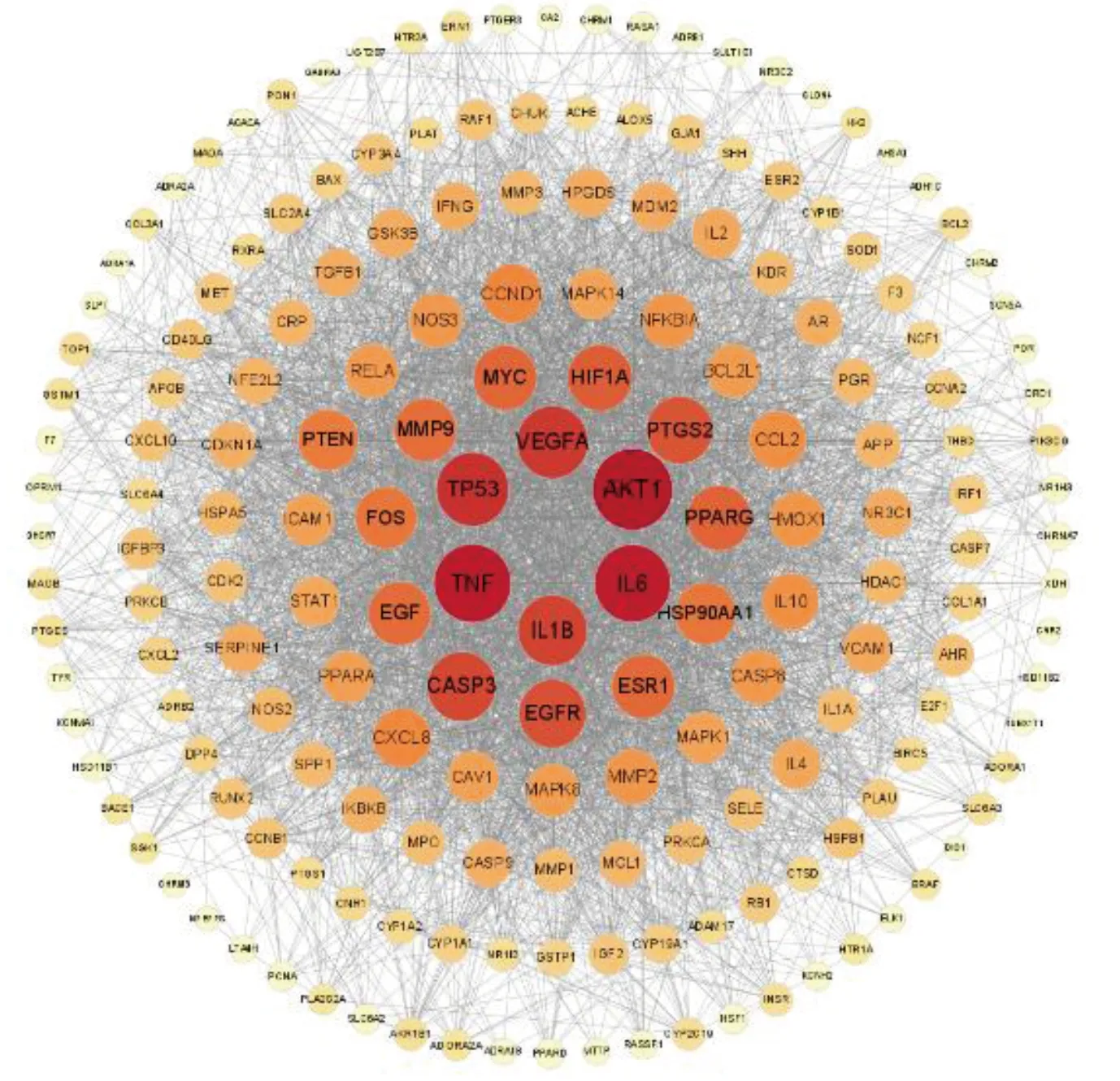
图4 PPI蛋白相互作用关系网络图
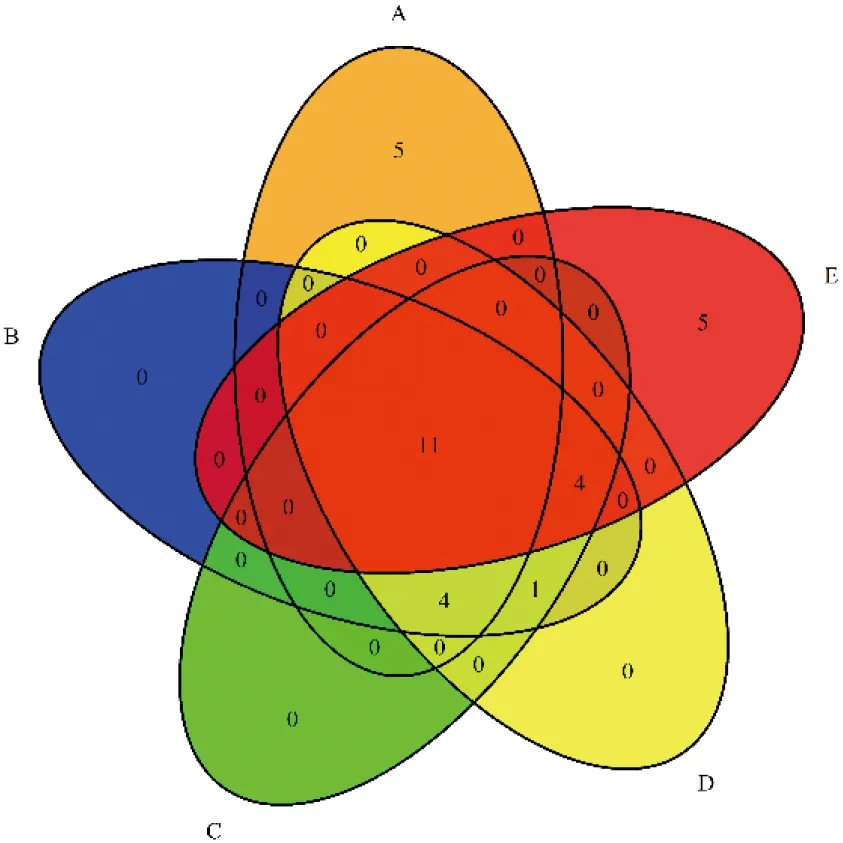
图5 交集靶点韦恩图
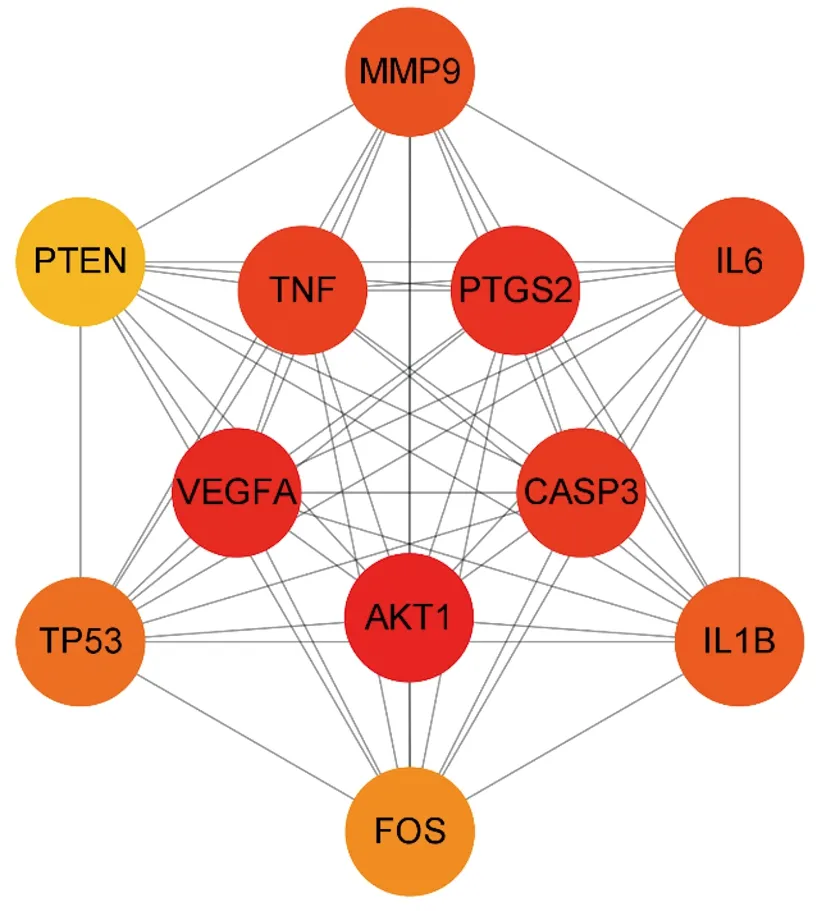
图6 11个关键靶点的PPI核心网络图

表2 Cytohubba交集靶点信息
2.5 GO富集分析和KEGG通路富集分析
GO-BP富集分析显示,蔓荆子可能通过调节脂多糖诱应答(response to lipopolysaccharide)、细菌来源的分子反应(response to molecule of bacterial origin)、异性生物质刺激的反应(response to xenobiotic stimulus)、含氧量的反应(response to oxygen levels)、金属离子(response to metal ion)、伤口愈合(wound healing)、营养水平(response to nutrient levels)、氧化应激(response to oxidative stress)、炎症反应(regulation of inflammatory response)等生物过程发挥治疗作用。详见图7。
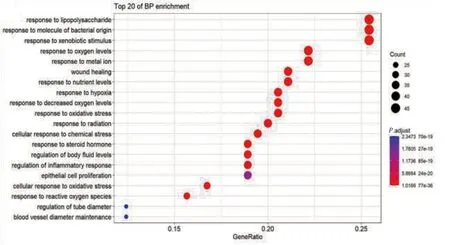
图7 GO-BP富集分析(前20项条目)
GO-MF富集分析显示,主要包括DNA结合蛋白因子(DNA-binding transcription factor binding)、RNA聚合酶Ⅱ特异性结合DNA结合蛋白因子(RNA polymerase Ⅱ-specific DNA-binding transcription factor binding)、信号受体激活剂活性(signaling receptor activator activity)、细胞因子受体结合(cytokine receptor binding)、泛素样蛋白连接酶结合(ubiquitin-like protein ligase binding)、蛋白质异源二聚化活性(protein heterodimerization activity)、细胞因子活性(cytokine activity)、核受体活性(nuclear receptor activity)等。详见图8。
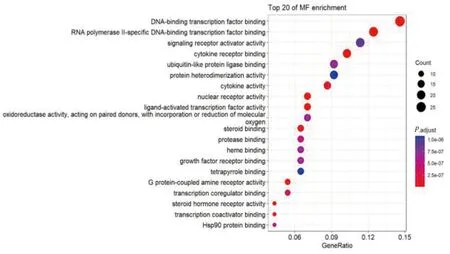
图8 GO-MF富集分析(前20项条目)
GO-CC富集分析显示,其主要参与膜筏(membrane raft)、膜微结构域(membrane microdomain)、囊泡腔(vesicle lumen)、细胞器外膜(organelle outer membrane)、外膜(outer membrane)、突触膜(synaptic membrane)、内质网腔(endoplasmic reticulum lumen)、细胞质囊泡腔(cytoplasmic vesicle lumen)、质膜筏(plasma membrane raft)等细胞组分的构成。详见图9。
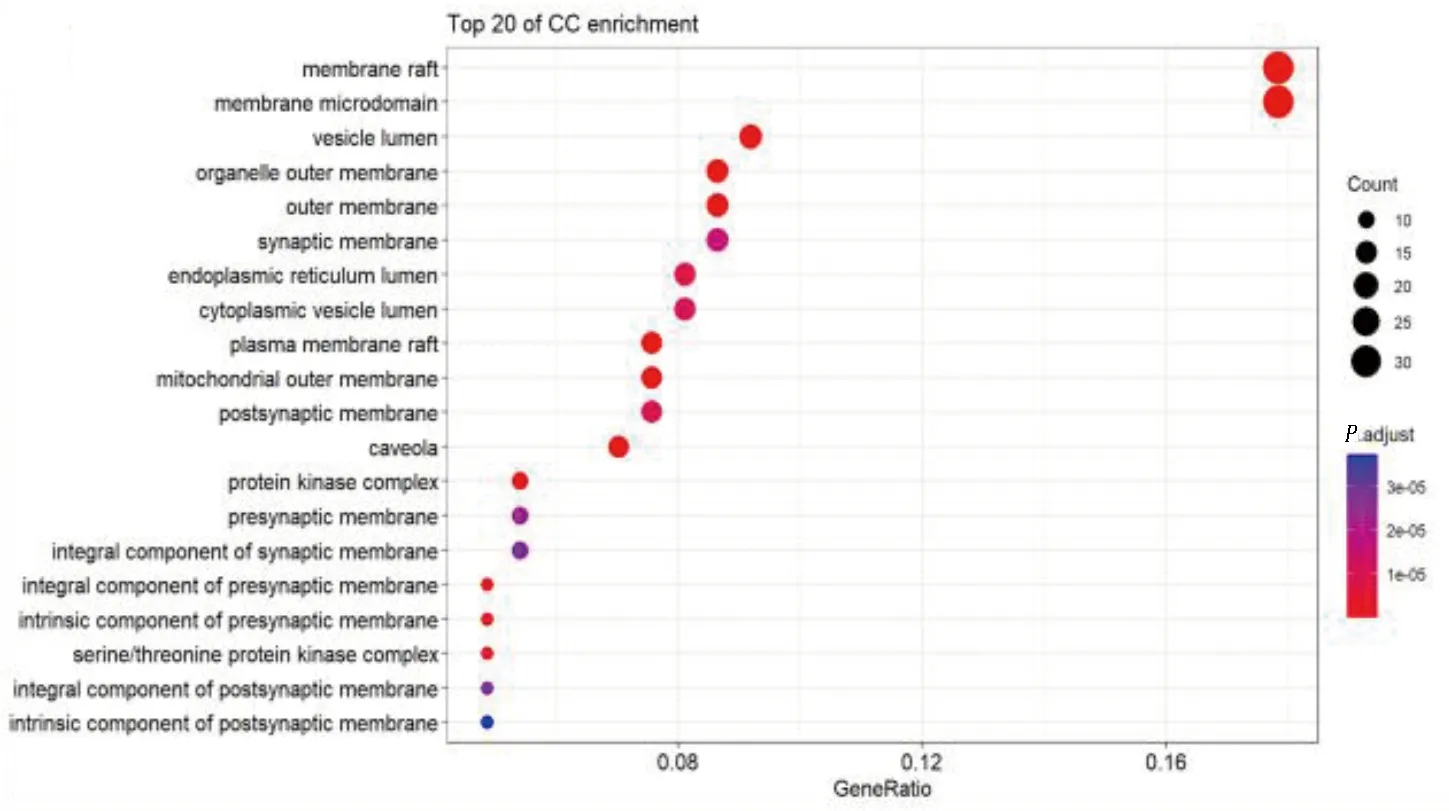
图9 GO-CC富集分析(前20项条目)
KEGG通路富集分析显示,蔓荆子可能通过参与脂质和动脉粥样硬化(lipid and atherosclerosis)、糖尿病并发症受体信号通路(AGE-RAGE signaling pathway in diabetic complications)、乙型肝炎前列腺癌(hepatitis B prostate cancer)、血流剪切应力与动脉粥样硬化(fluid shear stress and atherosclerosis)、IL-17信号通路(IL-17 signaling pathway)、TNF信号转导通路(TNF signaling pathway)等为主要调控作用途径。详见图10。
2.6 分子对接验证结果分析
一般而言,配体分子与受体蛋白间结合能愈小则表示二者结合亲和力越强,结构也越稳定。对PPI核心网络中排名前5位的靶点进行分子对接,通过对AKT1、VEGFA、PTGS2、CASP3、TNF及其相应的化合物进行分子对接,结果见表3。

表3 部分关键靶点分子对接结果
2.6.1 活性成分与AKT1相互作用
山柰酚、木犀草素、檞皮素与AKT1分子对接结果表明,3种化合物和AKT1均存在较强的结合作用,结合能力为木犀草素>檞皮素>山柰酚。潜在的结合位点主要有THR-21、LYS-14、ASN-53、ARG-23、ARG-25、ARG-15、LEU-52等氨基酸残基。3种化合物均可与氨基酸形成至少4个氢键,化合物与蛋白口袋结合能力较佳。其中木犀草素与AKT1受体的活性残基形成7个氢键,多于另外2个化合物,说明该化合物与蛋白结合口袋的结合更强。详见图11。
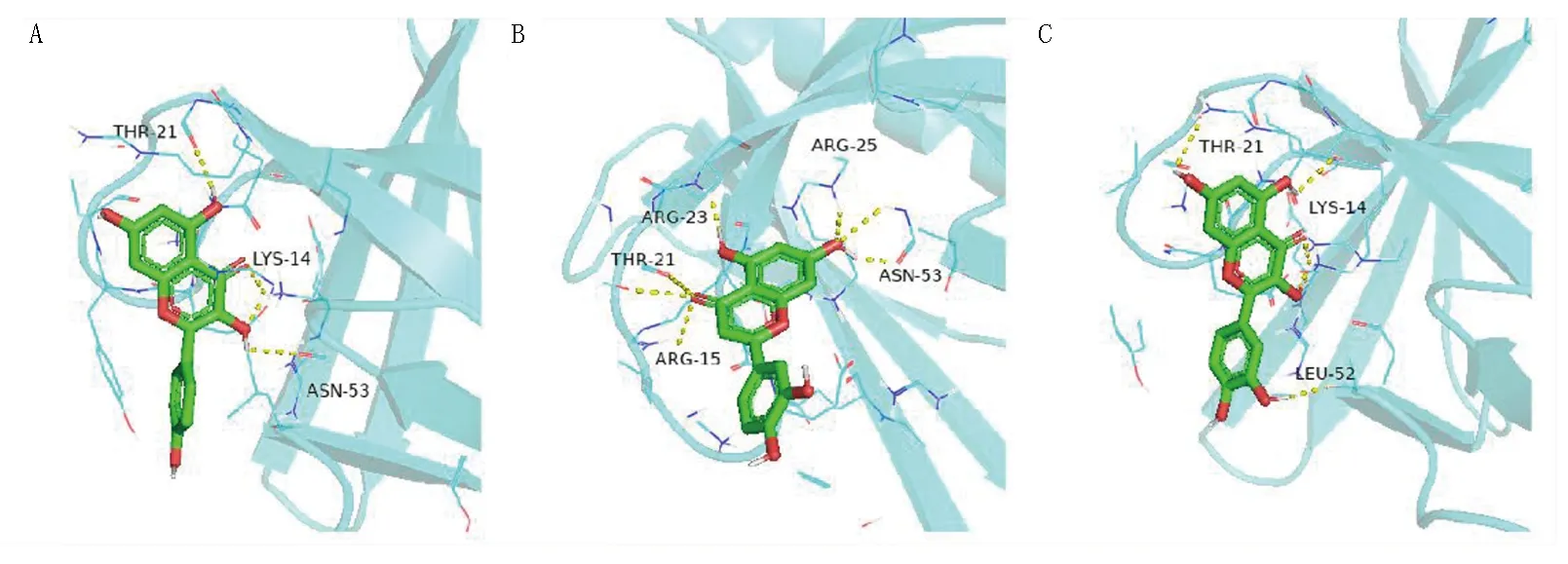
图11 山柰酚、木犀草素、檞皮素与AKT1分子对接模式图
2.6.2 活性成分与VEGFA相互作用
木犀草素、檞皮素与VEGFA分子对接结果表明,2种化合物和VEGFA均存在较好的结合作用,结合能力为檞皮素>木犀草素。潜在的结合位点主要有LYS-39、GLY-114、CYS-68、CYS-61、ASP-63、ASN-62等氨基酸残基。2种化合物均可与氨基酸形成至少2个氢键。其中檞皮素与VEGFA受体的活性残基形成7个氢键,多于木犀草素,说明该化合物与蛋白结合口袋结合较强。详见图12。
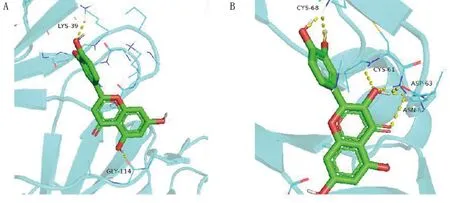
图12 木犀草素、檞皮素与AEGFA受体分子对接模式图
2.6.3 活性成分与PTGS2相互作用
将关键靶点PTGS2分别与15种蔓荆子活性成分进行对接,结合能力居前6位的化合物为玄参黄酮、山柰酚、CHEMBL1589200、木犀草素、檞皮素、紫杉叶素,与PTGS2对接结果表明,此6种化合物与PTGS2均存在较好的结合作用,结合能力为檞皮素>木犀草素>CHEMBL1589200>紫杉叶素、山柰酚>玄参黄酮。潜在的结合位点主要有HIS-39、ARG-44、TYR-130、GLU-465、GLY-135、CYS-47、CYL-36、ASP-125、ASN-43、ARG-469等氨基酸残基。其中檞皮素与PTGS2受体的活性残基形成5个氢键,多于其他活性成分,说明该化合物与蛋白结合口袋结合较强。详见图13。
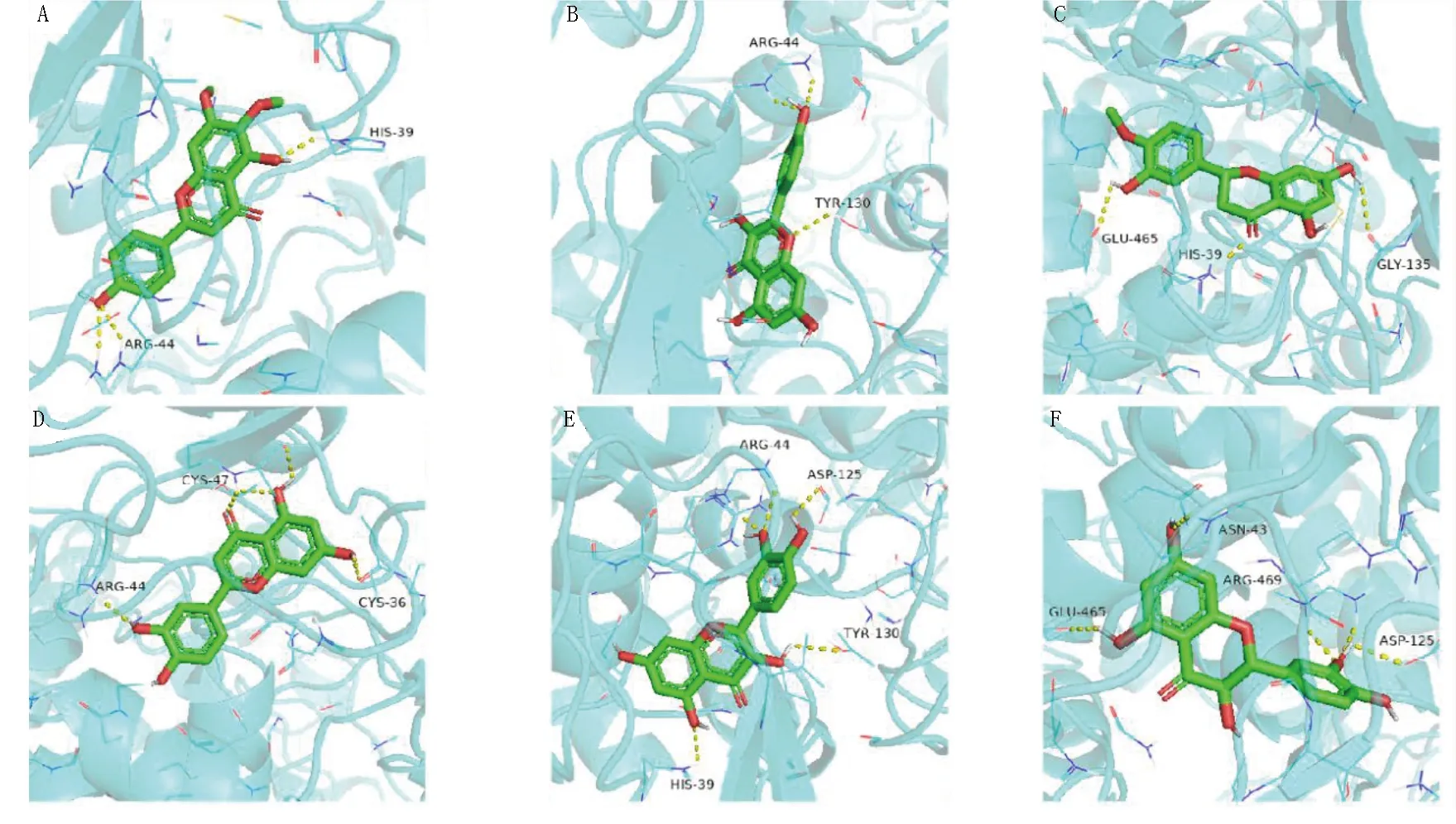
图13 活性成分与PTGS2受体分子对接模式图
2.6.4 活性成分与CASP3相互作用
山柰酚、木犀草素、檞皮素与CASP3对接结果表明,3种化合物和CASP3均存在较强的结合作用,结合能力为木犀草素>山柰酚>檞皮素。潜在的结合位点主要有GLU-124、GLY-125、ARG-164、THR-140、PHE-158、ALA-162等氨基酸残基。3种化合物均可与氨基酸形成至少3个氢键,化合物与蛋白口袋结合能力较佳。其中木犀草素与CASP3受体的活性残基形成6个氢键,多于另外2个化合物,说明该化合物与蛋白结合口袋的结合更强。详见图14。
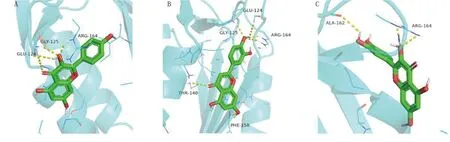
图14 山柰酚、木犀草素、檞皮素与CASP3分子对接模式图
2.6.5 活性成分与TNF相互作用
山柰酚、木犀草素、檞皮素、Vitrofolal B与TNF对接结果表明,4种化合物和TNF均存在较强的结合作用,结合能力为檞皮素>木犀草素>山柰酚>Vitrofolal B。潜在的结合位点主要有TYR-115、GLN-102、GLU-116、ALA-22、ASN-46、TRP-28、ALA-134、GLN-25、SER-133等氨基酸残基。4种化合物均可与氨基酸形成至少3个氢键,化合物与蛋白口袋结合能力较佳。其中檞皮素与TNF受体的活性残基形成6个氢键,多于另外3个化合物,说明该化合物与蛋白结合口袋的结合更强。详见图15。
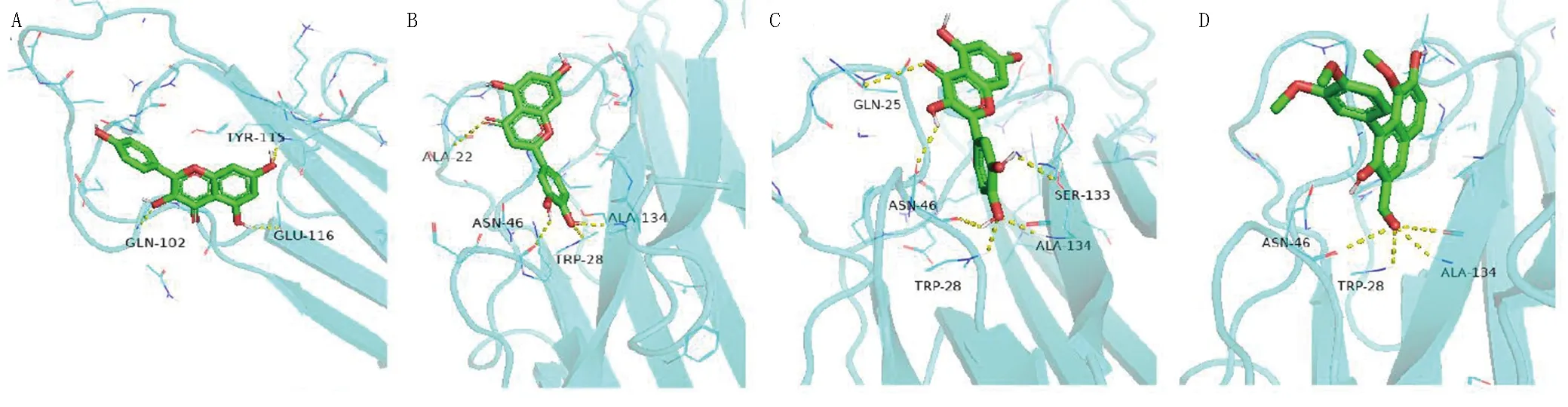
图15 活性成分与TNF分子对接模式图
3 讨 论
蔓荆子是一种被广泛应用于防治多种疾病的传统中药,包括心血管系统疾病,具有解热镇痛、抗炎、抗癌和抗氧化等作用[8]。但是蔓荆子防治AMI的作用机制尚未充分阐明,本研究利用现代生物信息学技术,探寻蔓荆子防治AMI的药效物质基础和潜在作用靶点。通过构建“药物-药物化合物-靶点”网络,发现槲皮素、木犀草素、山柰酚、豆甾醇、牡荆素C的Dgree值较大,在网络中作用明显,表明这5个成分可能是蔓荆子在防治AMI中发挥作用的主要物质基础。Li等[9]研究发现,槲皮素可抑制半乳糖凝集素-3-炎症小体(Gal-3-NLRP3)信号通路,发挥抗炎与抗氧化特性来减轻冠状动脉粥样硬化。Ding等[10]研究发现,木犀草素可通过调节信号换能器和转录激活剂来缓解炎症反应,减少巨噬细胞和脂质的积累,进而减轻冠状动脉粥样硬化。Feng等[11]研究表明,山柰酚可通过抑制炎症和细胞凋亡,使血管和脂质水平的形态正常化。胡景春等[12]研究发现,牡荆素可抑制心肌细胞缺氧/复氧(H/R)后活性氧产生,减少心肌细胞自噬体累积,对心肌细胞H/R损伤有明显的保护作用。
通过对药物与疾病交集的185个靶点进行GO和KEGG富集分析。GO富集分析结果显示,蔓荆子可能通过参与调控脂多糖诱应答、细菌来源的分子反应、异性生物质刺激的反应、金属离子、伤口愈合、营养水平、氧化应激、炎症反应等生物过程发挥治疗作用。此外,可通过干预DNA结合蛋白因子、RNA聚合酶Ⅱ特异性结合DNA结合蛋白因子、信号受体激活剂活性、细胞因子受体结合、泛素样蛋白连接酶结合、蛋白质异源二聚化活性、细胞因子活性、核受体活性等最终影响靶基因的表达。KEGG通路富集分析显示,蔓荆子可能通过参与脂质和动脉粥样硬化、糖尿病并发症受体信号通路、血流剪切应力与动脉粥样硬化、IL-17信号通路、TNF信号转导通路等为主要调控作用途径。通过GO和KEGG富集分析可知,蔓荆子可通过影响靶基因的表达,实现减轻内皮细胞损伤、氧化应激损伤、动脉粥样硬化及脂质沉积等带来的不利影响。表明蔓荆子是通过多靶点、多通路共同发挥抗血管内斑块形成的作用,从而发挥防治AMI的作用。
对185个交集靶点进行PPI分析,并利用插件CytoHubba进一步筛选,结果显示,AKT1、VEGFA、PTGS2、CASP3、TNF、IL-6、MMP9、IL1B、TP53、FOS、PTEN在该网络中起到关键作用。AKT激酶是AGC蛋白激酶组的成员,在细胞增殖、迁移、生长和代谢等功能方面扮演着重要的角色[13]。血管内皮生长因子(VEGF)是一种同源二聚体血管活性糖蛋白,是血管通透性和血管生成的主要调节因子。近年来,治疗性血管生成已被提出作为治疗AMI的新策略,VEGFA表达水平与梗死区微血管密度增加呈正相关,提示VEGFA在心肌重塑和血管生成中起着重要的作用[14]。CASP3的抑制剂是细胞凋亡的主要执行剂[15],通过慢病毒转染大鼠可下调CASP3的表达进一步缩小心肌组织的梗死面积和降低心肌细胞的凋亡指数[16]。Zhou等[17]研究发现,动脉粥样硬化的严重程度与PTGS2的表达呈正相关,且PTGS2可能是动脉粥样硬化的中心基因。TNF是参与细胞衰老的主要炎症信号分子之一,研究发现,奥格列汀可以抑制TNF-α诱导的促炎细胞因子白细胞介素(IL)-1β、IL-6和IL-8的表达,并通过减少氢的产生来抑制氧化应激,以预防大鼠主动脉血管平滑肌细胞的衰老[18]。MMP9是血管生成的关键调节因子[19],主要由成纤维细胞、炎性细胞和肌细胞产生,其表达和活性的变化与心肌梗死后左心室重塑密切相关[20]。
分子对接结果表明,蔓荆子部分关键化合物与相应靶蛋白均存在较佳的结合作用。其中核心靶点AKT1与化合物木犀草素结合亲和能力最强;VEGFA与檞皮素结合亲和能力最强;PTGS2与檞皮素结合亲和能力最强;CASP3与木樨草素结合能最强;TNF与檞皮素结合亲和能力最强。化合物均存在较多的氢键受体供体,这有助于与靶蛋白形成较为稳定的氢键使小分子化合物配体能够稳定地结合在相应蛋白的活性位点。此外,化合物配体与蛋白活性残基还存在疏水相互作用和范德华力以及形成共轭结构。这些作用力可以有效地使小分子固定在活性中心,从而提高化合物在蛋白活性口袋的稳定性。
本研究结果表明,蔓荆子防治AMI具有多成分、多靶点、多通路、多环节的调控特点,可能通过抗炎、免疫调节、脂代谢、调节细胞凋亡及细胞自噬等过程发挥防治作用。

