蓝萼甲素对缺氧/复氧诱导的H9c2细胞损伤模型HMGB1/TLR4/NF-κB信号通路的影响
杜 玥,李 莎,梅齐建,肖 鸣
心肌缺血/再灌注(myocardial ischemic/reperfusion,MI/R)损伤的诱因主要是心肌梗死、心肌缺血等,其发生机制十分复杂,是临床治疗的难题[1]。细胞凋亡、炎症反应和氧化应激是MI/R损伤的重要原因。研究表明,高迁移率族蛋白B1(high mobility group box 1,HMGB1)/Toll样受体4(Toll like receptor 4,TLR4)/核因子κB(nuclear factor κB,NF-κB)信号通路与MI/R损伤的发生联系密切[2]。HMGB1在几乎所有细胞类型中都有表达,抑制HMGB1表达可使其受体TLR4表达下降,导致下游NF-κB转录活性降低,从而起到减轻细胞损伤和炎症反应的效果[3]。蓝萼甲素(glaucocalyxin A,GLA)提取自蓝萼香茶菜,是一种具有广泛生物活性的二萜类化合物。GLA已被证实在氧化应激、免疫、抗炎等方面起作用[4]。同时,在乳腺癌中,GLA不仅能通过激活p53蛋白表达抑制细胞增殖和细胞周期进程[5],还能通过抑制磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)信号通路促进细胞凋亡[6];另外,GLA可通过下调糖原合成酶激酶-3β(GSK3β)/β-catenin信号通路相关蛋白表达从而明显抑制肺成纤维细胞转化[7]。研究发现,GLA通过抑制HMGB1/TLR4/NF-κB信号通路不仅能减轻卵清蛋白诱导的哮喘小鼠呼吸道炎症[8],也能调节人滋养细胞的炎症反应[9],还能减轻肥大细胞脱颗粒导致的过敏反应[10]。然而,GLA是否通过调节HMGB1/TLR4/NF-κB信号通路影响心肌细胞损伤还未可知。因此,本研究将通过构建H9c2细胞缺氧/复氧(H/R)损伤模型,观察GLA对H/R诱导的H9c2细胞损伤的影响,并探讨GLA是否通过HMGB1/TLR4/NF-κB信号通路干预H/R诱导的H9c2细胞损伤。
1 材料与方法
1.1 细胞与主要试剂、仪器
H9c2细胞购自中国科学院上海细胞库;GLA购自上海源叶生物科技有限公司;HMGB1/TLR4/NF-κB信号通路抑制剂甘草酸(glycyrrhizin)购自上海蓝木化工有限公司;胎牛血清(fetal bovine serum,FBS)、DMEM培养基购自南京森贝伽生物科技有限公司;细胞计数试剂盒(CCK-8)、细胞凋亡检测试剂盒购自美国Amresco公司;兔抗HMGB1、TLR4、NF-κB p65抗体(anti-HMGB1、anti-TLR4、anti-NF-κB p65、anti-p-NF-κB p65)及辣根过氧化物酶标记的二抗购自美国Thermo Fisher公司;乳酸脱氢酶(LDH)、超氧化物歧化酶(SOD)、丙二醛(MDA)及酶联免疫吸附试验(ELISA)检测试剂盒均购自上海酶联生物科技有限公司。酶标仪、流式细胞仪购自美国Bio-Rad公司;三气培养箱、恒温CO2培养箱购自德国Eppendorf公司;倒置荧光显微镜购自基恩士(中国)有限公司。
1.2 细胞培养与模型构建
对冷冻保存的H9c2细胞进行复苏,将其置于含10% FBS的DMEM培养基中,在恒温(37 ℃)CO2培养箱中培养。将对数生长期的H9c2细胞先在三气培养箱缺氧环境中(1%O2、94%N2、5%CO2)培养24 h,然后移至恒温CO2培养箱继续复氧2 h,模型构建完成。
1.3 细胞分组
将对数生长期的H9c2细胞分成对照组(正常培养)、模型组(构建H/R细胞模型)、GLA-L组(细胞中加入5 μmol/L的GLA后构建H/R细胞模型)、GLA-M组(细胞中加入10 μmol/L的GLA后构建H/R细胞模型)、GLA-H组(细胞中加入20 μmol/L的GLA构建H/R细胞模型)、GLA-H+甘草素组(细胞中加入20 μmol/L的GLA和100 μg/mL的甘草素[11]后构建H/R细胞模型)。
1.4 CCK-8实验检测细胞存活率
将各组H9c2细胞接种在96孔细胞板上,分别滴入10 μL的CCK-8溶液,2 h后使用酶标仪测定各组细胞在450 nm处的光密度值,评估细胞的存活率。
1.5 流式细胞术检测细胞凋亡情况
分别在对数生长期的各组H9c2细胞中依次加入10 μL的V-异硫氰酸荧光素(AnnexinV-FITC)和碘化丙啶(propidium iodide,PI),避光反应30 min,上流式细胞仪检测各组H9c2细胞凋亡情况。
1.6 细胞中ROS、LDH、抗氧化酶及炎性因子水平测定
收集经过处理的各组H9c2细胞,使用磷酸盐缓冲液进行清洗,然后在37 ℃下,使用10 μmol/L的2′-7′-二氯荧光黄双乙酸盐(DCFH-DA)避光处理30 min。接着,使用流式细胞仪分析各组H9c2细胞的相对荧光强度,反映ROS水平。按照LDH、SOD、MDA检测试剂盒的方法对各组细胞上清液进行LDH活性及SOD、MDA含量测定。利用ELISA方法检测炎性因子肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)水平。
1.7 实时荧光定量聚合酶链式反应(qRT-PCR)检测HMGB1、TLR4、NF-κB p65 mRNA表达
利用TRIzol试剂提取各组H9c2细胞总RNA,并逆转录成cDNA,按照qRT-PCR仪器的说明书进行程序设定和聚合酶链式反应(PCR)扩增。采用2-ΔΔCt方法计算HMGB1、TLR4、NF-κB p65 mRNA表达水平,甘油醛-3-磷酸脱氢酶(GAPDH)作为内参基因。HMGB1、TLR4、NF-κB p65引物序列见表1。

表1 HMGB1、TLR4、NF-κB p65、GAPDH引物序列
1.8 蛋白质免疫印迹法(Western Blot)检测HMGB1、TLR4、NF-κB p65蛋白表达
提取各组H2c9细胞总蛋白并使用二喹啉甲酸(BCA)试剂盒测定蛋白浓度,然后进行凝胶电泳,转膜,脱脂奶粉封闭处理后,加入anti-HMGB1、anti-TLR4、anti-NF-κB p65和anti-p-NF-κB p65一抗,次日加入辣根过氧化物酶标记的二抗,继续孵育1 h,使用增强型化学发光试剂(ECL)试剂进行显影,并分析其蛋白表达水平。
1.9 统计学处理
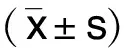
2 结 果
2.1 各组H9c2细胞存活率比较
与对照组比较,模型组H9c2细胞存活率明显降低(P<0.05);GLA-L组、GLA-M组和GLA-H组H9c2细胞存活率均明显高于模型组,呈剂量依赖性(P<0.05);而与GLA-H组比较,GLA-H+甘草素组H9c2细胞存活率明显升高(P<0.05)。详见表2。
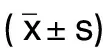
表2 各组H9c2细胞存活率比较 单位:%
2.2 各组H9c2细胞凋亡率比较
模型组H9c2细胞凋亡率明显高于对照组(P<0.05);与模型组相比,GLA-L组、GLA-M组和GLA-H组H9c2细胞凋亡率依次降低(P<0.05);而与GLA-H组比较,GLA-H+甘草素组H9c2细胞凋亡率明显降低(P<0.05)。详见图1、表3。

图1 流式细胞仪检测各组H9c2细胞凋亡情况
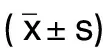
表3 各组H9c2细胞凋亡率比较 单位:%
2.3 各组H9c2细胞毒性和抗氧化酶比较
与对照组相比,模型组H9c2细胞中LDH活性和MDA含量明显上升,ROS相对荧光强度明显增强,SOD含量明显降低,差异均有统计学意义(P<0.05);与模型组比较,GLA-L组、GLA-M组和GLA-H组H9c2细胞中LDH活性和MDA含量明显下降,ROS相对荧光强度明显减弱,SOD含量明显升高,均呈现剂量依赖性,差异均有统计学意义(P<0.05);而与GLA-H组比较,GLA-H+甘草素组H9c2细胞中LDH活性和MDA含量明显降低,ROS相对荧光强度明显减弱,SOD含量明显上升,差异均有统计学意义(P<0.05)。详见表4。

表4 各组H9c2细胞毒性和抗氧化酶比较
2.4 各组H9c2细胞炎性因子表达比较
与对照组比较,模型组H9c2细胞中TNF-α、IL-6含量明显增加(P<0.05);与模型组比较,GLA-L组、GLA-M组和GLA-H组H9c2细胞中TNF-α、IL-6含量明显降低,且均表现为GLA-L组>GLA-M组>GLA-H组,差异均有统计学意义(P<0.05);而GLA-H+甘草素组H9c2细胞中TNF-α、IL-6含量明显低于GLA-H组(P<0.05)。详见表5。
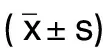
表5 各组H9c2细胞炎性因子表达比较 单位:ng/L
2.5 各组H9c2细胞HMGB1、TLR4、NF-κB p65 mRNA水平比较
模型组H9c2细胞中HMGB1、TLR4、NF-κB p65 mRNA水平明显高于对照组(P<0.05);与模型组相比,GLA-L组、GLA-M组和GLA-H组H9c2细胞中HMGB1、TLR4、NF-κB p65 mRNA水平依次降低(P<0.05);而GLA-H+甘草素组H9c2细胞中HMGB1、TLR4、NF-κB p65 mRNA水平明显低于GLA-H组(P<0.05)。详见表6。
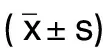
表6 各组H9c2细胞HMGB1、TLR4、NF-κB p65 mRNA水平比较
2.6 各组H9c2细胞HMGB1、TLR4、NF-κB p65蛋白表达比较
与对照组比较,模型组H9c2细胞中HMGB1、TLR4蛋白表达水平与磷酸化NF-κB p65(p-NF-κB p65)/NF-κB p65值明显升高(P<0.05);与模型组相比,GLA-L组、GLA-M组和GLA-H组H9c2细胞中HMGB1、TLR4蛋白表达水平与p-NF-κB p65/NF-κB p65值呈剂量依赖性降低(P<0.05);而GLA-H+甘草素组H9c2细胞中HMGB1、TLR4蛋白表达水平与p-NF-κB p65/NF-κB p65值明显低于GLA-H组(P<0.05)。详见图2、表7。

图2 各组H9c2细胞中HMGB1、TLR4、NF-κB p65、p-NF-κB p65蛋白表达条带图
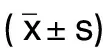
表7 各组H9c2细胞HMGB1、TLR4、NF-κB p65蛋白表达比较
3 讨 论
MI/R损伤是伴随心脏疾病介入治疗、搭桥手术出现的一种机体损伤[12]。研究发现,从传统中药里提取的活性物质可对MI/R损伤产生保护作用,如黄芪甲苷[13]、原花青素[14]、黄连素[15]等均可抑制H/R诱导的H9c2心肌细胞损伤。GLA是蓝萼香菜的主要活性成分,其已被证实能够激活AKT/Nrf2/血红素加氧酶-1 (HO-1)通路抑制细胞凋亡、增强细胞活力,从而使H9c2细胞免受H/R诱导的损伤[16]。本研究通过H9c2细胞H/R损伤模型构建研究GLA对H/R诱导的H9c2心肌细胞损伤的作用。LDH、MDA、ROS和SOD是检测细胞氧化应激损伤的标志物。细胞在受外界刺激发生损伤时,炎性因子(TNF-α、IL-6)水平会明显增加。本研究结果显示,模型组H9c2细胞存活率降低,细胞凋亡率升高,抗氧化酶MDA和ROS水平上升,SOD含量降低,炎性因子TNF-α、IL-6含量增加,揭示H/R诱导可使H9c2细胞活性和氧化应激能力降低,并促进细胞凋亡和炎症反应。而模型组H9c2细胞中LDH活性明显提高,说明H9c2细胞H/R损伤模型构建成功。在H9c2细胞H/R损伤模型细胞中分别加入低、中、高剂量的GLA后,细胞存活率明显升高,凋亡率明显降低,LDH活性、ROS水平和MDA含量明显下降,SOD含量明显升高,TNF-α、IL-6含量明显下降,均呈剂量依赖性。表明GLA能修复H/R诱导的H9c2细胞损伤,增强细胞活性并抑制凋亡。
研究显示,H/R诱导的H9c2心肌细胞损伤与HMGB1/TLR4/NF-κB通路关系密切[17]。在MI/R等细胞损伤情况下,产生炎症的重要介质是HMGB1。而HMGB1可与多种受体结合进而参与心肌细胞的增殖、凋亡以及炎症反应过程[18]。TLR4是HMGB1的关键受体之一,两者相互作用能够促进炎症反应的发生。同时,激活TLR4后,下游NF-κB转录因子上调表达,促使细胞中产生更多的炎性因子,进而加重细胞损伤程度[19]。Zhang等[20]研究发现,miR-708可靶向下调HMGB1的表达抑制TLR4/NF-κB通路的激活,进而降低凋亡和炎症反应并保护H/R诱导的心肌细胞损伤。然而,在H/R诱导的H9c2细胞损伤中,GLA与HMGB1/TLR4/NF-κB信号通路的关系及其作用机制尚未明确。本研究结果显示,模型组H9c2细胞中HMGB1、TLR4表达与NF-κB p65磷酸化水平均明显升高;GLA-L组、GLA-M组和GLA-H组H9c2细胞中HMGB1、TLR4表达与NF-κB p65磷酸化水平依次降低,揭示GLA能逆转H9c2细胞H/R损伤模型中HMGB1、TLR4、p-NF-κB p65的高表达。此外,甘草素是HMGB1的抑制剂,能够通过抑制HMGB、TLR4、NF-κB表达从而减轻放射性肺损伤。本研究进一步发现,抑制HMGB1表达后,GLA-H+甘草素组H9c2细胞HMGB1、TLR4表达与p-NF-κB p65水平降低;同时,细胞存活率升高、凋亡率降低,LDH活性、ROS水平和MDA含量明显下降,SOD含量明显升高,TNF-α、IL-6含量明显减少,提示GLA和HMGB1/TLR4/NF-κB通路抑制剂甘草素可能存在协同作用,对保护H9c2细胞的作用更佳。说明GLA可能通过抑制HMGB1/TLR4/NF-κB信号通路增加细胞活性、抑制细胞凋亡,对H/R诱导的H9c2细胞损伤产生保护作用。
综上所述,GLA可能通过阻滞HMGB1/TLR4/NF-κB信号通路,降低细胞凋亡率,减少炎性因子表达,进而保护H9c2细胞免受H/R诱导的损伤。

