高效液相色谱法测定饲料中泰万菌素含量
马瑛洁,王淑婷,周兰兰,牛蓉,孙志文
(1.河南宏信检测技术有限公司农产食品检测中心,河南南阳 473000; 2.牧原食品股份有限公司品控部,河南南阳 473000; 3.北京市农产品质量安全中心,北京 102629)
乙酰异戊酰泰乐菌素(泰万菌素)属于第3 代大环内酯类动物专用抗生素,是泰乐菌素经化学改造而生成的一种衍生物[1],在泰乐菌素的羟基位置乙酰基化和4-羟基位置异戊酰基化而得, 由英国伊科动物保健品有限公司开发,其药效是红霉素、泰乐菌素的5~10 倍,是替米考星、阿奇霉素的2~5 倍[2-5]。 目前制剂常使用的是酒石酸盐。 泰万菌素对比泰乐菌素等大环内酯类药物而言,对猪痢疾、猪气喘病、猪增生性肠炎和鸡支原体感染等疾病具有很好的防治效果[6-9]。 泰万菌素也具有高效、低毒、低残留、与其他大环内酯类抗生素不存在交叉耐药现象及对畜禽支原体病有治疗作用等优点,是一种优良的大环内酯类抗生素和饲料添加剂[10-14]。
由于目前抗生素在养殖企业常存在超剂量使用、不该用时乱用或者无规律服用抗生素等抗生素滥用现象, 导致抗生素耐药性以及环境污染问题日益严重,致使人们越来越重视抗生素的使用问题[15-16]。2019年7 月,中华人民共和国农业农村部发布194 号公告要求饲料生产企业停止生产含有促生长类药物饲料添加剂(中药类除外)的商品饲料。该公告自2020 年7月1 日起开始执行[17-19]。政府加强对饲料加药的管控,减抗、禁抗已是大势所趋。 这就需要我们尽快建立饲料中的抗生素质量检测标准,为企业、政府的管控提供检测方法。
目前, 泰万菌素制剂产品在 《兽药质量标准》2017 年版中使用的检测方法是抗生素微生物鉴定法,但该方法存在前处理复杂、灵敏度低、准确度低及检测种类受限等缺点,且饲料中泰万菌素的检测方法仍是空白[20-21]。 本文研究了用高效液相色谱法测定饲料中泰万菌素含量的方法,参考兽药典中对泰万菌素组分的检查方法,以泰万菌素组分A 外标法定量。 该方法重复性好,灵敏度高,检测速度快,可以为饲料中泰万菌素含量的检测提供理论依据。
1 材料与方法
1.1 材料与试剂
泰万菌素标准品(中国兽医药品监察所购置批号,K0692108,含量80.0%,CAS 号:63409-12-1,分子式:C53H87NO19);甲醇、乙腈(美国天地有限公司;4 L);醋酸铵(分析纯;国药集团化学技术有限公司);醋酸(色谱纯;国药集团化学技术有限公司);C18 色谱柱(安捷伦);试验用水为超纯水;0.22 μm 微孔滤膜:通用型。
1.2 仪器与设备
高效液相色谱仪配紫外检测器(Alliance E2695-2489), 美国Waters 公司; 电子天平(MS105DU),Mettler-Toledo;离心机(DD5000),四川蜀科仪器有限公司;多管混匀仪(MVM-200),南京祥中生物科技有限公司;超声波清洗器(UC-4480),深圳市朗杰超声电器有限公司。
1.3 泰万菌素标准储备液(1 000 μg/mL)
取泰万菌素对照品适量(相当于泰万菌素10 mg)于10 mL 容量瓶中,精密测定。 用乙腈溶解并稀释成浓度为1 000 μg/mL 的溶液,作为标准储备液。 置于-20 ℃冰箱中避光保存,有效期为12 个月。
1.4 泰万菌素标准中间液(100 μg/mL)
精密量取标准储备液1.00 mL 于10 mL 容量瓶中,用70%甲醇水稀释并定容,混匀。置于4 ℃冰箱中避光保存,有效期为3 个月。
1.5 标准曲线的制备
准确移取适量泰万菌素标准中间液, 用0.15 mol/L醋酸铵溶液∶乙腈∶醋酸(45∶45∶10,V∶V∶V)稀释定容,配制标准系列溶液, 浓度为1、5、10、20、50 及100 μg/mL,上机前过滤,待测。
1.6 试验方法
1.6.1 样品制备。 取无药物添加的猪用配合饲料样品500 g 左右, 粉碎至可通过1 mm 孔径筛后, 充分混匀,存储于广口瓶内密封备用。
1.6.2 样品提取。 称取试样约5 g(精确至0.01 g)于50 mL 容量瓶内中, 加0.15 mol/L 醋酸铵溶液∶乙腈∶醋酸(45∶45∶10,V∶V∶V)20 mL,多管混匀仪2 500 r/min混合1 min,超声提取15 min,4 000 r/min 离心5 min,取上清液过0.22 μm 微孔滤膜后作为试样溶液,供上机使用。
1.6.3 色谱条件。色谱柱:250 mm×4.6 mm,5-Micron,十八烷基硅烷键合硅胶为填充剂。流速:1.2 mL/min。 检测波长:280 nm。进样量:10 μL。流动相:0.15 mol/L。醋酸铵溶液∶乙腈∶醋酸(45∶45∶10,V∶V∶V)。
2 结果与分析
2.1 前处理条件的优化
2.1.1 样品提取溶剂选择。 泰万菌素分子式是C53H87H9·x(C4H6O6),分子量1 192.343 7,易溶于甲醇,可溶于水、丙酮或氯仿,微溶于乙酸乙酯和乙醚,几乎不溶于乙烷。2017 版《兽药质量标准》中对泰万菌素相关制剂检查组分时选择的稀释溶液是流动相0.15 M 醋酸铵溶液∶乙腈∶醋酸(45∶45∶10,V∶V∶V)。本研究选取超纯水、70%甲醇、 醋酸铵-醋酸-乙腈溶液3 种提取液,取空白饲料样品5 g,加标至100 mg/kg,分别加入以上3 种不同提取液20 mL,振荡混匀1 min,超声提取20 min,4 000 r/min 离心5 min,每种提取液重复试验3 次, 取上清液过0.22 μm 微孔滤膜后上机。 结果显示,当提取液为0.15 M 醋酸铵溶液∶乙腈∶醋酸(45∶45∶10,V∶V∶V)时,平均回收率最高,为112.9%(表1),最终选取醋酸铵-醋酸-乙腈溶液为提取溶液。

表1 不同提取溶剂对泰万菌素提取率的影响
2.1.2 样品提取方式、提取时间选择。 使用同一份制备好的样品,称取5 g,分别使用振荡提取法和超声提取法2 种提取方式,每种提取方式提取时间分别为5、10、20 及30 min,4 000 r/min 离心5 min, 每种提取液重复试验3 次,取上清液过0.22 μm 微孔滤膜后上机。 结果显示,振荡和超声2 种方式对泰万菌素的提取无明显影响,当提取时间超过10 min 后,回收率有所下降(表2)。为保证提取效果,本文选择提取方式为超声提取,提取时间为10 min。
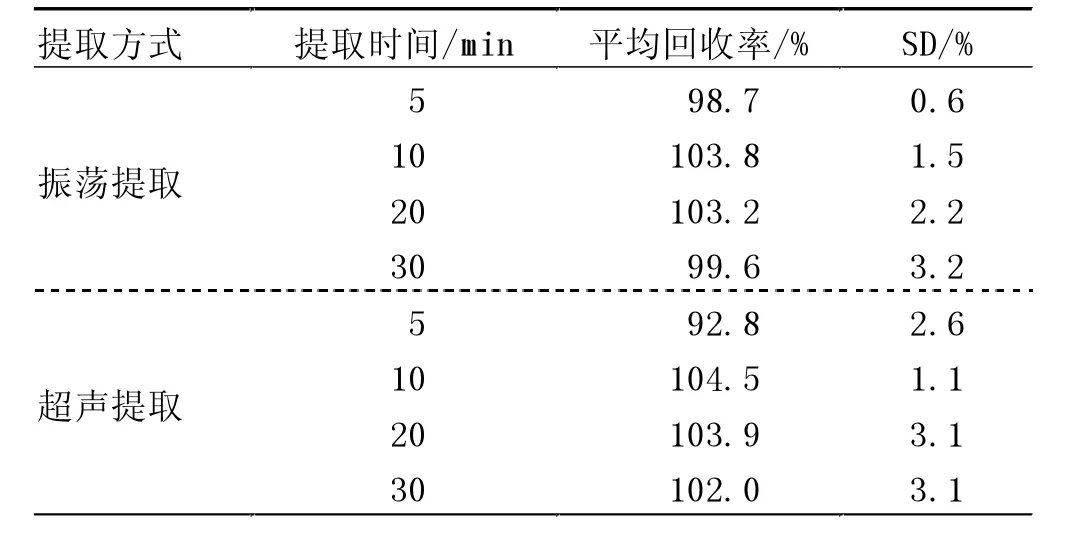
表2 提取方式、提取时间对泰万菌素提取率的影响
2.1.3 提取温度、提取次数选择。 本方法考查了不同提取温度(25、40 及60 ℃),使用醋酸铵-醋酸-乙腈溶液为提取液,加入20 mL 提取1 次、每次加入10 mL提取2 次、每次分别加入7、7 和6 mL 提取3 次,确定提取次数对提取效果的影响,每组重复3 次。 结果显示,提取温度为25 ℃、提取1 次,即可达到提取效果(表3)。 随着提取温度的升高,回收率逐渐降低,且回收率不会随着提取次数的增加而升高。 综合提取效率和时间成本,最终选择提取温度为25 ℃,提取次数为1 次(20 mL)。

表3 提取温度、提取次数对泰万菌素提取率的影响
2.2 色谱条件选择
2.2.1 柱温及流速的选择。 本方法考查了不同柱温(25、35 和45 ℃),不同流速(1.0、1.2 和2.0 mL/min)对泰万菌素的分离情况、保留时间和峰型的影响。 结果显示,柱温升高泰万菌素保留时间逐渐缩短,但无明显变化;流速增大时泰万菌素峰形逐渐变窄,但同时仪器系统压力逐渐增高,综合考虑最终选择色谱柱柱温为25 ℃、流速为1.2 mL/min,在该条件下泰万菌素的保留时间为10.9 min(图1)。
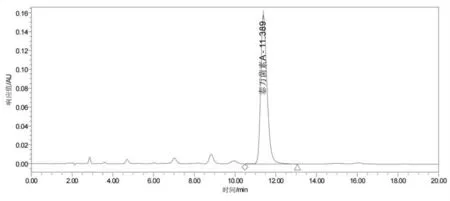
图1 泰万菌素标准溶液色谱图(280 nm)
2.2.2 检测波长的选择。2017 年版《兽药质量标准》中泰万菌素检测波长是280 nm, 为验证该波长是否为最佳检测波长,本研究配制了100 μg/mL 泰万菌素标准溶液,测试其在260~300 nm 的响应值,发现泰万菌素在280 nm 处响应最大(图2),因此确定280 nm 为最佳检测波长。
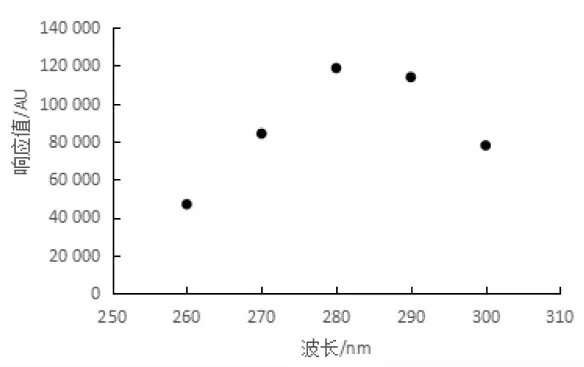
图2 泰万菌素标准溶液50 μg/mL 在不同波长下的响应值
2.3 方法学考查
2.3.1 方法的线性范围。 配制的1、5、10、20、50 和100 μg/mL 系列标准溶液,在上述色谱条件下,从低浓度到高浓度分别进样,重复进样2 针,按其所得峰面积的平均值与对应的标准溶液浓度作标准曲线,同时计算标准曲线的回归方程和相关系数。 结果表明,泰万菌素标准溶液浓度为1~100 μg/mL 时呈良好线性关系,其回归方程为y=7 917.8x-478.68,相关系数R2=0.999 9(图3)。
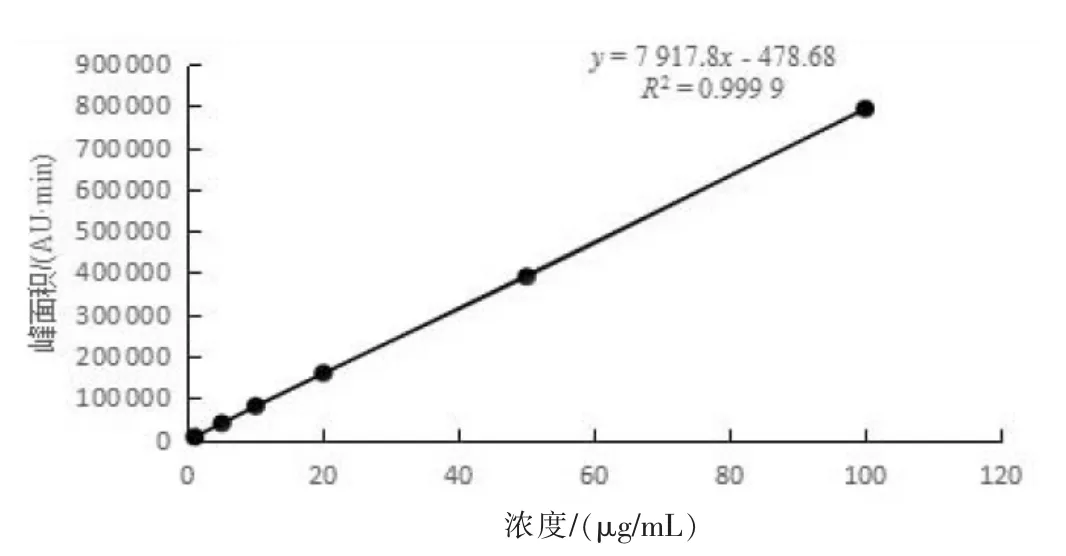
图3 泰万菌素标准曲线图
2.3.2 方法的稳定性。 将同一饲料样品提取液混合均匀后分成两份分别于室温和4 ℃密闭冷藏放置24、48 和72 h,每种方案做3 个平行,取以上时间点的提取液,试验泰万菌素色谱峰面积及RSD 均没有明显变化(表4),说明该方法的稳定性良好。
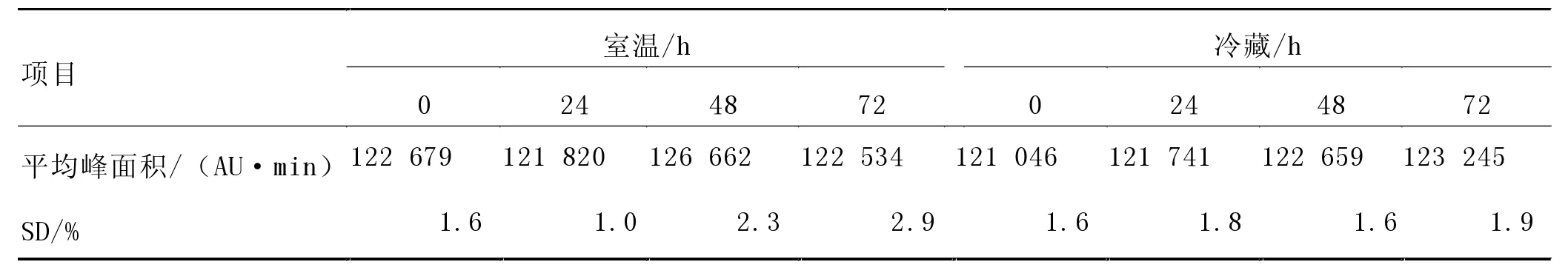
表4 稳定性测定结果(n=3)
2.3.3 方法的检出限和定量限。 根据2017 年版《兽药质量标准》规定的允许用量折算泰万菌素制剂在饲料汇总的最低允许用量,其中酒石酸泰万菌素预混剂最低允许用量为50 mg/kg。选择无药物添加的猪混合饲料为基质进行加标,加标范围为0.05~50 mg/kg,在上述色谱条件下每个样品重复进样2 次,按3 倍信噪比(S/N=3)和10 倍信噪比(S/N=10)确定方法的检出限(LOD)和定量限(LOQ)。结果显示,泰万菌素检出限为2 mg/kg,定量限为4 mg/kg。
2.3.4 方法的精密度及回收率。 利用本研究建立的方法,对空白饲料进行加标试验,5 g 空白饲料中分别添加不同浓度的泰万菌素标准溶液,使加标水平为4、10、20、50 和100 mg/kg,每个加标水平做6 个平行样品,进行回收率测定试验。 结果显示,平均回收率为94.6%~101.3%,相对标准偏差(RSD)为1.3%~6.0%(表5)。结果表明,该方法的准确性和精密度均较为理想,满足饲料中泰万菌素定量分析要求。
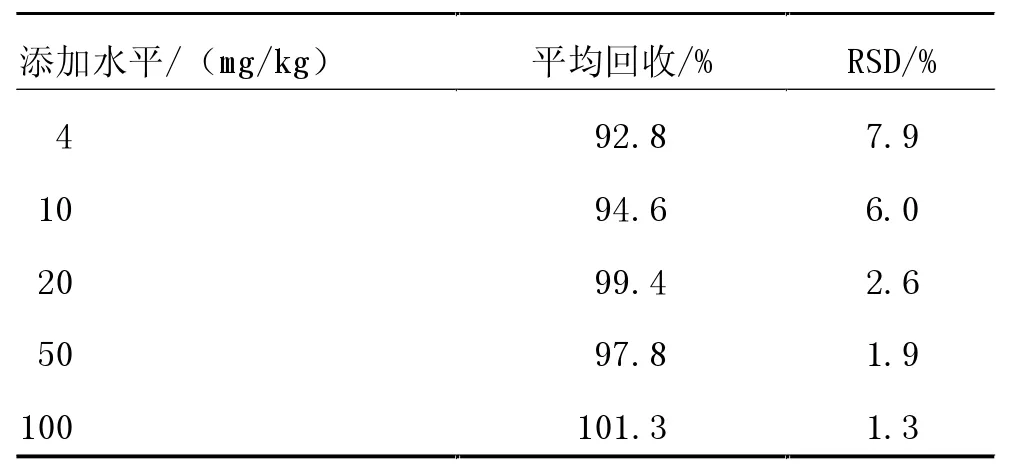
表5 泰万菌素的平均回收率(n=6)
2.4 实际应用
本研究从市场上购买了5 种共20 批次饲料,其中猪用配合饲料2 种、禽用配合饲料3 种,不同种类饲料各4 批,使用上述方法进行检测。 结果显示,仅有1 批次禽用配合饲料中检出泰万菌素。 含量为2.318 mg/kg,低于本方法定量限,剩余样品均无检出。
3 结论
综上所述,本研究建立了用高效液相色谱法测定饲料中泰万菌素含量的方法, 该方法线性范围广、前处理简单且检测速度快,适用于测定饲料中泰万菌素的含量,同时为饲料中泰万菌素检测提供了方法参考和借鉴。

