不同发育阶段桑天牛细菌群落多样性分析
郑建月,张杰,曾健勇,3,王华玲,4,李会平,4
(1河北农业大学,河北 保定 071000;2山西农业大学 植物保护学院,山西 晋中 030600;3河北省林木种质资源与森林保护重点实验室,河北 保定 071000;4河北省城市森林健康技术创新中心,河北 保定 071000)
桑天牛又名粒肩天牛、桑褐天牛,属鞘翅目天牛科沟胫天牛亚科,是杨树、构树、桑树、苹果等多种林木的主要蛀干害虫,幼虫成虫都能对林木造成危害,严重威胁着林、果、蚕业的发展[1]。为了寻求有效的防治桑天牛方法,国内外学者做了大量研究并取得了显著成果。苏筱雨等总结多年研究成果,提出了一套桑天牛无公害控制技术:应用桑天牛卵长尾啮小蜂、白僵菌、灭幼脲和树种抗性等综合作用来防治不同时期的桑天牛[2]。随着技术的发展,关于肠道微生物的研究逐渐深入,学者们认为通过改良操纵昆虫肠道细菌实现害虫的防治是一个全新的视角[3]。
在协同进化过程中,昆虫体内形成了与宿主昆虫生命活动紧密相关的复杂的功能微生物群落[4]。这些微生物可以协助宿主昆虫消化,为宿主提供营养物质,可以协助宿主昆虫降解有毒化合物,使宿主具有更强的环境适应能力[5-6]。但昆虫肠道微生物的多样性受到肠道特殊结构、昆虫性别、发育龄期等多种因素影响,即使是同一目的昆虫也具有不同的优势菌门及菌属[7]。受发育龄期影响,甜菜夜蛾幼虫肠道中的优势菌属会随宿主龄期发生变化;其中不动杆菌属的相对丰度随宿主龄期的变化出现先下降后上升的趋势,在第 5 龄时相对丰度最大;而噬氢菌属和噬酸菌属的相对丰度则随着宿主的龄期变化呈现下降的趋势[8]。在梨小食心虫中则表现为早期幼虫(1 龄和2 龄)的细菌多样性显著高于末期幼虫(3 龄至5 龄);与末期幼虫相比,雄性蛹和成虫的细菌丰富度再次增加[9]。因此,发育龄期对昆虫微生物多样性具有很大影响,并且不同菌种在不同昆虫中会呈现出不同的变化趋势。在先前关于桑天牛的研究中并未关注这一现象。
目前关于桑天牛肠道微生物的研究主要集中在其生活史的某一发育阶段(成虫或幼虫),但对不同发育阶段菌群组成及多样性变化的研究还未见报道。因此本研究利用 16S rRNA 技术对桑天牛不同发育阶段(卵、初孵幼虫、老熟幼虫、雌雄成虫)的细菌群落多样性进行了探究,旨在明确桑天牛不同发育阶段的细菌群落组成,探究共生微生物在桑天牛生长中的重要作用,为通过生物途径防治桑天牛奠定基础。
1 材料与方法
1.1 供试虫源
成虫:采集自河北农业大学标本园(河北保定),寄主植物为桑树。
卵:将野外采集的成虫带回室内养虫笼中饲养,以1年生细嫩桑枝补充营养,另放入标本园内采集的 2~3 年生(直径 1~3 cm)毛白杨枝条用于产卵,1 周后自产卵枝条中将卵取出[10]。
初孵幼虫:自枝条中取出的卵放在含有湿润滤纸的无菌培养皿中让其孵化,随时观察,获得初孵幼虫。
老熟幼虫:采集自河北农业大学标本园,寄主植物为毛白杨。
1.2 材料前期处理
将采集的桑天牛初孵幼虫、老熟幼虫、雌雄成虫饥饿处理48 h。然后将雌雄成虫、幼虫以及卵的样本在75%乙醇中浸泡3 min,然后用无菌水冲洗3遍,最后在超净工作台内用解剖镜及高温灭菌的镊子解剖幼虫及成虫,取出其整条肠道。将卵和解剖获得的肠道转移至含100 μL PBS 缓冲液的 2 mL 离心管中,用液氮速冻后转移至超低温冰箱保存备用[11]。每个样本保留4个重复。
1.3 细菌16S rRNA 测序
使用粪便DNA提取试剂盒(QIAamp PowerFecal Pro DNA Kit)提取肠道内容物总DNA。并用引物341 F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806 R(5’-GGACTACHVGGGTWTCTAAT-3’)进行PCR扩增[12]。PCR扩增体系(50 μL)如下:PCR master mix(TaKaRa TaqTMVersion 2.0 plus dye)25 μL,上下游引物各2 μL,模板DNA 1 μL,ddH2O 20 μL。PCR反应程序为:94 ℃预变性3 min,94 ℃变性30 s,55℃退火45 s,72 ℃延伸45 s,共30个循环; 72 ℃延伸10 min,4 ℃终止反应。采用1%的琼脂糖进行电泳,用凝胶提取试剂盒(QIAquick Gel Extraction kit)(QIAGEN) 对PCR产物进行纯化。构建好的文库使用Illumina MiSeq测序平台进行测序[13]。
1.4 测序数据质控与OTU注释
通过PE reads重叠关系,将配对后的reads以最小重叠长度为10 bp的标准合并为1个序列,最大允许错配比为20%。通过barcode分辨样本barcode错配允许个数为0,引物错配允许个数为2。用Usearch软件在97 %的相似性水平上对序列进行OUT聚类。并利用UCHIME来识别和移除嵌合物去除嵌合体,根据Silva分类数据库进行分类注释[14]。
1.5 细菌多样性分析
通过 Mothur (v.1.21.1)软件分析获得多样性指数、Rank-Abundance曲线、物种累积曲线,并利用 R 语言工具包制作成图[15]。本研究统计的多样性指数有Chao指数、Shannon指数、Simpson指数、ACE指数、测序深度指数和均匀度指数。采用维恩图(Venn)展示桑天牛细菌样本共有及特有OTU。利用 R 语言工具绘制样本聚类树与柱状图。使用R语言PCoA分析和vegan软件包进行主坐标分析(PCoA)分析和基于Beta多样性距离的非度量多维尺度分析(NMDS)。通过FAPROTAX软件进行功能预测分析。
2 结果与分析
2.1 桑天牛不同发育阶段细菌OUT聚类分析
本试验中共有 20 个样品,分为卵(E)、初孵幼虫(NL)、老熟幼虫(ML)、雌成虫(FA)与雄成虫(MA)5个组,每组 4 个重复。测序文库共获得1 536 330条序列,其中有效序列有1 533 509条,每个样品至少产生28 916条,平均产生51 211条,平均序列长度为423.89 bp。结果显示测序数据质量较高,可以用作后续分析。
关于桑天牛不同发育阶段的物种累积曲线和Rank-Abundance曲线见图1。
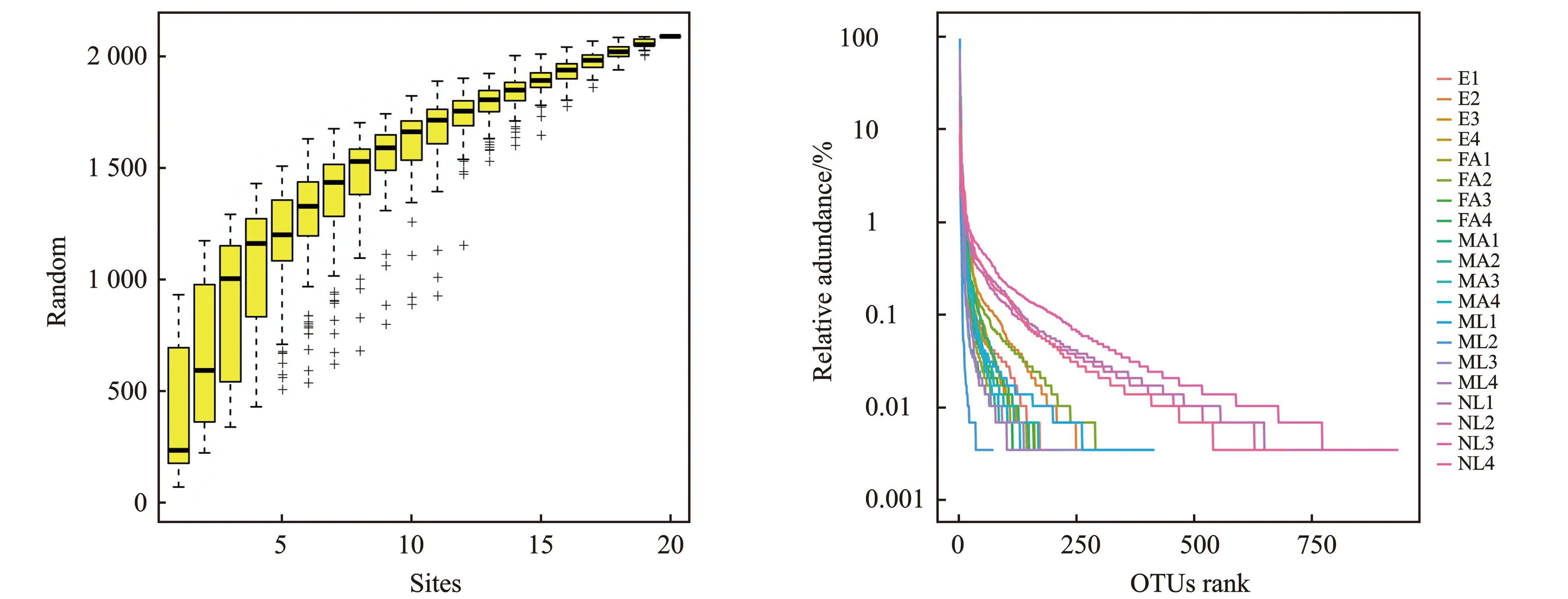
(a) (b)图1 桑天牛不同发育阶段的物种累积曲线和Rank-Abundance曲线Figure 1 Species accumulation curves and Rank-Abundance curves in different developmental stages of Apriona germari注:E代表卵;NL代表初孵幼虫;ML代表老熟幼虫;FA代表雌成虫;MA代表雄成虫。
由图1可知,随样本量增大,物质积累曲线逐渐趋于平缓,说明抽样数据足够充分,可进行数据分析(图1a)。初孵幼虫Rank-Abundance曲线水平方向跨度较大,垂直方向上平滑程度小(图1 b),说明桑天牛初孵幼虫时期肠道菌群组成比较丰富,但物种分布的均匀度较低。其余发育阶段样品在水平方向跨度较小,说明丰富度相对较低,均匀度相对较高。
关于桑天牛不同发育阶段肠道组间OUT情况统计见图2。
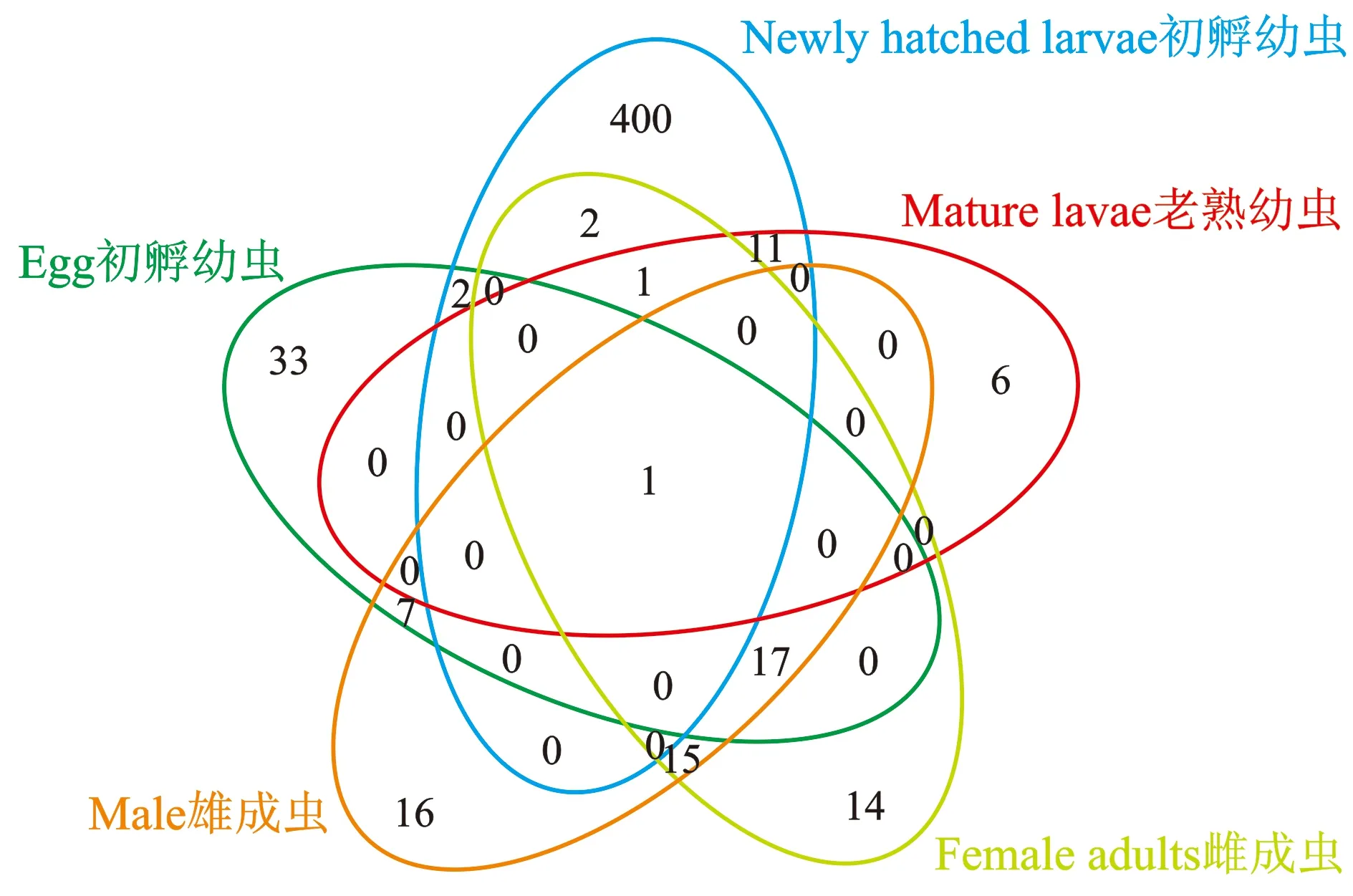
图2 桑天牛不同发育阶段肠道组间的共有以及特有OTUsFigure 2 Common and specific OTUs in different developmental stages of Apriona germari
由图2可知,桑天牛在卵、初孵幼虫、老熟幼虫、雌性成虫和雄性成虫中共有的细菌OTU仅为1个,而卵、初孵幼虫、老熟幼虫、雌雄成虫特有OTUs分别为33、400、6、14和16个。说明桑天牛的不同发育阶段的肠道细菌的种类有很大的差异。卵与初孵幼虫共有OTUs为3个,初孵幼虫与老熟幼虫共有OTUs为13个,雌雄成虫共有OTUs为33个。卵与雌雄成虫共有OTUs为18个。因此,桑天牛雌雄成虫细菌OTU相似度较高,其次为卵与雌雄成虫和初孵幼虫与老熟幼虫。
2.2 桑天牛不同发育阶段细菌Alpha多样性分析
关于桑天牛肠道菌群的Alpha多样性分析见表1。

表1 不同发育阶段桑天牛肠道菌群的样本测序数据结果及Alpha多样性分析Table 1 Reads number and Alpha diversity index statistics in different developmental stages of Apriona germari
由表1可知,测序深度指数coverage表明每个样本的覆盖率都达到99.84%以上,说明可检测出大多数物种,能客观反映各样本物种信息。桑天牛在初孵幼虫阶段的微生物Chao1 、Shannon、ACE指数明显高于其他发育阶段,其次为卵和老熟幼虫阶段,而Simpson指数明显小于其他发育阶段,表明桑天牛初孵幼虫阶段的细菌多样性高于桑天牛卵期、老熟幼虫、雌雄成虫3个阶段。
2.3 不同发育阶段细菌Beta多样性分析
关于桑天牛不同发育阶段的Beta多样性分析见图3。
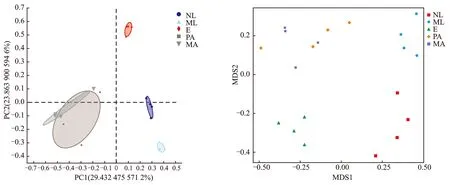
(a) PCOA分析图 (b)NMDS分析图图3 桑天牛不同发育阶段的PCoA 分析图与NMDS分析图Figure 3 PCoA and NMDS plots of bacterial communities in different developmental stages of Apriona germari注:E代表卵;NL代表初孵幼虫;ML代表老熟幼虫;FA代表雌成虫;MA代表雄成虫。
图3的PCoA与NMDS分析结果显示,桑天牛的雌雄成虫菌群有交叠在一起的现象,卵期、初孵幼虫期、与老熟幼虫期没有交互现象,说明桑天牛雌雄成虫的细菌群落结果较为相似,与其他 3 个发育阶段间相互存在差异。
2.4 桑天牛不同发育阶段细菌组成分析
关于桑天牛不同发育阶段不同分类阶元统计见表2。
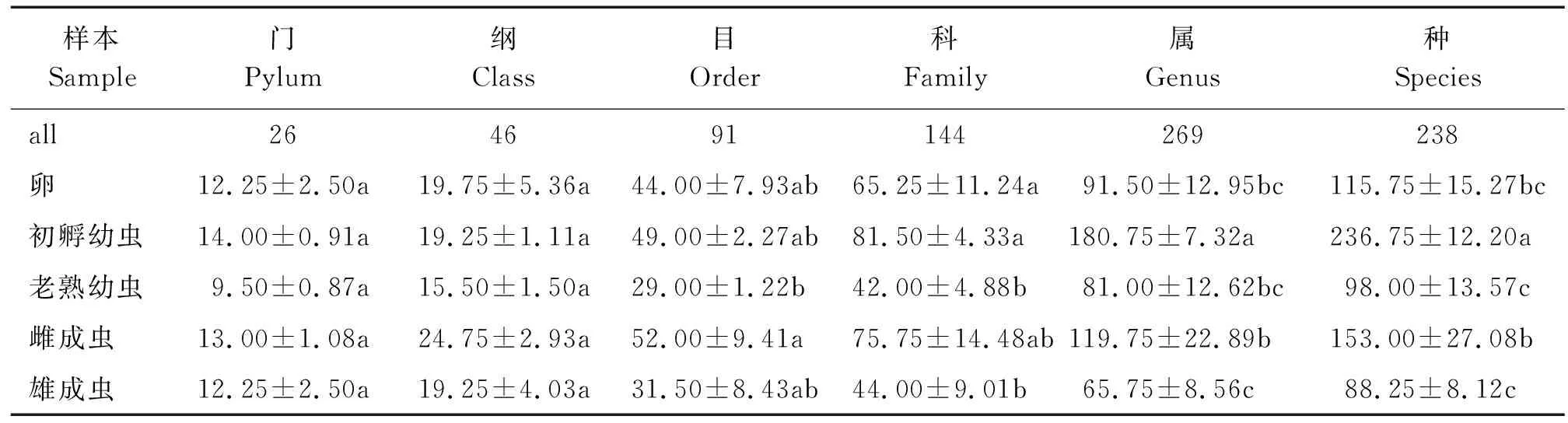
表2 桑天牛不同发育阶段在不同分类阶元的组成数目统计Table 2 Statistics on the number of components at each classification level in different developmental stages of Apriona germari
本研究共注释到26门46纲91目144科269属238种桑天牛细菌。由表2可知,在门与纲水平组成数目相同,从目到种水平出现差异,其中初孵幼虫阶段的注释数目最多,明显高于其他发育阶段。
关于桑天牛不同发育阶段样本聚类情况见图4。
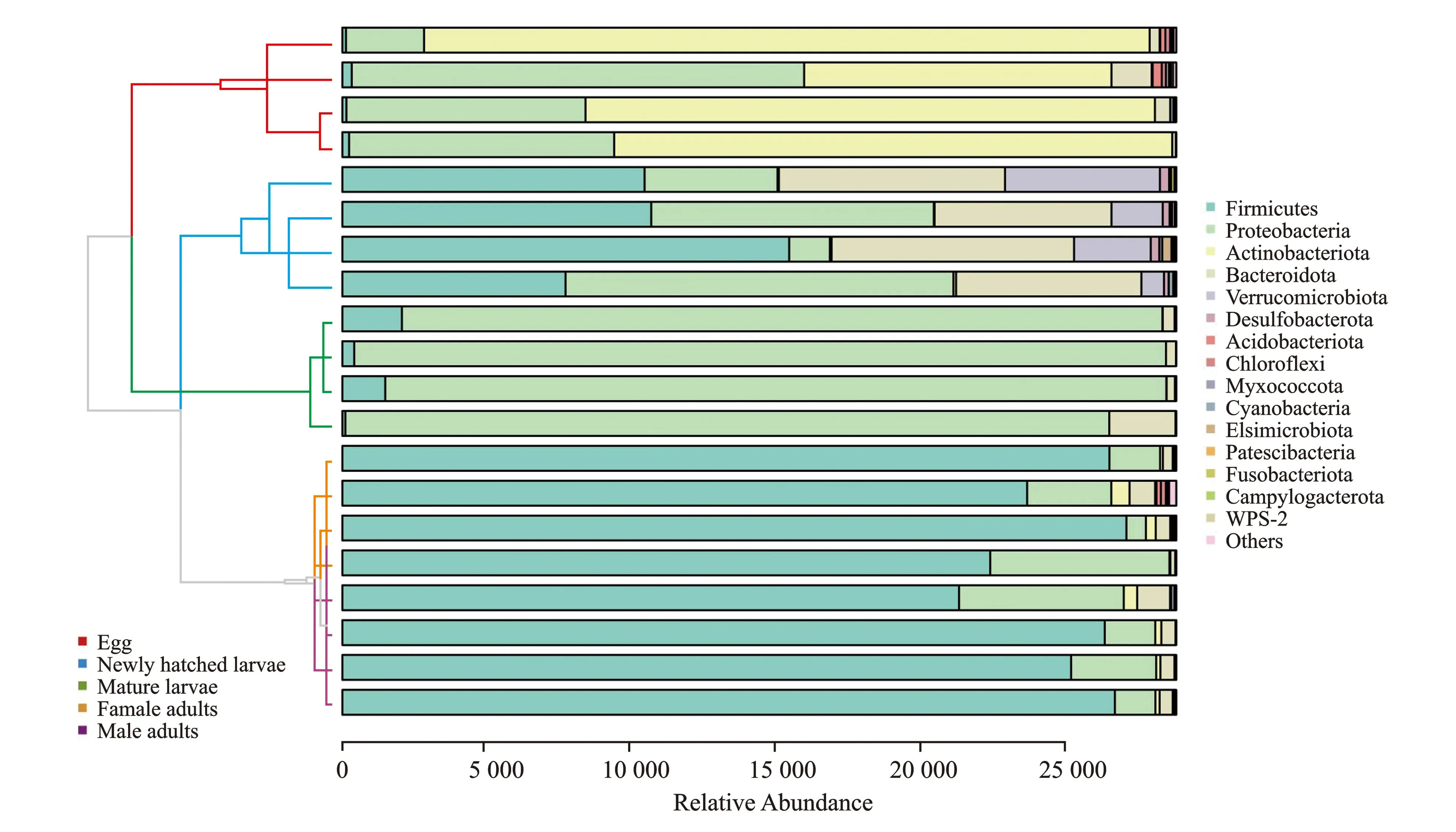
图4 桑天牛不同发育阶段样本聚类树与柱状图组合分析图(门水平)Figure 4 Microbial community barplot and sample cluster tree in different developmental stages of Apriona germari(Phylum level)注:Egg代表卵;Newly hatched larvae代表初孵幼虫;Mature larvae代表老熟幼虫;Female adults代表雌成虫;Male adults代表雄成虫。
由图4可知,桑天牛初孵幼虫与老熟幼虫样本聚类成簇,卵与雌雄成虫聚类成簇,说明初孵幼虫与老熟幼虫相似度较高,而卵与雌雄成虫相似度较高。
关于桑天牛不同发育阶段肠道中几种主要菌门的丰度差异见表3。
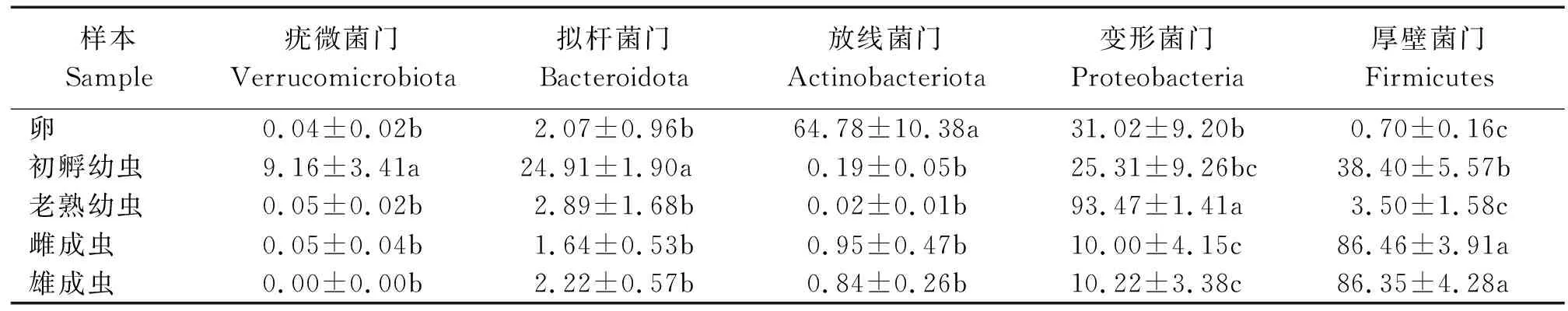
表3 桑天牛不同发育阶段肠道细菌主要菌门差异性分析Table 3 Difference analysis of main bacterial phyla of gut bacteria in different developmental stages of Apriona germari
在门分类水平共注释到了放线菌门、变形菌门、拟杆菌门、厚壁菌门、疣微杆菌门、酸杆菌门、蓝细菌门、脱硫杆菌门、弯曲杆菌门、梭菌门等26个门。不同发育阶段的优势菌门有所不同(图3)。卵期的优势菌门为放线菌门(64.78%)、次优势菌门为变形菌门(31.02%),其次为拟杆菌门(2.07%)。初孵幼虫阶段的优势菌门为厚壁菌门(38.40%),其次为变形菌门(25.31%)、拟杆菌门(24.91%)、疣微杆菌门(9.16%)。在老熟幼虫阶段,变形菌门(93.47%)为优势菌门,其次为厚壁菌门(3.50%)和拟杆菌门(2.89%)。在雌雄成虫阶段优势菌门均为厚壁菌门(86.46%、86.35%),次优势菌门为变形菌门(10.00%、10.22%)。桑天牛在不同发育阶段具有不同的优势菌门,相对丰度也有所差异,但厚壁菌门和变形菌门几乎存在于桑天牛的各个发育阶段。变形菌门在卵、初孵幼虫、老熟幼虫3个阶段中丰度较高,其中老熟幼虫期占比显著高于卵期其他发育阶段。而厚壁菌门在初孵幼虫、雌雄成虫2个阶段丰度都较高,其中雌雄成虫期占比最高。初孵幼虫时期的疣微杆菌门明显高于其他阶段,放线菌门卵时期明显高于其他阶段。
关于属水平桑天牛不同发育阶段肠道细菌的组成见图5。
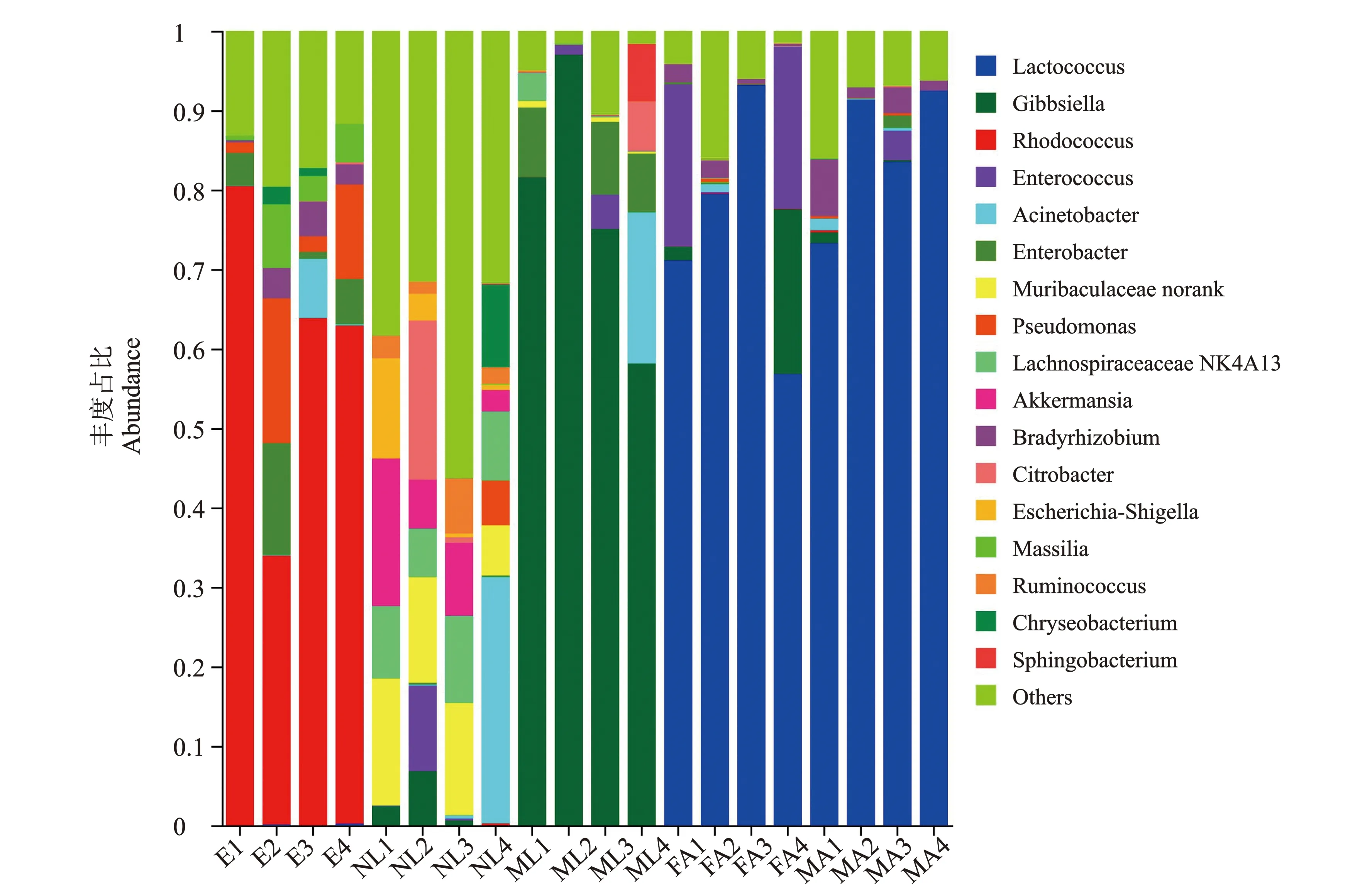
图5 桑天牛不同发育阶段肠道细菌的组成(属水平)Figure 5 Composition of bacterial communities in different developmental stages of Apriona germari(Genus level)注:E代表卵;NL代表初孵幼虫;ML代表老熟幼虫;FA代表雌成虫;MA代表雄成虫。
在属水平,共注释到269属细菌。桑天牛卵期的细菌主要包括红球菌属(60.23%)、假单胞菌属(8.33%)、肠杆菌属(6.19%)、Massilia(4.11%)、慢生根瘤菌属(2.76%)、Corynebacteriales(2.73%)、Methylovirgula(1.97%)和不动杆菌(1.93%)等。初孵幼虫细菌组成为科未知属(12.43%)、Akkermansia(9.15%)、Lachnospiraceae NK4A136 group(8.69%)、不动杆菌属(7.89%)、柠檬酸细菌属(5.20%)、埃希氏志贺氏菌菌属(4.28%)、拟杆菌属(3.41%)、瘤胃球菌属(3.35%)、肠球菌属(2.76%)、金黄杆菌属 (2.62%)、Gibbsiella(2.47%)、普氏菌属 (1.89%)、乳杆菌属 (1.64%)和假单胞菌属(1.35%)等,其种类比较丰富,但丰度都相对较低。在老熟幼虫中为Gibbsiella(77.94%)、肠杆菌属(6.35%)、不动杆菌属(4.76%)、鞘氨醇杆菌属(1.82%)、柠檬酸细菌属(1.54%)和肠球菌属(1.38%)等。雌雄成虫的优势菌均为乳球菌属,占比分别为75.15%、85.14%。但其次优势菌属不相同,雌成虫的次优势菌属为肠球菌属(10.25%)、Gibbsiella(5.62%)和慢生根瘤菌属 (1.32%)。雄成虫的次优势菌属为慢生根瘤菌属(3.25%)和Methylovirgula(2.38%)。假单胞菌属在卵期、初孵幼虫期均存在,并且占比有减少趋势。不动杆菌属在卵、初孵幼虫、老熟幼虫3个阶段均存在,占比先升高后降低。柠檬酸细菌属同时存在于初孵和老熟2幼虫阶段,有降低趋势。肠球菌属在初孵幼虫、老熟幼虫与雌成虫肠道内均存在,在雌成虫中占比较高。Gibbsiella在初孵幼虫、老熟幼虫与雌成虫肠道内均存在,占比有先升高后降低趋势。Methylovirgula存在于卵与雄成虫,二者占比相似。
2.5 细菌功能预测
关于桑天牛不同发育阶段肠道细菌菌群功能预测结果见图6。
图6功能预测结果表明,化学异养、发酵及好氧性化学异养在桑天牛各个发育阶段的占比都比较丰富。除此之外,硝酸盐呼吸、动植物及人类病原体、动物肠道等也几乎存在于桑天牛各个阶段。甲醇氧化、甲基营养、锰氧化、硝酸盐还原、尿素分解、芳香烃降解、芳香族化合物降解、脂肪族非甲烷烃降解、烃降解、木质素分解、塑料降解、暗硫化物氧化、暗硫代硫酸盐氧化等功能在桑天牛卵期较为明显,其中甲醇氧化与甲基营养还存在于雄成虫内,芳香烃降解存在于雌成虫内,芳香族化合物降解存在于老熟幼虫。氮呼吸、亚硝酸氨化、延胡索酸呼吸、硫酸呼吸、硫化合物呼吸、纤维素水解等在初孵幼虫中较为丰富。固氮作用在卵和雌雄成虫阶段较为明显。参与调控需氧化能异养的细菌种类繁多但占比都不高,主要有不动杆菌属、假单胞菌属、慢生根瘤菌属、金黄杆菌属、埃希氏志贺氏菌属、柠檬酸细菌属。化能异养功能受红球菌属、拟杆菌属、瘤胃球菌属、金黄杆菌属、埃希氏志贺氏菌属、Akkermansia、乳杆菌属、乳球菌属、不动杆菌属、肠杆菌属、肠球菌属等多菌属作用。拟杆菌属、瘤胃球菌属、埃希氏志贺氏菌属、Akkermansia、乳杆菌属、柠檬酸细菌属、肠杆菌属、肠球菌属、乳球菌属都对发酵功能有贡献,其中乳球菌属、拟杆菌属、瘤胃球菌属占比较大。固氮作用主要受慢生根瘤菌属影响。植物病原体主要受乳球菌属、假单胞菌属影响。假单胞菌属主要控制暗硫代硫酸盐氧化、暗硫化物氧化、锰氧化等氧化作用和木质素分解功能。与动物肠道相关的菌主要有肠杆菌属、拟杆菌属、瘤胃球菌属、埃希氏志贺氏菌属、柠檬酸细菌属。与动物寄生体或共生体相关细菌为肠杆菌属、Massilia、普氏菌属、拟杆菌属、瘤胃球菌属、埃希氏志贺氏菌属、假单胞菌属。芳香烃降解功能由红球菌属和假单胞菌属2菌属控制。芳香族化合物降解受不动杆菌属、红球菌属、假单胞菌属调控。芳香族非甲烷烃降解只受沙雷氏菌属调控。烃降解的调控菌主要有沙雷氏菌属、假单胞菌属。氮呼吸、硝酸盐呼吸和硝酸盐还原功能主要受假单胞菌属、埃希氏志贺氏菌属、肠杆菌属3菌调控;在前两个呼吸作用中3菌丰度都较低,而在还原作用中肠杆菌属占比较高。塑料降解主要受假单胞菌属控制。由此可见,细菌群落在桑天牛各发育阶段发挥着不同的作用。
3 讨论
随着宏基因组及测序技术的快速发展,关于桑天牛微生物的研究也更加深入,但关于不同发育阶段之间菌群差异的研究还未见报道。本研究利用16S rRNA测序技术对桑天牛卵、初孵幼虫、老熟幼虫、雌雄成虫的肠道细菌进行高通量测序探究了不同发育阶段天牛细菌多样性。由于桑天牛生活史较长,且本试验室并未完成其世代连续培养,因此各阶段材料来源并不完全一致,为减小环境因素影响,本研究尽量保持桑天牛寄主一致,室内饲养天牛枝条与田间采集枝条来源一致。本研究中不同阶段桑天牛由不同菌群组成,初孵幼虫包含不动杆菌属、柠檬酸细菌属、拟杆菌属等13个属的细菌;而卵期有8个菌属,老熟幼虫有6个菌属,雌成虫有 4 个菌属,雄成虫 3 个菌属。初孵幼虫可能是由于刚刚破除卵壳,发育还不稳定,因此需要种类繁多的菌群来补足自身发育需求,但由于本试验中初孵幼虫来自于湿润培养皿而不是来自树木,可能会导致补充菌群不足,因此出现丰度较低的现象。与本研究结果相似,在草地贪夜蛾的整个生命周期中微生物多样性会随着发育在大阶段(变态)间逐步降低,但不同的是它在不同龄的幼虫间多样性逐步增加。草地贪夜蛾的卵期微生物多样性最高,孵化成幼虫后多样性急剧下降,但其体内微生物种类随幼虫发育逐渐增多,到 6 龄时多样性最高,而成虫期群落丰富度最低[16]。细菌丰度随年龄逐渐减少的趋势在其他昆虫中也有所体现。大分舌蜂随着幼虫生长阶段的递进,其肠道微生物的多样性会出现逐步降低的现象,这可能与昆虫进食及肠道微生物驱动的环境适应有关[17]。同理,本研究中老熟幼虫与成虫阶段可能因为发育更为成熟、对环境适应力更高,已经在桑天牛体内形成了较为稳定且固定的细菌群落,在不受新刺激的情况下对新菌群的需求较少,因而这2个阶段肠道细菌多样性较低且优势菌属明显。其中,老熟幼虫中Gibbsiella属占比达到了77.83%,乳球菌属在雌雄成虫中占比分别为75.76%、85.27%。由此推测乳球菌属可能是来自昆虫肠道内的常驻菌属。此外,本研究结果显示桑天牛雌雄成虫间、初孵与老熟2幼虫间具有相似的细菌组成;卵期细菌OUT则更为接近雌雄成虫,其次为初孵幼虫。因此推测桑天牛雌雄成虫到卵、卵到初孵幼虫、初孵幼虫到老熟幼虫等相邻的发育阶段间存在垂直传播的现象,具有相同的肠道菌群。如假单胞菌属同时存在于卵期与初孵幼虫期;柠檬酸细菌属同时存在于初孵和老熟2幼虫阶段;不动杆菌属同时存在于卵、初孵幼虫、老熟幼虫3个阶段;肠球菌属同时存在于初孵幼虫、老熟幼虫、雌成虫3个阶段,极有可能由初孵幼虫到老熟幼虫一直稳定存在并传播至雌成虫。与本研究结果相似,家蚕卵与成虫及低龄幼虫的肠道微生物结构类似,而高龄幼虫间较为相似[18]。
肠道细菌是昆虫生长发育的重要组成部分,它可以帮助昆虫适应生存环境,通过改造肠道细菌阻碍昆虫发育是生物防治的新方法[3]。FAPROTAX 功能预测显示桑天牛肠道内大部分菌株也在不同阶段表现出了多种作用。假单胞菌属参与了所注释到的大多功能,尤其是氧化降解相关功能;而假单胞菌属在卵期与初孵幼虫期存在,说明这2个阶段氧化与降解等代谢活动旺盛。有报道证明,假单胞菌属与昆虫间存在多种相互作用,既可以是昆虫的致病菌,通过口腔或伤口感染进入宿主后释放毒素或其他致病因素致使昆虫发育迟缓、身体畸形等,最终导致昆虫死亡;也可以是昆虫体内有益的共生微生物,在低浓度时对昆虫生长有益;其中有些菌株也可以将昆虫作为载体,在合适的时机由昆虫传播到植物寄主,在此期间菌与昆虫表现出中性关系[19]。在本研究中沙雷氏菌属并不是桑天牛的主要优势菌属,但也存在于桑天牛体内并参与了多种功能的调控。傅慧静等研究表明松褐天牛幼虫肠道内黏质沙雷氏菌可通过产生木质素过氧化物酶和锰过氧化物酶降解木质素,且降解能力较强[20]。昆虫肠道细菌生物学功能复杂多样,通过分离培养获得益生菌,对其进行改造并发掘其应用潜力对昆虫资源开发和害虫防治具有重大意义[7]。
家蚕成虫、卵以及1-2龄幼虫的肠道微生物结构类似,以假单胞菌和不动杆菌为主;高龄幼虫(3~5 龄)之间较为相似,以甲基杆菌属属和鞘氨醇单胞菌属细菌为主;肠球菌属、葡萄球菌属和微小杆菌属细菌在各龄期内均有存在[18]。与家蚕相似,桑天牛不同发育阶段的优势菌属也存在一定差异。桑天牛卵期的优势菌属为红球菌属;雌雄成虫的优势菌均为乳球菌属;老熟幼虫的优势菌属为Gibbsiella、肠杆菌属、不动杆菌属、鞘氨醇杆菌属、柠檬酸杆菌属和肠球菌属,其中Gibbsiella的丰度最高。Gibbsiella在桑天牛初孵幼虫、老熟幼虫与雌成虫肠道内均存在且占比有先升高后降低趋势,出现这一现象可能是由于肠道内Gibbsiella同时来源于前一阶段的虫体和取食的寄主植物:一部分菌通过垂直传播,自幼虫肠道至成虫阶段一直存在,但由于完全变态时肠道结构变化导致菌群减少。已有研究显示完全变态发育的昆虫在成虫阶段,幼虫的肠道会完全消失,但是有些肠道微生物可以通过隐窝结构保留[21]。另一部分菌则来源于寄主植物的横向传播,幼虫后期取食寄主植物导致菌占比增加。因此,本课题组通过从桑天牛不同发育阶段以及不同寄主2部分出发,探究了桑天牛肠道菌群的组成及变化,希望能在桑天牛生物防治中找到新的出发点[22]。但本试验也存在一些不足之处,如没有获得桑天牛蛹期样本,没有对幼虫进行详细的龄期划分,可能会导致研究不够全面。
4 结论
本研究从桑天牛不同发育阶段出发,探究了桑天牛卵、初孵幼虫、老熟幼虫以及雌雄成虫的细菌群落组成。在桑天牛不同发育阶段存在着不同的优势菌落,但一些菌落存在于桑天牛多个发育阶段,可能是桑天牛的定殖菌群,在桑天牛体内稳定存在;另一些则可能是通过取食寄主植物获得过路菌群,二者均为桑天牛适应寄主发挥作用。如卵期和初孵幼虫期微生物种类众多,同时各种与生命活动相关的功能也繁多,说明这2个阶段桑天牛代谢活动旺盛,为后期的生长发育打下基础。

