土壤深度对凤丹根际细菌群落组成和多样性影响
肖夏,胡艺春,杨丽,邢广宇,汪成忠
(1 江苏三维园艺有限公司,江苏 昆山 215016;2苏州农业职业技术学院,江苏 苏州 215008)
土壤微生物在土壤生态系统中发挥着重要作用,在土壤养分循环利用、植物生长发育、植物抗逆性及维持根系平衡方面具有十分重要的作用。对土壤细菌群落结构组成和多样性的探究,可以了解植物根际土壤生态的平衡和稳定[1-3]。已有研究表明,土壤微生物对季节、海拔及土壤深度方面都具有独特的物种结构和分布格局[4-6]。土壤深度被认为是土壤性质的生态过滤器,沿着土壤剖面形成高度异质性的梯度环境,影响土壤微生物群落的多样性、组成和功能[1]。由于深层土壤受到地上的干扰较低,其土壤微生物的结构和组成更能反映土壤原本的微生物,但目前对底层土壤微生物的群落结构及功能研究仍滞后于表层土壤[7]。此外,深层土壤储存了大量的微生物,结构稳定,对深层土壤微生物的探究有利于阐释植物连作障碍的发生机制[4]。
油用牡丹是我国十分重要的一种经济兼观赏花卉,具有寿命长、产量高、结实能力强的特点,目前在中国南方广泛种植[8]。凤丹(Paeoniaostii)是我国广泛种植的油用牡丹品种,其种子含有丰富的不饱和脂肪酸和白藜芦醇等物质,在食品和药品领域具有重要的应用价值[9]。但因耕地不足及需求量的增加,油用牡丹通常连年种植,开花量和产籽量降低,病虫害发生严重,再植后出现生长缓慢、生长势差、根系不发达的情况,连作障碍已成为制约凤丹种植的主要因素之一[10-12]。郭丽丽等探究了凤丹不同种植时间根际细菌群落的多样性变化,以及不同种植模式下凤丹根际微生物群落机构及多样性,而关于油用牡丹土壤根际微生物群落组成和结构分布格局尚不明晰[13-14]。本试验采用Mesiq高通量测序技术,对安徽铜陵牡丹园不同深度土壤的凤丹根际细菌群落组成及结构进行研究,阐明在不同土壤深度下凤丹根际细菌群落结构组成规律及分布格局,为后续深入研究凤丹土壤微生物环境奠定基础。
1 材料与方法
1.1 研究区概况
研究地位于安徽省铜陵市(E 118°01′13.39″,N 30°52′14.28″),为亚热带季风气候,全年温暖湿润,湿度较大,雨热同季,无霜期较长。年平均降水量为1 384.7 mm,蒸发量1 280 mm。年平均气温16.2 ℃,极端高温41 ℃,极端低温为-11.9 ℃,无霜期年平均为230 d,全年日照为2 000~2 050 h,土壤以黄红壤土和黄褐土为主。
1.2 试验材料
供试土壤取自凤凰山牡丹园,面积15 hm2。在园区选择位置一致、耕作管理一致、长势良好的8年生凤丹3株,以其植株30~40 cm 为半径的范围内,去除表面的枯枝落叶后,利用土壤采样器采集深度为0~20 cm(记作A)、20~40 cm(记作B)和40~60 cm(记作C)的土样。取样时,从挖掘出的土壤中,轻轻取出凤丹根系,将根系上松散土壤除去,之后将附着在根系2 mm范围内的土壤收集起来作为根际土壤,之后将土壤分别装入无菌牛皮纸袋、做好标记,放入冰盒带回实验室,用无菌2 mm的土壤筛去除其他杂质后,4 ℃保存,每处理3次重复,共9个土壤样品。
1.3 试验方法
1.3.1 土壤微生物基因组 DNA 提取及质量检测 土壤基因组DNA使用Power soil extraction kit-12888(USA) 试剂盒,提取方法参照说明书。提取出的土壤微生物总DNA采用Nanodrop检测 DNA 样品纯度和浓度;土壤DNA 样品置于-80 ℃保存。
1.3.2 PCR扩增细菌 对土壤细菌采用16S rRNA 基因 V3-V4 可变区进行扩增,引物序列为341 F (5′-CCCTACACGACGCTCTTCCGATCTGCCTACGGGNGGCWGCAG-3′)和805 R (5′-GACTGGAGTTCCTTGGCACCCGAGAATTCC AGACTACHGGGTATCTAATCC-3′)。扩增体系为25 μL:包含10 g DNA,12.5 μL PCR reaction mix,1 μL 正向引物341 F,1 μL 反向引物805 R,用去离子水补齐25 μL。PCR 扩增程序为:包括95 ℃ 5 min,35个循环(95 ℃ 1 min,52 ℃ 1 min,72 ℃ 10 min)。扩增后的PCR产物用Tiangen Gel Clean KIT 试剂盒进行纯化。PCR纯化产物采用Qubit 2.0进行定量,符合测序浓度要求,检测合格后,采用Illumina MiSeq对 16S rRNA 基因序列的 V3-V4 区进行高通量测序,测序由上海美吉生物医学有限公司完成。
1.3.3 信息分析流程 首先删除原始序列中的错配序列和低质量序列,得到可用序列;然后采用PEAR软件对双端序列进行序列拼接,拼接采用默认算法;采用CD-HIT软件依据97%的置信范围进行聚类,聚类后获得OTU (Operational taxonomic unit)表。采用Silva数据库对获得的OTU序列进行比对。依据最小序列数对所有样品进行抽平,然后使用抽平后的OTU表进行α和β多样性、群落组成、heatmap分析,分析均采用R语言的“micro-eco”包实现。PCoA基于OTU水平采用R语言的“micro-eco”包完成,采用Bray-Curtis距离矩阵。Heatmap图选择科水平,选取丰度排名前25科水平绘制热图。PERMANOVA采用R语言的“Vegan”软件包实现。
2 结果与分析
2.1 不同土层凤丹根际细菌OTU
不同土壤深度中的凤丹根际细菌群落,见图1。
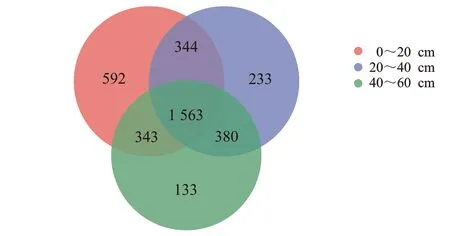
图1 不同土壤深度凤丹根际细菌群落韦恩图Figure 1 Venn diagram of rhizosphere bacterial community in P.ostii at different soil layers
由图1可知,不同土壤深度凤丹的9个根际土壤样品中共获得3 588个细菌OTUs,分属于20门,60纲、100目、110科、98属。OTUs 数目均介于750~900之间。0~20、20~40、40~60 cm凤丹根际土壤样品分别获得 2 842、2 520、2 419个细菌OTUs,OTUs数目均一化较高。其中,3种土壤深度共有根际细菌OTU数目为1 563个,占总数的43.56%;0~20 cm的根际细菌特有OTU数目为592个,占总数的16.50%;20~40 cm的根际细菌特有OTU数目为233个,占总数的6.49%;40~60 cm的根际细菌特有OTU数目为133个,占总数的3.71%。这表明不同土壤深度间凤丹根际细菌组成存在一定的差异,且随着土壤深度的增加根际细菌种类数目逐渐减少。
2.2 不同土壤深度中凤丹根际细菌物种的丰度聚类
基于最大似然法,对科水平不同土壤深度的细菌进行丰度聚类分析结果,见图2。
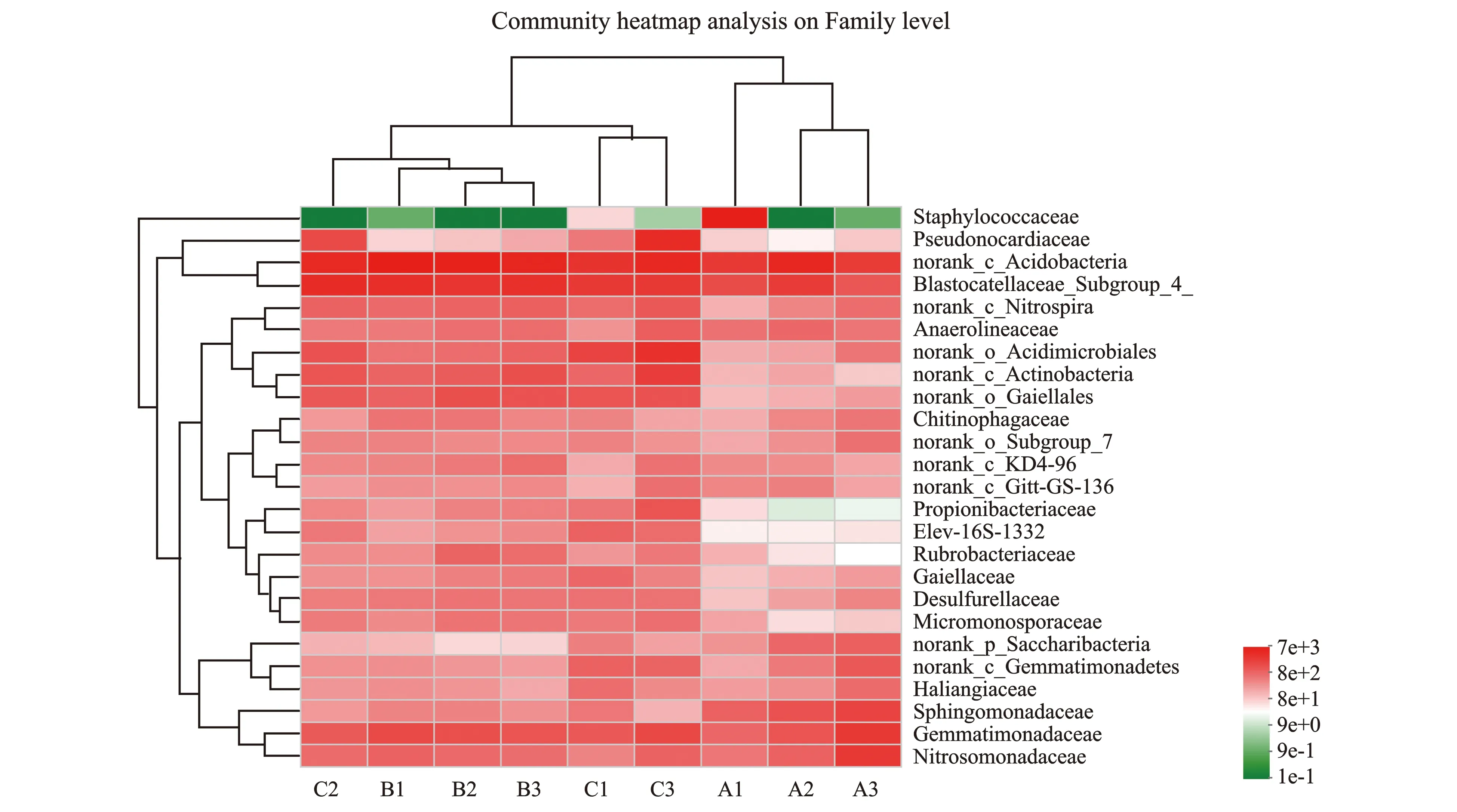
图2 不同土壤深度凤丹根际细菌物种丰度科水平上的聚类分析Figure 2 Cluster analysis at the family level of species abundance in the rhizosphere of P. ostii at different soil layers
由图2可知,经聚类结果表明,0~20 cm土壤深度的根际细菌聚为1类,20~40 cm和40~60 cm的根际细菌聚为1类。这说明20~40 cm和40~60 cm的根际细菌在科水平物种组成比较接近,而与0~20 cm的根际细菌科结构差异较明显。这表明随着土壤深度的增加,根际土壤细菌群落结构也会发生变化。PERMANOVA结果表明,不同土壤深度细菌群落结构发现显著改变(P<0.05)。
2.3 不同土壤深度中凤丹根际细菌群落结构组成
不同土壤深度凤丹根际细菌门水平的组成特征,见图3。
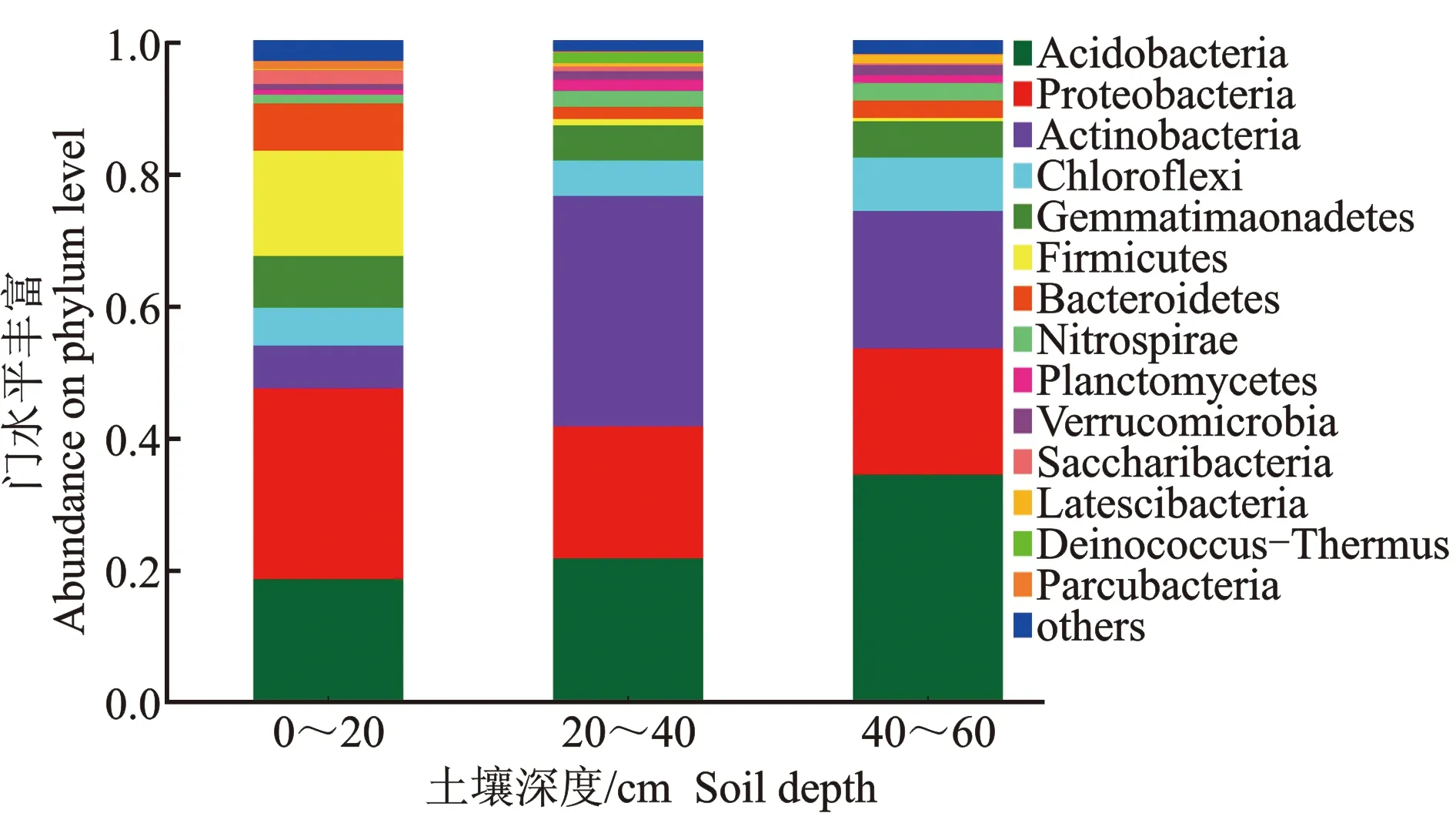
图3 凤丹根际细菌门水平上的组成特征Figure 3 Composition characteristics at the level of rhizosphere bacterial phyla of P.ostii
由图3可知,研究的3种土壤深度凤丹根际优势细菌门主要是酸杆菌门(Acidobacteria)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadetes)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)以及硝化螺旋菌门(Nitrospirae)等,其中酸杆菌门(Acidobacteria)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和绿弯菌门(Chloroflexi)四者丰度之和高达60%以上。其中,酸杆菌门(Acidobacteria)丰度随着土壤深度的增加而增加,在0~20 cm土层中占比18.7%,在40~60 cm土层中酸杆菌门丰度达到34.5%。而厚壁菌门(Firmicutes)丰度则随着土壤深度的增加而降低,在0~20 cm土层中占比16.0%,而在20~40、40~60 cm土层中占比仅有1.0%。放线菌门(Actinobacteria)丰度则是在20~40 cm土壤深度最高,占比为34.8%,在0~20 cm土层中仅占比6.5%,在 40~60 cm土层为20.7%。
不同土壤深度凤丹根际细菌纲水平的组成特征,见图4。
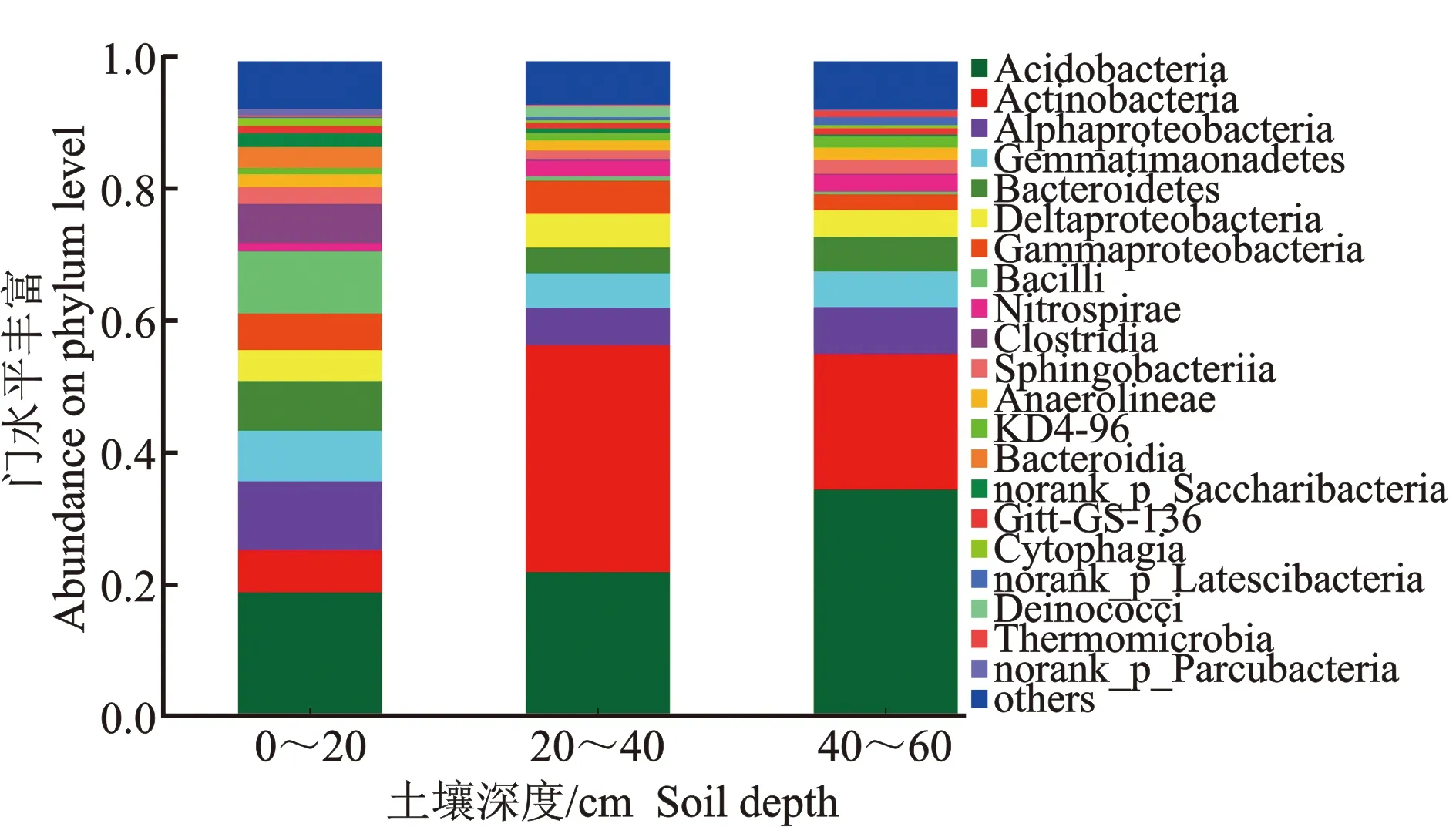
图4 不同深度土层凤丹根际细菌纲水平上的群落结构特征Figure 4 Characteristics of community structure at the level of rhizosphere bacteria class in different soil layers of P.ostii
由图4可知,不同土壤深度中凤丹根际优势细菌纲主要是酸杆菌纲(Acidobacteria)、放线菌纲(Actinobacteria)、α-变形杆菌纲(Alphaproteobacteria)以及芽单胞菌纲(Bacilli)。其中,导致3种土层差异的主要细菌纲是酸杆菌纲(Acidobacteria)、放线细菌纲(Actinobacteria)以及芽胞杆菌纲(Bacilli)。其中,酸杆菌纲(Acidobacteria)在0~20 cm和20~40 cm土层中丰度分别达到18.7%和21.8%,而在40~60 cm土层中为34.5%,是前二者占比的1.58~1.84倍。放线细菌纲(Actinobacteria)在0~20 cm土层中仅占比6.5%,在20~40、40~60 cm土层中分别达到34.8%和20.7%。芽胞杆菌纲(Bacilli)在0~20 cm土层中丰度达到9.5%,而在20~40 cm与40~60 cm土层中丰度不到1.0%。
2.4 不同土层中凤丹根际细菌群落多样性
不同土壤深度凤丹根际细菌群落α多样性,见图5。
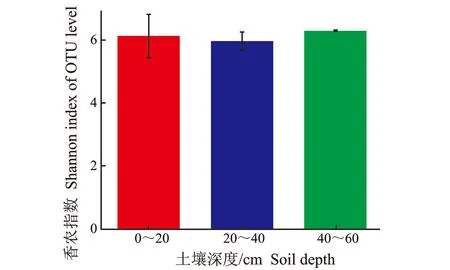
(a) 土壤细菌香农指数
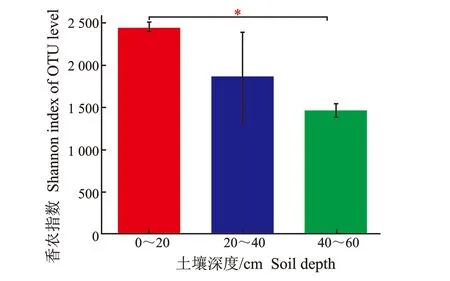
(b) 土壤细菌赵氏指数图5 凤丹根际细菌α多样性Figure 5 α-diversity of rhizosphere bacteria in P. ostii
由图5-(a)可知,不同土壤深度凤丹根际细菌Shannon多样性指数无显著性差异,表明3种土壤深度中的根际细菌群落多样性无差异。但随着土壤深度的增加,土壤细菌香农指数呈现先下降后降低的趋势,即土壤细菌香农指数的变化规律表现为:40~60 cm>0~20 cm>20~40 cm。
由图5-(b)可知,而0~20 cm与40~60 cm的Chao1指数具有显著性差异,说明0~20 cm土层与40~60 cm土层中的根际细菌丰富度具有显著性差异,且随着土壤深度的增加,丰富度指数逐渐降低,0~20 cm土层显著高于40~60 cm土层。即赵氏指数表现出的规律为:0~20 cm>20~40 cm>40~60 cm。
不同土壤深度凤丹根际细菌群落β多样性,见图6。
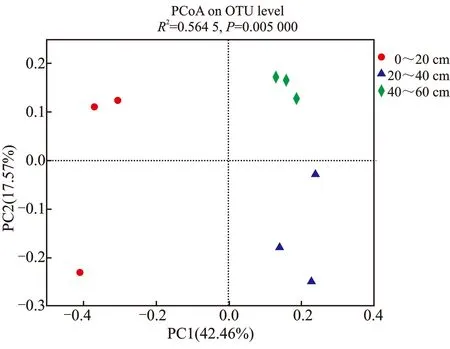
图6 不同土层凤丹根际细菌主坐标分析Figure 6 Analysis of principal coordinates of rhizosphere bacteria in different soil layers of P.ostii
由图6可知,通过主坐标分析能够实现多个样品间的分类,更进一步的展示样品间物种多样性的差异。从主坐标分析可以看出,3种土层间同组内样本距离较近且集中,表明每种土层组内样本间根际细菌群落差异较小,而各土层组间差异较大。从整体上来看,不同土壤深度间的土壤细菌群落结构差异显著,而且20~40 cm 和40~60 cm的土壤细菌群落结构更为接近。这也说明,上层土壤(0~20 cm)与下层土壤细菌的群落结构差异显著(P<0.05)。
3 讨论
凤丹牡丹长期种植后根际微生态环境发生改变,出现连作障碍[15]。杨瑞先指出凤丹牡丹的连作障碍主要是根际微生物失调的结果[10]。本研究对不同土层凤丹根际土壤细菌的分析表明,0 ~ 20 cm土层细菌物种数高于20~40 cm和40~60 cm,表明细菌物种丰富度随着土层深度的加深而降低。热图聚类结果表明,0~20 cm土壤深度的根际细菌聚为1类,20~40 cm和40~60 cm的根际细菌聚为1类,说明0~20 cm土壤深度与20~40 cm和40~60 cm深度土壤在细菌进化上具有一定的差异。Kim指出土壤剖面被认为是土壤性质的生态过滤器,随着土壤剖面深度的改变,土壤微生物群落多样性、组成及功能均会产生一定的变化[16]。本研究结果正体现了这一点。
本研究结果发现,不同深度土壤优势细菌门均为酸杆菌门、变形菌门、放线菌门和绿弯菌门,而不同土壤层次间的优势细菌纲主要为酸杆菌纲、放线细菌纲以及芽胞杆菌纲。从细菌纲的水平来看,酸杆菌纲、放线菌纲以及芽胞杆菌纲在不同土壤深度发生显著改变。其中,酸杆菌门是3种土层共同的优势细菌门,与郭丽丽等研究相一致[13]。且土壤深度相差越大(图3),优势菌丰度相差越大。有可能是长期单一种植凤丹牡丹,其根系分泌物以及植物残体随着种植时间的增加而逐渐富集,改变了根际土壤微环境,导致根际微生物群落结构发生改变[17-18]。变形菌门是细菌中最大的门,其中的许多类群可以进行固氮作用,并能够适应各种复杂的环境[19]。研究表明表层土壤中养分含量高,土壤通气条件好,适合富营养性的微生物生长,而随着土壤深度的增加,土壤养分条件降低,氧气含量减少,从而导致酸杆菌与放线菌微生物在表层土壤的富集[20]。本研究中,有可能由于凤丹栽培过程中人工添加肥料等措施,导致表层土壤养分含量明显高于下层土壤,最终造成表层土壤细菌种类高于下层土壤。
本研究结果发现,不同土壤层次根际细菌的Shannon多样性指数并未发生显著改变,表明3种土壤深度根际细菌群落多样性无差异。而0~20 cm土层与40~60 cm Chao1指数具有显著性差异,说明0~20 cm土层与40~60 cm土层根际细菌丰富度具有显著性差异。这表明不同土壤层次中的根际细菌的种类和均匀度改变并不明显,但是其细菌丰度却发生了显著改变,这可能是因为根际细菌的种类主要由土壤的性质决定的,地上植被并不会影响微生物种类和分布的变化,但会对根际细菌的丰度和含量进行调控。先前的研究结果也表明,随着土壤深度的增加,土壤细菌的丰富度呈显著降低的趋势[21-22]。但是由于土壤微生物的分布原因和控制因素比较复杂,也有一些研究发现随着土壤深度的改变,其土壤细菌的丰度Alpha多样性变化并不明显,例如Chernov等对比研究了碱土和草原栗钙土深达150 cm的细菌群落结构,发现细菌Alpha多样性在碱土中随深度增加而下降,而在栗钙土上变化不明显。Wang对青藏高原生态系统的研究发现,酸杆菌门是土壤最主要的优势细菌,土壤细菌群落较其他微生物具有更明显的垂直分布特征,且细菌多样性与海拔高度有一定的相关性[23-24]。Van等对森林土壤微生物垂直分布的探究表明,在0~80 cm深度内微生物丰度随土壤深度的增加而降低[25]。因此,未来需要进一步通过土壤理化性质、土壤酶活性、土壤微生物结构和功能等多维度综合试验,以阐释不同土壤深度凤丹土壤微生物群落结构和功能的分布规律及其调控机制。
4 结论
所有土壤样品共获得3 588个OTUs, 分属于20门,60纲、100目、110科、98属。不同土壤深度凤丹根际土壤细菌主要的差异细菌门为酸杆菌门、变形菌门、放线菌门和绿弯菌门,酸杆菌门(Acidobacteria)在0~20 cm土层中占比18.7%,而在40~60 cm土层中酸杆菌门丰度达到34.5%;主要的差异细菌纲为酸杆菌纲、放线细菌纲以及芽胞杆菌纲,酸杆菌纲在0~20 cm和20~40 cm土层中丰度分别达到18.7%和21.8%,而在40~60 cm土层中为34.5%,是前二者占比的1.58~1.84倍。Alpha多样性分析表明,土壤深度细菌群落多样性无差异,但0~20 cm土层与40~60 cm土层细菌丰富度具有显著性差异。Bate多样性表明,组内样本间细菌群落差异较小,而各土层组间差异较大。而且根际土壤细菌科水平聚类分析结果表明,20~40 cm和40~60 cm的根际细菌在科水平物种组成比较接近,而与0~20 cm的根际细菌科结构差异较明显,并且随着土壤深度的增加,土壤细菌种类和数目逐渐减少。

