DLEU1通过调控p38/JNK信号通路促进高血压大鼠血管平滑肌细胞增殖和血管重塑的实验研究
冉娅娅,邓功建,宋欢欢
高血压是心血管疾病的主要危险因素。全基因组关联研究已经确定了许多与血压调节相关的分子量>50 bp的单核苷酸多态性位点,这可以解释高血压的遗传倾向[1]。在前期的研究中发现,长链非编码RNA(lncRNA)-淋巴细胞白血病缺失基因1(DLEU1)的一个基因组位点与原发性高血压密切相关,DLEU1在血管平滑肌细胞(vascular smooth muscle cell,VSMCs)中高表达,并推测这可能与血压升高和血管重塑有关,DLEU1基因可能是高血压的潜在诱发因素。DLEU1的缺失、突变和失控与人类口腔鳞状细胞癌相关,并被认为是潜在的肿瘤抑制基因[2]。此外,DLEU1基因在肾母细胞瘤中也被鉴定为肿瘤抑制基因[3],但潜在的机制仍然不确定。血管重塑在高血压的发病过程中起着关键作用,其特征是血管结构异常、血管平滑肌细胞(VSMCs)增殖和迁移增加以及综合表型改变。此外,许多研究也证实了p38和c-jun氨基末端激酶(JNK)在血管平滑肌细胞增殖、迁移和凋亡过程中的重要作用[4-5]。p38/JNK可能通过不同的分子机制参与多种血管疾病,是治疗血管疾病的新靶点。然而,关于DLEU1对VSMCs功能的调节作用以及是否由p38和JNK介导仍不确定。因此,本研究旨在探讨阻断p38和JNK通路能否改变DLEU1转基因大鼠(DLEU1 transgenic rats,DTRs)的血压、心脏参数和血管结构。
1 材料与方法
1.1 实验动物及分组
12只DTRs大鼠委托赛业生物科技有限公司构建并验证。用戊巴比妥钠(120 mg/kg)腹腔注射麻醉12周龄雄性DTRs大鼠,开胸取心,解剖主动脉进行后续实验。用无创尾套法和BP-98A系统测量大鼠的收缩压、舒张压、平均血压和心率。测量心脏不同成分的重量,评价心脏肥大程度。主动脉、心脏、肾脏组织用4%多聚甲醛固定,石蜡包埋切片。切片用苏木精-伊红(HE)染色确定主动脉、心脏和肾脏的形态结构,用Massontri铬染色评估胶原面积和纤维化程度。使用Image-Pro Plus软件测定血管的中层厚度、血管直径、中膜面积、管腔面积和中膜/管腔面积比。计算同一组织切片内不同位置的5个随机测量值的平均值,得到各降主动脉的中层厚度。为了确定JNK和p38的作用,将12只大鼠随机分为对照组、DTRs组、p38组、JNK组。对照组:按照15 mg/kg体质量标准,对Wistar大鼠腹腔注射二甲基亚砜溶液;DTRs组:按照15 mg/kg体质量标准,对DTRs大鼠腹腔注射二甲基亚砜溶液;p38组:将1 μmol/L浓度的p38丝裂原活化蛋白激酶(MAPK)特异性抑制剂SB203580溶解于二甲基亚砜溶液中,按照15 mg/kg体质量标准进行腹腔注射;JNK组:将1 μmol/L浓度的JNK抑制剂SP600125溶解于二甲基亚砜溶液中,按照15 mg/kg体质量标准进行腹腔注射。所有动物实验操作均通过大学动物伦理委员会审核。
1.2 细胞模型构建
人主动脉VSMCs购自美国加利福尼亚州卡尔斯巴德科学细胞公司。将VSMCs在添加2%胎牛血清、1%平滑肌细胞生长补充剂和1%青霉素/链霉素溶液的平滑肌细胞培养液中培养。通过转染pcDNA3.1(+)_myc-His A-DLEU1进行DLEU1过表达VSMCs。阴性对照和DLEU1过表达质粒由GeneChem(中国上海)合成。在Opti-MEM1无血清培养基中,1 μg质粒与脂质体2000按生产说明书步骤,共同孵育20 min后,将细胞培养液换成含5%胎牛血清的DMEM培养液。通过实时荧光定量聚合酶链式反应(RT-PCR)检测DLEU1过表达的mRNA水平,验证DLEU1过表达细胞模型。
1.3 溴脱氧核苷尿嘧啶(BrdU)实验
将VSMCs接种于96孔板中,浓度为1×104个/孔,饥饿24 h后用10 μmol/L的BrdU标记细胞,并用固定液固定。将BrdU 5 mg用0.5 mL的1N-NaOH溶解,再加入蒸馏水5 mL。细胞培养结束前,加入终浓度为30 μg/L的BrdU,37 ℃孵育40 min。磷酸缓冲盐溶液(PBS)洗涤、甲醇/乙酸固定、5%血清封闭、甲酰胺变性核酸。洗涤后孵育抗BrdU单克隆抗体。在显微镜下随机计数10个高倍视野的细胞总数和BrdU阳性细胞数,计算细胞增殖率。洗涤后,将抗BrdU单克隆抗体孵育1 h,与山羊抗鼠免疫球蛋白G(IgG)偶联。加入过氧化物酶底物,停止溶液终止反应。用分光光度计微板阅读器在450 nm/550 nm波长处测定样品的吸光度。
1.4 细胞周期及迁移检测
将DLEU1过表达的VSMCs、胰酶消化后,在4 ℃、70%的冷乙醇中固定,去掉乙醇后再悬浮于200 μL磷酸盐缓冲液中,在4 ℃黑暗环境中用200 μL碘化丙啶孵育。染色细胞过滤,用流式细胞仪检测DNA荧光。将细胞种于24孔Boyden小室进行迁移实验,将含有10%胎牛血清的DMEM放置在小室底部,用无胎牛血清的DMEM中悬浮VSMCs细胞,以8×104个/孔的密度加入上室,用4%多聚甲醛固定后,用0.4%结晶紫染色。取出滤器上部的细胞,用倒置显微镜计数迁移细胞数。
1.5 蛋白免疫印迹法(Western Blot)检测
VSMCs细胞中提取蛋白样本,用预冷的裂解缓冲液裂解细胞。离心后取上清液,用BioRad蛋白分析试剂盒测定蛋白浓度。将蛋白质样品在8%~10%的十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)上电泳后转移到硝酸纤维素膜上,用5%的脱脂牛奶封闭。将膜与一抗在4 ℃孵育过夜,然后与二抗反应,用增强型化学发光试剂显影印迹条带,并用BioRad成像系统检测,其中条带信号强度用Quantity One软件进行定量分析。JNK一抗、p38一抗、p27一抗、基质金属蛋白酶-2(MMP-2)一抗、基质金属蛋白酶-9(MMP-9)一抗、基质金属蛋白酶抑制剂-1(TIMP-1)一抗、基质金属蛋白酶抑制剂-2(TIMP-2)一抗均购于美国Abcam公司,稀释浓度1∶1 000,以甘油醛-3-磷酸脱氢酶(GAPDH)为内参。
1.6 免疫组织化学染色
对Ki67、α-平滑肌肌动蛋白(α-Actin)、平滑肌肌球蛋白重链(smMHC)和结蛋白进行免疫组织化学染色,石蜡包埋切片在85 ℃柠檬酸缓冲液中孵育5 min进行抗原修复。经5%正常山羊血清孵育后,用抗Ki67(GB111141,Servicebio)、α平滑肌肌动蛋白(GB111364,Servicebio)、平滑肌肌球蛋白重链(GB11805,Servicebio)的抗体共同孵育。脱氧核糖核苷酸末端转移酶介导的缺口末端标记(TUNEL)法采用末端脱氧核苷酸转移酶(TdT)介导的脱氧尿嘧啶(dUTP)缺口末端标记试剂盒检测主动脉组织TUNEL阳性染色,在显微镜下拍摄图像。
1.7 统计学处理
2 结 果
2.1 大鼠主动脉形态学
血管重塑是高血压重要的结构改变和病理生理改变。对照组大鼠血管腔大小正常,内膜平滑无明显增厚,DTRs组大鼠血管腔面积显著减小,中膜增厚,p38组及JNK组DLEU1介导的血管中膜增厚的效应减轻,中膜/管腔面积比增加。详见图1。

图1 各组大鼠主动脉形态学改变
2.2 各组大鼠肾脏组织学
肾脏组织学检查显示,DTR组大鼠肾组织中可见小动脉增生,血管壁和肾小球增厚。在p38和JNK抑制剂处理下,肾脏小动脉的病理改变有所改善。但各组大鼠的肾小球均无明显损伤。详见图2。

图2 各组大鼠肾脏组织学变化
2.3 DLEU1介导的p38/JNK磷酸化
RT-PCR检测显示,转染过表达DLEU1质粒后,VSMCs中DLEU1的相对表达量显著提高(P<0.05),这表明细胞模型构建成功。Western Blot检测也发现,磷酸化p38(p-p38)和磷酸化JNK(p-JNK)蛋白的表达上调,表明DLEU1有激活VSMCs中p38/JNK通路磷酸化的作用。详见图3、图4。

图3 Western Blot检测DLEU1介导的VSMCs中p-p38/ p-JNK蛋白表达
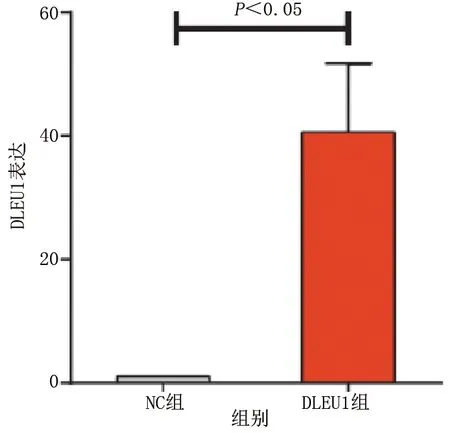
图4 RT-PCR检测VSMCs中DLEU1的相对表达量
2.4 各组细胞增殖率及细胞周期
BrdU实验检测细胞增殖结果发现,DLEU1过表达导致细胞增殖率显著增加,经p38和JNK抑制剂处理后,细胞增殖率均有所下降(P<0.05)。流式细胞仪分析结果显示,随着DLEU1基因的过表达,S期细胞比例从33.12%显著增加到46.16%,G0/G1期细胞比例从65.87%下降到42.40%。p38和JNK抑制剂可显著阻断细胞周期,处理后,G0/G1期细胞比例均有所上升,S期细胞比例无明显变化。详见图5、图6。

图5 各组细胞增殖率比较

图6 流式细胞仪检测各组细胞周期的细胞比例
2.5 Western Blot检测细胞中基质金属蛋白酶相关蛋白表达
Western Blot检测显示,过表达DLEU1可显著提高细胞中MMP-2和MMP-9的蛋白表达水平,阻断p38和JNK可部分消除DLEU1对MMP-2和MMP-9蛋白表达的促进作用。而作为MMP-2和MMP-9抑制剂的TIMP-1和TIMP-2则表现出与MMP-2和MMP-9完全相反的变化。结果表明,DLEU1及其下游信号通路p38和JNK可通过TIMP-1/MMP-9和TIMP-2/MMP-2促进血管平滑肌细胞的重塑和增殖。详见图7。

图7 各组基质金属蛋白酶相关蛋白表达
2.6 p38/JNK在DLEU1介导的VSMCs迁移和表型改变中的作用
Boyden小室迁移实验发现,DLEU1过表达可诱导更多的迁移VSMCs,这表明DLEU1诱导的迁移能力更强。经p38抑制剂和JNK抑制剂干预后,迁移细胞数量有所降低。观察细胞形态发现,NC组VSMCs形态呈纺锤形,DLEU1过表达细胞多为成纤维细胞,经抑制剂处理后细胞形态恢复到对照状态。Western Blot检测显示,骨桥蛋白(OPN)表达水平明显上调,平滑肌22α(SM-22α)蛋白表达显著下调。经p38抑制剂和JNK抑制剂干预后,OPN蛋白表达水平明显降低,SM-22α蛋白表达水平上调。这些结果都表明,p38/JNK在DLEU1介导的VSMC迁移中起着关键作用。详见图8、图9。

图8 各组SM-22α、OPN蛋白表达条带图

图9 Western Blot检测各组SM-22α、OPN蛋白表达
3 讨 论
本研究发现,DLEU1过表达大鼠表现出显著的血管重构特征,表现为血管腔面积显著减小、中膜增厚。DLEU1可促进平滑肌细胞增殖、细胞周期进展、迁移能力提高和VSMC合成表型的改变。此外,本研究还发现p38/JNK的磷酸化是介导DLEU1诱导高血压的关键步骤。根据p38/JNK抑制剂的应用结果,推测DLEU1需要p38/JNK通路介导才能起到促进高血压进展、促进VSMCs增殖、迁移和从收缩表型向合成表型的转变。
高血压的特点是血管功能和结构紊乱。动脉血管壁可分为内膜、中膜和外膜3层,内膜、中膜和外膜含有内皮细胞、血管VSMCs和细胞外基质等多种细胞成分[6]。血管VSMCs是动脉的主要细胞成分,也是血管疾病的关键决定因素。血管VSMCs增殖与血管重塑和高血压密切相关,疾病进展可导致内膜-中层厚度增加,并导致动脉僵硬和血压升高。VSMCs迁移是血管发育过程中的正常过程,也是血管损伤后组织修复的正常过程。然而,病理性迁移是导致血管重塑的主要因素,也是导致广泛内膜增厚的关键[7]。与本研究结果一致,高血压易感基因DLEU1的过表达促进了VSMCs的增殖、迁移和向综合型转化。
本研究探讨了参与该过程的潜在信号通路,发现在DLEU1过表达模型中p38/JNK有明显的磷酸化活性。有研究发现,SB203580对乙酰胆碱诱导的WKY正常大鼠的血压没有影响[8]。由于p38/JNK通路在正常状态下并不能被激活,因此,认为p38/JNK抑制剂对正常大鼠的血压没有影响。p38/JNK的抑制剂可阻断DLEU1诱导的细胞增殖、迁移和表型转化作用。p38/JNK通路的激活是决定VSMCs功能和人类微血管内皮细胞程序性死亡的关键,该通路激活后可通过抑制血小板衍生生长因子受体β、p38和JNK介导的信号,防止血VSMCs的增殖和迁移,抑制新生内膜的形成。主动脉VSMCs周期性机械牵张可引起JNK和p38依赖的细胞死亡,JNK和p38抑制剂可减少细胞死亡,这可能对急性血压升高引起的主动脉夹层有一定的临床价值。
基质金属蛋白酶和金属蛋白酶组织抑制因子已被广泛认为与高血压相关的主动脉和肺动脉基质重塑有关。TIMP-1和TIMP-2分别与基质金属蛋白酶前体-9(pro-MMP-9)和基质金属蛋白酶前体-2(pro-MMP-2)结合,并作为MMP-2和MMP-9的抑制剂[9]。TIMP-1/MMP-9和TIMP-2/MMP-2在不同类型的细胞中与p38和JNK有潜在的相关性。p38信号被证实是MC3T3-E1细胞分泌和激活MMP-2所必需的[10],特异性p38抑制剂SB203580可抑制大鼠肺成纤维细胞MMP-2的表达[11]。非小细胞肺癌细胞中的MMP-2和MMP-9都被认为是p38信号通路的下游效应分子[12]。下调p38MAPK和JNK可降低人肺腺癌细胞MMP-2和MMP-9的表达[13]。研究表明,JNK抑制剂可以降低表皮生长因子介导的HTR-8/SVneo滋养层细胞MMP-9/TIMP-1的比率[14]。本研究发现,p38/JNK参与了DLEU1诱导的高血压VSMCs的增殖、迁移和表型改变。
综上所述,本研究发现,高血压时DLEU1介导的VSMCs增殖和表型改变需要p38/JNK通路介导。这为高血压的遗传学和生物学基础提供了新的见解,并为进一步研究针对DLEU1和p38/JNK的干预策略以对抗高血压提供了实验基础。

