脂蛋白相关lncRNA通过参与炎症反应致冠心病血管损伤的机制研究
刘旭光,陈 晨,吴 斌,胡家芸,项 娜
冠心病是一种缺血性心脏病,在病理学上以动脉粥样硬化为特征,这是一种与炎症密切相关的慢性病理过程[1-2]。目前,有关冠心病的治疗(包括他汀类等药物治疗和冠状动脉旁路移植等非药物治疗)和对危险因素(如吸烟、糖尿病并发症或高血压)的识别取得了一定研究进展,但冠心病仍然是死亡的主要原因[3-4]。因此,寻找包括长链非编码RNA(lncRNA)在内的新型生物标志物对于预防和治疗冠心病具有重要意义。lncRNA是长度>200个核苷酸并广泛分布在细胞核和细胞质中的非编码RNA[5]。研究表明lncRNA在多能性的调节和心脏特异性基因的激活中发挥重要作用[6],lncRNA在调节各种细胞过程方面起着关键作用,如血管内皮细胞(VECs)功能障碍、血管平滑肌细胞(VSMC)增殖和脂质代谢[7-8]。血管内皮细胞重塑被认为是冠心病发病机制的关键[9]。氧化型低密度脂蛋白(ox-LDL)可以通过涉及成纤维细胞生长因子2(FGF2)启动子甲基化和抑制FGF2转录的丙二醛依赖性途径破坏人冠状动脉内皮细胞(HCAEC)的生长和存活[10]。研究表明,lnc-MICALL2-2在冠心病病人中表达升高,其表达升高是冠心病的独立危险因素[11]。然而,lnc-MICALL2-2在冠心病诱导的血管内皮损伤及其特异性分子机制中尚未报道。本研究将ox-LDL诱导的HCAECs作为损伤模型,以探索lnc-MICALL2-2在冠心病发病机制中的生物学作用。本研究中使用HCAECs作为细胞,主要考虑:1)冠状动脉内皮损伤是冠心病发展的早期阶段;2)HCAEC被广泛用作工具细胞以探索氧化损伤,包括由ox-LDL引起的内皮功能障碍[12];3)使用的ox-LDL诱导的HCAECs损伤模型更接近冠心病的病理状况。
1 材料与方法
1.1 HCAECs的培养和鉴定
HCAECs购于Sciencell,被选为血管内皮细胞模型,细胞培养基由Procell生命科学技术有限公司(中国武汉)提供。HCAECs在具有37 ℃、5%CO2的培养基中培养。细胞在单层中生长,并在细胞附着率达到90%时进行常规传代。倒置显微镜(奥林巴斯公司,日本)用于观察细胞形态和生长。
血管性血友病因子(vWF)是血管内皮细胞合成过程中释放的蛋白质因子。vWF参与血液凝固和血栓形成,并作为鉴定体外培养的血管内皮细胞的特征因素。根据标准免疫组织化学染色技术染色HCAECs。用Cy3染料(红色)染色vWF,并用4′,6-二氨基-2-苯基吲哚染料(蓝色)复染细胞核。
1.2 ox-LDL诱导的HCAECs模型构建
ox-LDL在HCAECs功能障碍中起重要作用,并且与动脉粥样硬化性心脏病和冠心病有关。在体外ox-LDL已被用于培养HCAECs,以模拟动脉粥样硬化的形成。ox-LDL(Biotechnology,中国)在磷酸缓冲盐溶液(PBS)中使用Cu2SO4(氧化剂)进行氧化。添加过量的EDTA-Na2终止氧化。在琼脂糖凝胶电泳上分析每个批次的迁移与低密度脂蛋白(LDL)。为了确定ox-LDL诱导HCAECs的合适浓度和暴露时间,将正常对数生长期HCAECs的密度调整为2×105个/mL,在96孔板(3板,每板12孔)中培养。HCAECs与不同浓度的ox-LDL(0、25、50、100 μg/mL)分别孵育24、48、72 h。
1.3 siRNA转染
在转染之前,将HCAECs的接种密度调整为5×105个/mL,将细胞和200 μL无血清Opti-MEM培养基加入6孔板中,加入终浓度为50 nmol/L的siRNA(Gemma Gene,中国上海),将lnc-MICALL2-2靶向siRNA转染到HCAECs中。通过用逆转录实时荧光定量聚合酶链式反应(qRT-PCR)评估lncRNA的表达来证实敲低。用干扰片段转染后,用100 μg/mL的ox-LDL处理细胞,在37 ℃和5%CO2条件下孵育48 h。实验分为对照组、ox-LDL组、NC-shRNA+ox-LDL组、sh-MICALL2-2+ox-LDL组。对照组:未经处理;ox-LDL组:ox-LDL处理HCAECs;NC-shRNA+ox-LDL组:用NC-shRNA处理HCAECs;sh-MICALL2-2+ox-LDL组:用lnc-MICALL2-2处理HCAECs。
1.4 细胞活力测定
使用细胞计数试剂盒(CCK-8)检测细胞活力。细胞置于96孔板上,37 ℃培养过夜,与不同浓度的药物孵育72 h,加入CCK-8 试剂,并将混合物在37 ℃下孵育0.5~4.0 h。使用酶标仪检测450 nm处的吸光度值。与对照相比评价细胞生长速率,并使用GraphPad Prism 7.0软件计算50%抑制浓度(IC)值。
1.5 qRT-PCR检测lncRNA-MICALL2-2水平
使用TRIzol试剂(Invitrogen)分离处理过的HCAECs的总RNA,使用PrimeScript RT试剂盒(中国大连,Takara)获得cDNA。在lightCycler 480Ⅱ(罗氏,美国)上进行qRT-PCR,具有SYBR绿色染料检测(TaKaRa Bio,美国)。所有样品一式3份测定,采用2-ΔΔCt方法对数据进行分析,lncRNA分析中以U6 RNA为参考,以甘油醛-3-磷酸脱氢酶(GAPDH)为mRNA分析的参考。
1.6 酶联免疫吸附实验(ELISA)检测炎症相关因子
在细胞培养过程中收集上清液,离心上清液并转移到干净的试管中,采用ELISA测定法测量上清液中肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-6、IL-10、IL-1β、血管细胞黏附分子-1(VCAM-1)、细胞间黏附分子-1(ICAM-1)和单核细胞趋化蛋白-1(MCP-1)含量,根据试剂盒说明书进行检测。
1.7 荧光原位杂交技术(FISH)检测lncRNA-MICALL2-2在细胞核中的定位
在室温下,用4%多聚甲醛固定细胞20 min,用0.1%二甲苯基硅碳酸水洗涤5 min(2次),在37 ℃下进行蛋白酶K消化20 min,用PBS洗涤5 min(2次),在室温下用1%多聚甲醛固定10 min,再用PBS洗涤5 min(2次)。将样品在-20 ℃下冷冻,并在70%、85%和100%乙醇中脱水5 min,将异硫氰酸荧光素(FITC)探针和探针稀释剂混合成探针杂交混合物,并在73 ℃下在冰上变性8 min。将溶液滴到切片上并在42 ℃下孵育过夜,然后用预热(42 ℃)50%甲酰胺洗涤3次(5 min)。采用二脒基苯基吲哚(DAPI)染色细胞核,并用PBS再次洗涤3次(5 min),然后用荧光显微镜观察。
1.8 蛋白免疫印迹(Western Blot)试验
使用RIPA缓冲液裂解各组HCAECs细胞,获得全细胞提取物,通过NE-PERTM核和细胞质提取试剂盒(ThermoFisher Scientific)分离细胞质和核蛋白,采用BCA Protein Assay试剂盒(Beyotime Biotechnology,China)测定总蛋白浓度。最后通过十二烷基硫酸钠-聚丙烯酰胺凝胶分离蛋白质并转移到聚偏二氟乙烯膜上,将膜与抗体一起孵育并使用增强的化学发光检测系统进行检测。用ImageJ 软件测量定量数据。实验独立重复3次。
1.9 活性氧(ROS)检测
使用二氯荧光素二乙酸酯(DCFH-DA)检测HCAECs中ROS水平。在除去细胞培养基后加入用无血清培养基稀释的DCFH-DA,将细胞在细胞培养箱中孵育30 min,用PBS洗涤细胞,在激光共聚焦显微镜(日本奥林巴斯)观察免疫荧光。
1.10 流式细胞术检测细胞凋亡
采用凋亡测定试剂盒(Beyotime,C1062L)检测HCAECs凋亡率。用PBS洗涤细胞3次,加入膜联蛋白-V和碘化丙啶(PI),细胞在细胞培养箱中孵育40 min,通过流式细胞术测量细胞凋亡率。
1.11 统计学处理
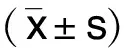
2 结 果
2.1 ox-LDL促进HCAECs炎症反应和血管损伤
体外进行HCAECs实验,大部分培养的细胞均对vWF呈阳性(见图1),表明HCAECs的培养产生了纯度相对较高的血管内皮细胞。CCK-8结果表明HCAECs的细胞活力随着ox-LDL浓度的增加而降低,其中100 μg/mL的ox-LDL作用最显著,与对照组比较差异有统计学意义(P<0.05),详见图2。ELISA检测炎症相关因子(TNF-α、IL-1β、IL-6和IL-10)和黏附因子(VCAM-1、ICAM-1和MCP-1)显示,ox-LDL可明显增加促炎因子IL-1β、TNF-α、IL-1β、IL-6及黏附因子VCAM-1、ICAM-1、MCP-1表达,降低抗炎因子IL-10表达,差异均有统计学意义(P<0.05),详见图3、图4。表明ox-LDL促进了炎症反应和血管损伤。

图1 通过vWF对HCAECs进行纯化鉴定

图2 CCK-8法检测不同浓度ox-LDL刺激HCAECs的细胞活力
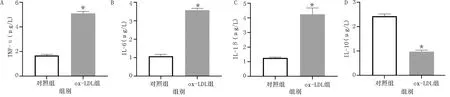
图3 ELISA检测炎症相关因子

图4 ELISA检测细胞黏附因子
2.2 lncRNA-MICALL2-2在HCAECs中的表达差异
FISH结果表明,lncRNA-MICALL2-2主要定位于细胞核中(见图5)。qRT-PCR检测HCAECs细胞中lncRNA-MICALL2-2的含量表明,lncRNA-MICALL2-2在ox-LDL诱导的HCAECs损伤模型中上调,用sh-RNA序列转染HUVECs以敲低lncRNA-MICALL2-2的表达,CCK-8结果表明敲低lncRNA-MICALL2-2后细胞活力增加,差异均有统计学意义(P<0.05),详见图6。表明敲低lncRNA-MICALL2-2降低了ox-LDL诱导的HCAECs中的血管内皮损伤。

图5 通过FISH检测HCAECs中的lncRNA-MICALL2-2定位

图6 各组HCAECs的细胞活力及lncRNA-MICALL2-2表达比较
2.3 敲低lncRNA-MICALL2-2降低ox-LDL诱导的HCAECs血管内皮损伤
Western Blot检测结果表明,ox-LDL组磷酸化内皮型一氧化氮合酶(p-eNOS)和内皮型一氧化氮合酶(eNOS)的蛋白表达水平下降,敲低lncRNA-MICALL2-2后,p-eNOS和eNOS水平升高。ox-LDL组内皮素-1(ET-1)表达升高,敲低lncRNA-MICALL2-2后,ET-1表达被部分抑制,差异均有统计学意义(P<0.05)。详见图7、图8。

图7 Western Blot检测各组eNOS和p-eNOS蛋白表达

图8 Western Blot检测各组ET-1蛋白表达
2.4 敲低lncRNA-MICALL2-2可抑制ox-LDL诱导的HCAECs炎症反应和血管细胞黏附因子上调
在ox-LDL诱导的HCAECs细胞中VCAM-1、ICAM-1、MCP-1、TNF-α、IL-1β和IL-6表达水平升高,IL-10表达水平降低;在敲低lncRNA-MICALL2-2后,HCAECs细胞中VCAM-1、ICAM-1、MCP-1、TNF-α、IL-1β和IL-6表达水平降低,IL-10表达水平升高,差异均有统计学意义(P<0.05)。详见图9、图10。
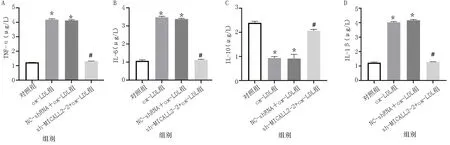
图9 各组炎性因子TNF-α、IL-1β、IL-6、IL-10表达水平比较
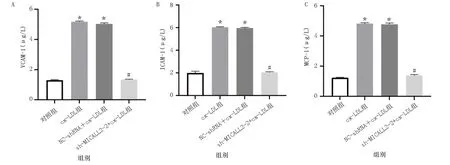
图10 各组VCAM-1、ICAM-1、MCP-1表达水平比较
2.5 敲低lncRNA-MICALL2-2可降低ox-LDL诱导的HCAECs中ROS水平和细胞凋亡率
高水平ROS和细胞凋亡引起的氧化损伤也是细胞损伤的重要指标,因此本研究检测了细胞内ROS水平和细胞凋亡率。结果表明,ox-LDL组和NC-shRNA+ox-LDL组ROS水平明显高于对照组,敲低lncRNA-MICALL2-2后,HUVECs中ROS水平下降。ox-LDL组和NC-shRNA+ox-LDL组细胞凋亡率均高于对照组,敲低lncRNA-MICALL2-2后,降低了ox-LDL诱导的HUVECs细胞凋亡率。此外,本研究检测相关凋亡基因水平,结果显示,ox-LDL组和NC-shRNA+ox-LDL组Bax和Caspase-3蛋白表达水平升高,Bcl-2表达水平降低,敲低lncRNA-MICALL2-2后,Bax和Caspase-3表达水平降低,Bcl-2表达水平升高,差异均有统计学意义(P<0.05)。详见图11~图15。

图11 各组ROS水平比较

图12 各组ROS染色图

图13 流式细胞术检测各组HCAECs凋亡情况

图14 Western Blot检测各组相关凋亡基因Bax、Bcl-2和Caspase-3蛋白表达水平

图15 各组细胞凋亡率比较
2.6 敲低lncRNA-MICALL2-2可抑制ox-LDL诱导的HCAECs血管炎症
ox-LDL组和NC-shRNA+ox-LDL组腺苷单磷酸活化蛋白激酶-α1(AMPKα1)水平下调,敲低lncRNA-MICALL2-2后,HUVEC中AMPKα1升高。当HUAECs受到ox-LDL诱导时,NOX-2表达升高,当敲低lncRNA-MICALL2-2后,NOX-2水平降低,差异均有统计学意义(P<0.05)。详见图16、图17。

图16 各组AMPKα1、NOX-2蛋白表达条带图

图17 Western Blot检测各组HUVECs中AMPKα1和NOX-2蛋白表达
3 讨 论
冠心病仍然是全球住院和死亡的主要原因之一,研究表明,冠心病家族史、吸烟、肥胖、焦虑和抑郁都是冠心病的危险因素。然而外部因素只能部分解释冠心病的病因[13]。研究表明基因组和表观遗传学在冠心病病因学中起着至关重要的作用[14]。本研究显示,lnc-MICALL2-2在ox-LDL诱导的HCAECs中表达升高,并且敲低lnc-MICALL2-2后可减轻ox-LDL诱导的炎症反应和血管损伤。
冠心病是一种慢性炎症性疾病。炎症反应在动脉粥样硬化斑块和斑块破裂的形成和发展中起重要作用,是冠心病的发病机制之一。血管炎症反应涉及白细胞、内皮细胞、血管平滑肌细胞和细胞外基质之间的复杂相互作用[15]。氧化的脂质代谢物可以激活血小板级联反应并引发血栓炎性因子释放。血小板上清除剂受体的ox-LDL结合可导致ROS的产生、巨噬细胞活化和细胞凋亡。此外,血小板活化可以诱导趋化因子,促进炎症和促血栓形成微环境[16]。在体外主要使用ox-LDL建立动脉粥样硬化模型,大量证据表明在ox-LDL低浓度下,可以成功诱导前动脉粥样硬化性HCAECs功能障碍、死亡和病理性新生血管形成[17]。ox-LDL损伤参与冠心病发生与进展,研究表明,血清ox-LDL为早期冠心病的危险因素[18]。本研究进一步发现,体外敲低lnc-MICALL2-2的表达减弱了ox-LDL引起的血管内皮细胞损伤,为新型表观遗传靶点在ox-LDL介导的冠心病病因中的作用提供了初步证据。
血管内皮细胞功能障碍被认为是冠心病的早期病理过程[19]。研究表明,用不同浓度的ox-LDL(30~200 μg/mL)诱导可引起HCAECs的炎症损伤并产生动脉粥样硬化表型,伴有相关炎性因子的表达水平增加,如IL-6、IL-1β和TNF-α[20]。研究表明,lncRNA可以直接参与血管内皮细胞的分化和增殖或影响参与免疫调节的血管内皮细胞[21]。在本研究中,与正常培养的细胞相比,抑制lnc-MICALL2-2显著提高了细胞活力,而且减弱了ox-LDL诱导的冠心病的细胞增殖,降低了炎性因子(TNF-α、IL-1β和IL-6)的表达。
一氧化氮(NO)可以维持血管的正常收缩和松弛,NO主要由eNOS合成。本研究结果显示,ox-LDL组eNOS和p-eNOS表达水平下降,在敲低lnc-MICALL2-2后,eNOS和p-eNOS表达水平升高。表明ox-LDL可诱发NO释放障碍以及eNOS和p-eNOS的表达,从而导致血管内皮细胞损伤。此外,ET-1的异常表达被认为与各种心血管疾病的发展和进展有关[22]。本研究中ox-LDL组ET-1表达增加,敲低lncRNA后,ET-1水平下降。表明lnc-MICALL2-2敲低后抑制ET-1水平并保护血管内皮细胞。VCAM-1存在于内皮细胞表面,在动脉粥样硬化中起重要作用[23]。ICAM-1也是一种内皮细胞黏附分子,在动脉粥样硬化组织中增加[24]。本研究中VCAM-1、ICAM-1和MCP-1水平在ox-LDL的诱导下升高,敲低lnc-MICALL2-2部分抑制内皮因子的增加。ROS水平和凋亡率也是血管内皮细胞损伤的重要指标。研究显示,高水平的ROS和凋亡率可诱发血管内皮细胞功能障碍,同时,ROS和细胞凋亡也是血管内皮细胞损伤过程中的重要因素[25-26]。本研究ROS水平和细胞凋亡率是由ox-LDL诱导的,在敲低lnc-MICALL2-2后,ROS水平及细胞凋亡率降低。研究表明,体内AMPKα1蛋白表达的降低导致NOX-2蛋白表达的增加,这些蛋白质的变化导致内皮功能障碍和血管内皮炎症[27]。本研究结果显示,敲低lnc-MICALL2-2增强AMPKα1的蛋白表达并抑制NOX-2蛋白表达水平。
综上所述,lnc-MICALL2-2在冠心病中表达升高,敲低lnc-MICALL2-2后可改善ox-LDL诱导的炎症反应,保护血管内皮细胞损伤。本研究表明lnc-MICALL2-2可能在冠心病中发挥作用,可能是治疗冠心病诱发血管内皮细胞损伤的新靶点。

