菊花“帅旗”组织培养技术研究
吉佩佩
摘 要:以带芽的菊花“帅旗”茎段为外植体,在附加不同浓度植物生长调节剂2,4-D、6-BA和IBA的MS基本培养基上诱导培养,通过器官直接发生途径获得再生植株。结果表明:菊花“帅旗”茎段外植体在无菌条件下用75%酒精消毒30 s,再用0.1%的升汞消毒9 min的污染率最低;茎段在添加不同生长调节剂配比的培养基中再生不定芽的能力不同;丛生芽诱导的最佳培养基为MS+6-BA 0.3 mg/L+2,4-D 0.3 mg/L+IBA 0.1 mg/L;最佳生根培养基为1/2 MS+2,4-D 3.00 mg/L+IBA 0.60 mg/L。
关键词:“帅旗”;外植体;再生体系;组织培养
文章編号:1005-2690(2023)18-0004-03 中国图书分类号:S567.239 文献标志码:B
菊花为多年生菊科草本植物,品种已达千余种。菊花在中国已有三千多年的栽培历史,是世界上极为普遍的鲜切花之一,也是中国十大名花之一。菊花喜凉爽,植株较耐寒,枝叶耐轻霜,花朵忌霜冻,生长适温18~21 ℃,花期在9—12月。地下根茎耐旱,最忌积涝,喜地势高、土层深厚、富含腐殖质、疏松肥沃、排水良好的壤土。在微酸性至微碱性土壤中皆能生长,以pH值6.2~6.7为宜。短日照植物。菊属有30余种,中国原产17种,主要有野菊、毛华菊、甘菊、小红菊、紫花野菊、菊花脑等。“帅旗”是菊花的一个品种,为我国五大名菊之首,单瓣宽带型,瓣宽可达7 cm,花瓣最多达26瓣,正面紫红色,背面金黄色,犹如古代军事统帅的一面旗帜。花色丰富,观赏性好,是菊花在园林中适于陆地栽培的一个品种群,极具应用前景的优良园林地被植物。
菊花无性繁殖的方法主要有扦插、分株、嫁接等,长期以来植株感染病毒严重,目前侵袭菊花的病毒有10余种。植株病情随种植时间的延长而逐渐恶化,导致繁殖速度慢,生长势偏弱,并有退化现象,无法满足市场需求,甚至有些优良品种因此灭绝。人们积极探索植物病毒病的防治方法,随着现代生物技术的发展,人们发现植物的顶端分生组织不受病毒感染,因而采用茎尖培养可望得到无病毒的材料,其中马铃薯茎尖培养、甘薯茎尖培养等是最成功的例子[1-2]。
植物组织培养是指从植物体中取出组织器官,然后模拟机体的生理条件在体外进行培养使之生存,形成组织成长成植株的技术过程。组织培养具有增殖效率高、繁殖速度快的特点,可以用较短的时间和较少的空间生产出大量的试管苗。
在菊花育种过程中应用生物技术,可打破种间杂交的障碍,扩展遗传物质交流的范围,为种质创新提供更有利的措施,使品种改良方法现代化和高效化。无论细胞工程还是基因工程,均需建立良好的受体系统和高效的再生体系。菊花的茎尖、茎段、叶片、花瓣、花托、花萼、雌雄蕊、花蕾及子房都可以实现植株的再生。
文章研究了菊花“帅旗”在组织培养过程中升汞消毒的最适时间[3]、不同种类和浓度的植物激素配比组合对茎段快繁的影响,试图找出“帅旗”快繁的最佳消毒时间和最适培养基配方,为完善“帅旗”的组培快繁技术和菊花基因工程育种、大规模工厂化生产“帅旗”品种奠定必要的基础。
1 材料和方法
1.1 试验材料
菊花“帅旗”购于开封市丰禾农业有限公司。整个花体色泽明快,花瓣面为大红色,背浅泥金黄或老黄色。平瓣,瓣宽4~6 cm,平展,瓣端圆阔或略尖。花瓣上有深浅条沟、凹沟。生长势中,花易侧头。
1.2 试验方法
以MS为基本培养基,蔗糖30 g/L、琼脂6.5 g/L,pH值调节为5.8,附加不同浓度的激素2,4-D、6-BA和IBA,培养基在121 ℃的高温下灭菌20 min。诱导芽分化后,进行继代培养,增殖量达到一定程度后,把丛生芽切下转入到MS+6-BA 0.30 mg/L+2,4-D 0.30 mg/L的培养基上,使其生长。待苗高3~4 cm时切下小苗,转移到1/2 MS+2,4-D 3.00 mg/L+IBA 0.60 mg/L的生根培养基上,使其生长成植株。
培养室温度为(25±1)℃,每日光照16 h,黑暗8 h,在培养架上进行培养。经1~2个月培养,可诱导成苗。培养基和接种过程中所需的各种器皿、器具均放入高压锅内消毒、灭菌,待自然冷却后取出,放入接种室备用。
1.3 试验方案设计
1.3.1 筛选消毒时间
众多研究学者认为,不同的消毒剂处理外植体的消毒效果不同。顾昌华和郑利锋(2006)[4]认为,茎段外植体适宜的消毒方式为2.0%次氯酸钠+0.1%升汞5 min。季昆等(2008)[5]认为,70%酒精10 s+0.1%升汞8 min处理茎段外植体具有较好的消毒效果。在本试验设计中,采用75%酒精消毒30 s和0.1%升汞处理茎段外植体9 min,并观察、记录、统计数据。
试验操作流程:从盆栽的植株上选取健壮的当年生枝条,用饱满而未萌发的枝条中段侧芽作为外植体。枝条去叶,切成2~3 cm小段,每段至少带有1个侧芽。清水洗净枝条小段,再用滤纸吸干。无菌条件下,用75%酒精消毒30 s,使消毒剂渗入并均匀到达每一处且有效杀死微生物病菌,再用0.1%升汞分别进行3、5、7、9、11、13、15 min的7组消毒处理。考虑到残留的汞离子对植物体的伤害,最后用无菌水冲洗茎段3~4遍,茎段消毒后,将剪口与药剂接触的部分切去,减轻药剂对植物组织的伤害,提高初代培养的成活率。在超净工作台上将其接种于不同的芽分化培养基上,每一处理接种6瓶,每瓶3个外植体(呈△排列接种),研究不同消毒时间对“帅旗”茎段的消毒效果,7 d后统计污染数和存活数。
本次试验设计中,用0.1%升汞分别进行7组不同消毒时间处理,经初代培养后的统计结果见表1。
1.3.2 诱导侧芽分化培养基
培养基中生长素和细胞分裂素的比率正确与否是决定生芽和生根的关键。提高细胞分裂素浓度,有利于芽的形成;提高生长素浓度,有利于根的形成;二者处于一定平衡质量浓度时则有利于愈伤组织的形成。由此可见,对某一品种菊花进行组培时,选用什么样的激素种类和配比,较难有一个固定模式,除参照前人经验外,最好的办法还是先进行小规模试验,选出适宜的激素组合再扩大生产。
本试验以6-BA、2,4-D和IBA为3个变化因素,6-BA分别采用0.20、0.30、0.40 mg/L 3个水平,2,4-D分别采用0.10、0.20、0.30 mg/L 3个水平,IBA分别采用0.10、0.30、0.50 mg/L 3个水平,试验中选取有代表性的9种不同配方的培养基进行培养和数据统计。每一处理接种6瓶,每瓶3个外植体(呈△排列接种)。
1.3.3 诱导生根培养基
不同培养基对根的诱导效果不一样。王佐芝等(1993)[6]认为,IBA对根诱导效果好于2,4-D;王丽娟等(2002)[7]认为,在生根培养阶段,一些菊花品种诱导生根时不加生长素,但对大多数菊花而言加入适量的生长素效果会更好,从生根的天数和生根的质量看,IBA较2,4-D好;叶小曲等(1999)[8]认为,菊花生根培养比较容易,采用不同IBA浓度诱导生根率都为100%,但以0.5 mg/L最好。本试验中,生根培养基的基本成分为1/2 MS,然后向其中加入2种激素,分别是2,4-D和IBA。2,4-D采用3个水平,分别是1.00、2.00、3.00 mg/L;IBA采用3个水平,分别是0.10、0.30、0.60 mg/L。每一处理接种6瓶,每瓶3个外植体(呈△排列接种)。
1.4 试管苗的移栽
在生根培养基中无菌苗迅速生长,植株逐渐健壮,其根系生长尤为迅速。在多数根系长达1.0 cm时,其根尖仍保持旺盛生长状态,此时即可进入过渡栽培阶段。组培过程中,试管苗移栽是一个关键环节。试管苗在试管中不论生长多好,若不能成功移栽,就会导致前功尽弃[9-10]。
试验中,当试管苗有3~5片叶、4~6条根时即可移栽。移栽前先炼苗,将培养瓶拿出培养室,打开瓶盖,常温下置于较强散射光中炼苗3 d,接着向瓶中加入少量温水,软化培养基后取出试管苗,再用清水洗净粘附在根系上的琼脂,最后移栽入蛭石、珍珠岩、泥炭已混合(体积比为1∶1∶1)消毒的培养基中。
基质用水淋透,然后用透明塑料薄膜覆盖,保湿约7 d后打开薄膜,每隔2 d用喷雾器喷水1次,保证基质潮湿适度。待小苗长至10 cm左右时,移植到田间定植。移栽时避免伤根,栽后及时浇水,移栽成活率可达98%以上,同时加强水肥管理,促进植株迅速生长。
2 结果与分析
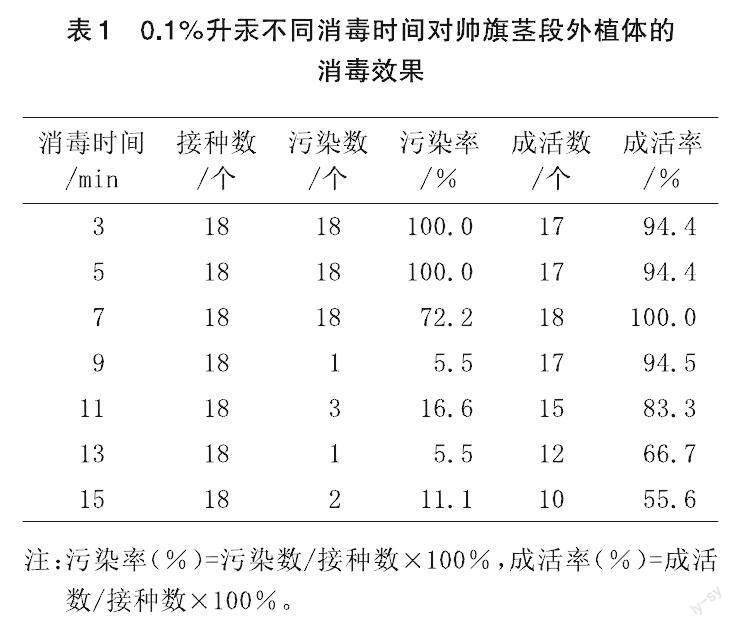
2.1 对茎段存活率和污染率的最适消毒时间的探求
从表1可知,消毒时间在3、5 min时,污染率达到100%,但成活率高达94.4%;消毒时间在13、15 min时,污染率低至5.5%,但成活率也低至55.6%;消毒时间9 min时,污染率低至5.5%,成活率可高达94.5%。由此推断出,消毒处理时间过短,消毒不彻底,茎段接种后易感染;时间过长,茎段虽未被染菌污染,但逐渐枯萎死亡,成活率低。通过比较可以得出,0.1%升汞处理帅旗茎段9 min杀菌效果较好。
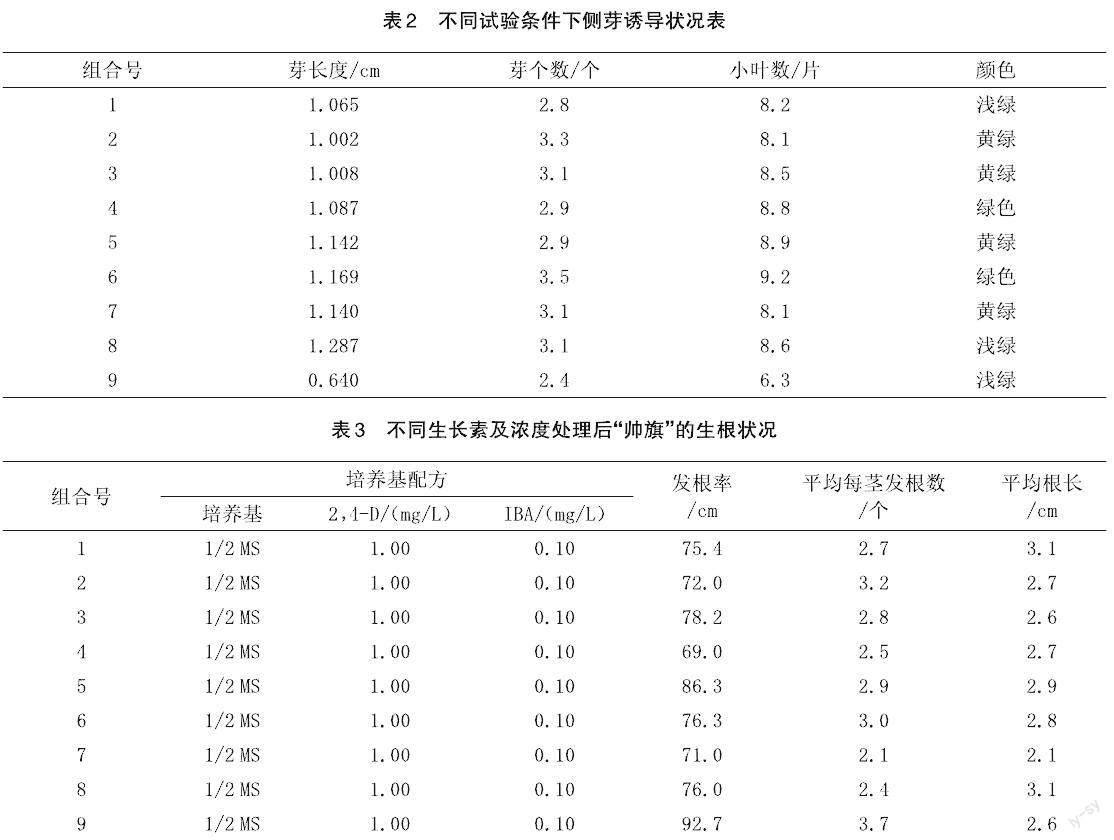
2.2 对“帅旗”侧芽诱导的最适激素组合的探求
由表2可知,芽长度较好的是组合8(1.287 cm)和组合6(1.169 cm),芽个数较好的是组合2(3.3个)和组合6(3.5个),小叶数较好的是组合5(8.9片)和组合6(9.2片),芽颜色较好的是组合4和组合6(绿色)。最有利于帅旗侧芽诱导的激素组合及浓度为组合6,即6-BA 0.3 mg/L+2,4-D 0.3 mg/L+IBA 0.1 mg/L。
2.3 对“帅旗”生根诱导的最适激素组合的探求
由表3可知,发根率较好的是组合5(86.3%)和组合9(92.7%),平均每茎发根数较好的是组合2(3.2)和组合9(3.7),对“帅旗”发根率、平均每茎发根数、平均根长诱导效果最好的是组合9,即激素组合1/2 MS+2,4-D 3.00 mg/L+IBA 0.60 mg/L。
3 结论
3.1 对茎段存活率和污染率的最适消毒时间
本试验中,用75%酒精消毒30 s,再用0.1%升汞分别进行3、5、7、9、11、13、15 min消毒处理,进行原代培养。
通过分析表3可知,用75%酒精30 s+0.1%升汞9 min处理茎段外植体的杀菌效果较为理想,成活率可达94.5%,污染率降低至5.5%[11]。
3.2 对“帅旗”侧芽诱导的最适激素组合
本试验中,以6-BA、2,4-D和IBA为3个变化因素,6-BA采用3个水平,分别是0.2、0.3、0.4 mg/L,2,4-D采用3个水平,分别是0.1、0.2、0.3 mg/L,IBA采用3个水平,分别是0.1、0.3、0.5 mg/L,最有利于“帅旗”侧芽诱导的激素组合及浓度为组合6,即6-BA 0.3 mg/L+2,4-D 0.3 mg/L+IBA 0.1 mg/L。
3.3 对“帅旗”生根诱导的最适激素组合
本试验中生根培养基的基本成分为1/2 MS,向其中分别加入2,4-D和IBA两种激素诱导生根。经研究选出2,4-D 3.00 mg/L+IBA 0.60 mg/L为最佳生根组合,生根率可达92.7%。
参考文献:
[1]王康才,张雪琼.杭菊花茎尖组织培养初探[J].药用植物栽培,2000,23(3):125.
[2]焦德志,李波,魏明丽,等.菊花的快速繁殖[J].北方园艺,2007(6):208-210.
[3]童朝阳.菊花组织培养和快速繁殖[J].芜湖职业技术学院学报,2001,3(1):28.
[4]顾昌华,郑利锋.世界名菊——墨菊花的组织培养与快速繁殖技术[J].种子,2006,25(6):93-95.
[5]季昆,武宇坤,赵景峰,等.绣球绣线菊组培快繁体系的建立[J].南方农业,2008,2(1):15-18.
[6]王佐芝,李鸿俊,赵满萍.几种名贵菊花的组织培养与快速繁殖[J].运城高专学报,1993(4):55-57.
[7]王丽娟,沈默,吴绛云,等.名种菊花快速繁殖技术[J].北方园艺,2002(3):61.
[8]叶小曲,沈效东,张新宁,等.植物激素对菊花试管苗快速繁殖的影响宁夏[J].农林科技,1999(3):30-33.
[9]柳建军,于洪欣.菊花外植体分化诱导及植株再生的初步研究[J].山东农业科学,1994(5):37-38.
[10]刘麗君,谷迎春,邵雪.切花菊组织培养及移栽[J].农业科技通讯,1988(11):17.
[11]张燕,王志勇.菊花组织培养技术研究进展[J].廊坊师范学院学报(自然科学版),2015,15(4):80-85.
(编辑:郭志阳)

