质量提取法对注射用头孢他啶包装系统的密封完整性研究
郭燕燕,张莞英,邱怡婷,任锟,王晓兰,江燕,蒲小聪
质量提取法对注射用头孢他啶包装系统的密封完整性研究
郭燕燕,张莞英,邱怡婷,任锟,王晓兰,江燕*,蒲小聪*
(四川省药品检验研究院,成都 611731)
建立一套完整的质量提取方法,对注射用头孢他啶(规格为15 mL,1.0 g)的包装系统的密封完整性进行研究。通过对阴性对照样品、阴性样品以及阳性样品进行测试,进而优化试验参数,完成系统适用性、检出限以及质量提取法的方法学确认,并对在加速条件下存放的0月、3月、6月的6批样品进行测试。加速条件:温度为(40±2)℃,相对湿度为(75±5)%。该方法的检测限为2 μm,检测灵敏便捷,本品的密封完整性符合要求。质量提取方法可用于顶空无菌包装系统的注射用头孢他啶的密封性研究。
质量提取法;注射用头孢他啶;密封完整性;顶空无菌包装系统
头孢他啶是第三代头孢菌素类抗生素,是目前对绿脓杆菌作用最强的抗菌药物[1],并且能抑制转肽酶在细胞壁合成的最后一步交叉连接中的转肽作用,使交叉连接不能形成,从而影响细胞壁合成,导致细菌溶菌死亡[2-4]。在溶解含有碳酸钠的注射用头孢他啶时会释放出二氧化碳气体,因而产生正压力,为方便使用,一般会经过减压处理。另外,如果在运输过程中发生泄漏,导致空气中的水分进入,会与药品中的辅料碳酸钠发生反应,生成碳酸氢钠,从而影响药效。因此保证包装系统密封完整性尤其重要。
包装系统密封性(Package Integrity),又称容器密封完整性(Container-Closure Integrity),指包装系统防止内容物损失、微生物侵入以及气体(氧气、空气、水蒸气等)或其他物质进入,保证药品持续符合安全与质量要求的能力[5-7]。注射制剂包装系统的泄漏包括微生物入侵、药品逸出或外部液体/固体侵入以及顶空气体含量改变。包装容器良好的密封性是对药品保护的重要体现之一[8-19]。尤其是注射制剂药品,以注射的方式直接进入人体的组织结构,对密封性的要求会更加严格。本试验方法是将包装封闭在真空试验箱中,通过在真空状态下测量从包装中提取的质量流失来检测包装泄漏。试验系统是一个封闭系统,该封闭系统包括真空泵、真空贮罐、智能分子流量传感器(IMFS)和真空试验腔体。从被测试包装中提取到真空测试室的质量通过IMFS流到真空贮罐,以使系统压力平衡。从真空室到真空贮罐的质量流量由IMFS测量。基于质量守恒定律,进入封闭系统的质量等于测试包装的质量损失。测试系统能够根据要求产生定量(可变数据)的数值,并可根据上述方法开发的临界阈值差判定产生定性(通过/失败)结果。该方法准确可靠且可进行定性定量测试。
1 试验
1.1 仪器
主要仪器:ATC ME2密封性检漏仪(质量提取法),Advanced Test。
1.2 样品信息
1.2.1 试验样品及药品包装材料
试验样品及药品包装材料:注射用头孢他啶,规格为15 mL、1.0 g,共6批,以下标注为1、2、3、4、5、6;中硼硅玻璃管制注射剂瓶,规格为15 mL;注射用无菌粉末用卤化丁基橡胶塞(溴化),规格为20-B2;抗生素用铝塑组合盖,规格为20 mm,颜色为绿色。以上样品均由厂家提供。
1.2.2 阴性对照样品
与试验样品包装系统外尺寸一致的铝制实心模具,尺寸按照由厂家提供的实际样品定制,作为阴性对照。
1.2.3 阴性样品
将注射用头孢他啶的检测样品与阴性对照样品进行泄漏率(μg/min)对比,将与阴性对照结果相近的样品作为阴性样品。
1.2.4 阳性对照样品
1)2 μm阳性对照:阴性对照样品+2 μm阳性标准漏孔。
2)在中硼硅玻璃管制注射剂瓶身上采用激光打孔的方法,制造标准规格漏孔的阳性瓶,并对孔径进行校准。分别制备标称2、5、8 μm 3个阳性对照样品。
1.2.5 大漏样品
大漏阳性样品A:剪去胶塞约1/6扇形面积后进行压盖的空包装系统。
大漏阳性样品B:压盖后插入内径0.9 mm中空针头的空包装系统。
大漏阳性样品C:紧贴管制注射剂瓶颈内侧放入金属丝后进行压盖的空包装系统。
2 方法参数的设定
2.1 方法时间参数开发
为保证实验结果的准确性,需对质量提取法中的测试周期进行设置。循环系统1和循环系统2用于检测大泄漏量的样品,通过对阴性样品以及阴性对照样品进行反复测试,设置循环系统1测试时间为3 s;循环系统2测试时间为4 s;循环系统3用于控制泄漏检测的本底流量噪声清除,设置其时间为15 s;循环系统4用于控制检测出高于2 μm漏孔的微漏检测阶段,设置其时间为7 s。
2.2 临界阈值限值的确认
针对阴性样品测试不少于90次;测试时间为3 d;每天测试3次,每次测试10瓶,测试间隔不少于1 h。计算平均值和中间精密度的标准偏差(1)。
进行2 μm阳性对照(阴性样品+2 μm标准漏孔),测试不少于90次;测试时间为3 d;每天测试3次,每次测试10瓶,测试间隔不少于1 h。计算最终流量平均值和中间精密度的标准偏差(2)。临界阈值的确认见表1。
表1 临界阈值的确定
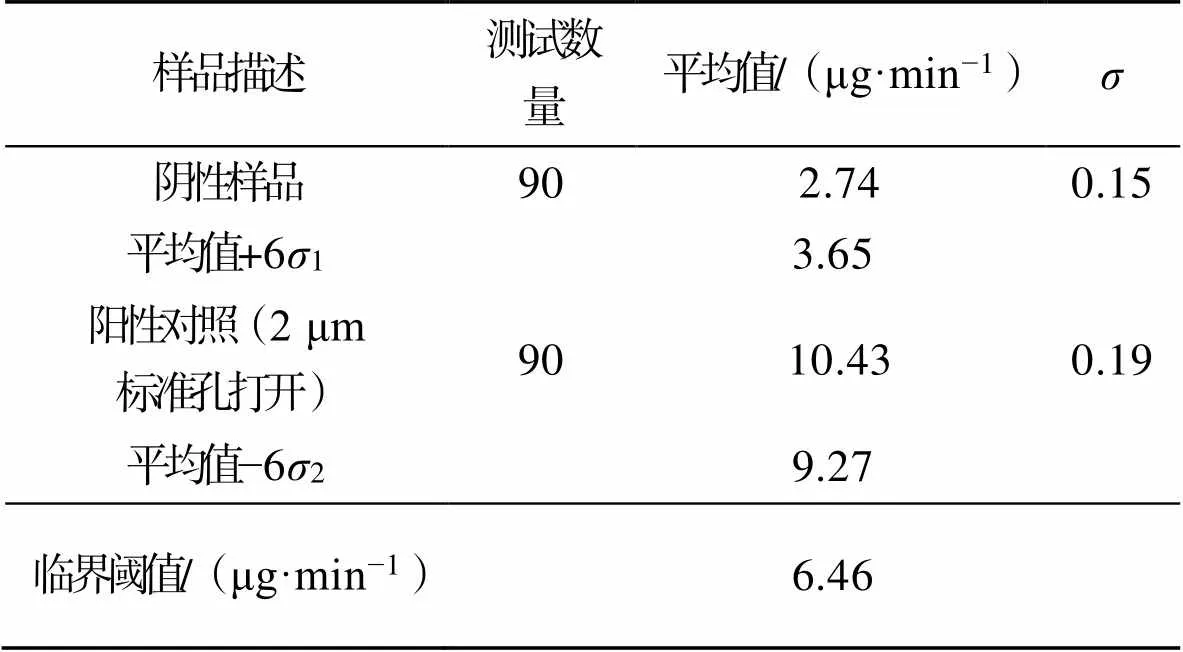
Tab.1 Determination of critical threshold
临界阈值的计算见式(1)。
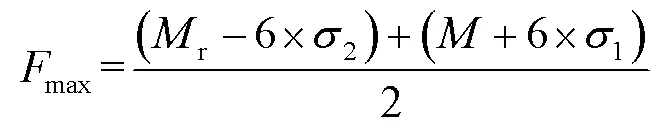
式中:1为阴性样品中间精密度标准偏差;2为阳性对照中间精密度标准偏差;max为临界阈值,μg/min;r为2 μm阳性对照平均值,μg/min;为阴性样品平均值,μg/min。
2.3 大泄漏流量限值的确认
取临界阈值确认试验中3 d阴性样品最大泄漏量的数值。大泄漏流量的确认见表2。
表2 大泄漏流量的确定

Tab.2 Determination of large leakage flow
大泄漏流量限值计算见式(2)。
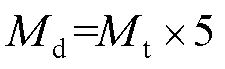
式中:d为大泄漏流量限值,μg/min;t为阴性样品大泄漏流量均值,μg/min。
2.4 测试压力最大值限值的确认
将测试压力最大值设定为1.000,用阴性对照运行5次测试,阴性样品运行5次测试,用测试腔体空腔体和原包装系统使用的中硼硅管制注射剂瓶空瓶运行各5次测试。经测定测试压力的最大值限制为434.63 Pa,测试数据见表3。
测试压力的最大值计算见式(3)。

式中:max为测试压力最大值,Pa;ave为1和2平均值;ave为1和2平均值;1为阴性对照测试压力;2为阴性样品测试压力;1为空腔体测试压力;2为包装系统使用的中硼硅管制注射剂瓶空瓶样品的测试压力。
3 方法验证
3.1 系统适应性确认
阴性对照测试3瓶/次,测试结果应为通过“Pass”;打开验证阀,进行2 μm标准漏孔泄漏挑战,测试3瓶/次,测试结果应为失败“Fail”。试验结果见表4。
3.2 检出限的确认
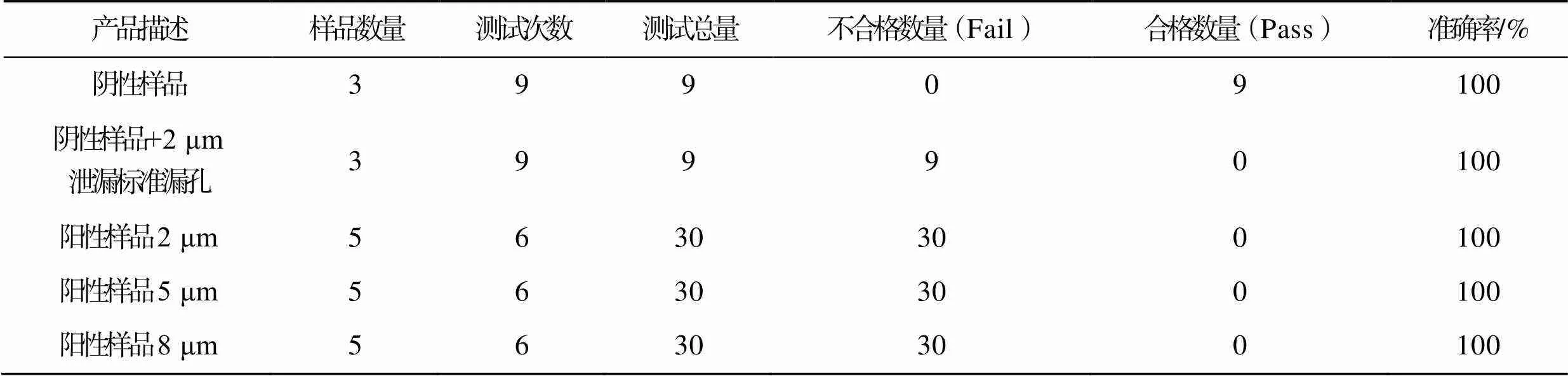
首先对已知完好的阴性样品随机测试9瓶样品,测试结果应为通过“Pass”;随机测试3组,每组3瓶,总计9次测试结果。然后打开2 μm标准漏孔验证阀,对已知完好的阴性样品随机测试9瓶样品,进行2 μm标准漏孔泄漏挑战测试,测试结果应为失败“Fail”;每次随机测试3瓶样品,测试3组,总计9次测试结果。最后取阳性样品泄漏挑战各5瓶(3个标准尺寸分别为2 μm±1 μm、5 μm±1 μm和8 μm±1 μm的孔径泄漏的阳性样品),每瓶阳性样品测试3组,每组每瓶连续测试2次,总计30次。测试结果见表5。
3.3 大漏样品泄漏挑战
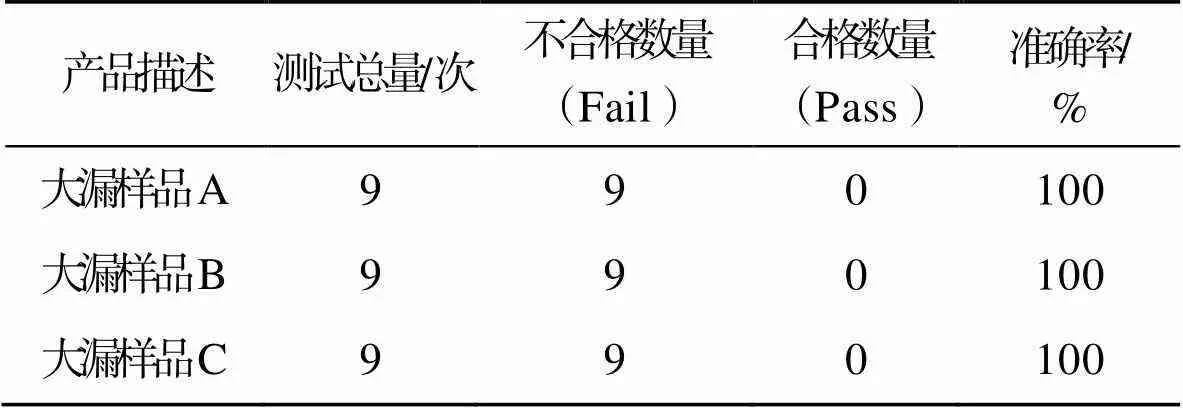
大漏样品泄漏挑战(型式缺陷),对1.2.5节下的大漏样品A、B、C进行测试,每瓶各测试3组,每组3次,计各9次结果。试验结果见表6。
表3 测试压力最大值试验结果
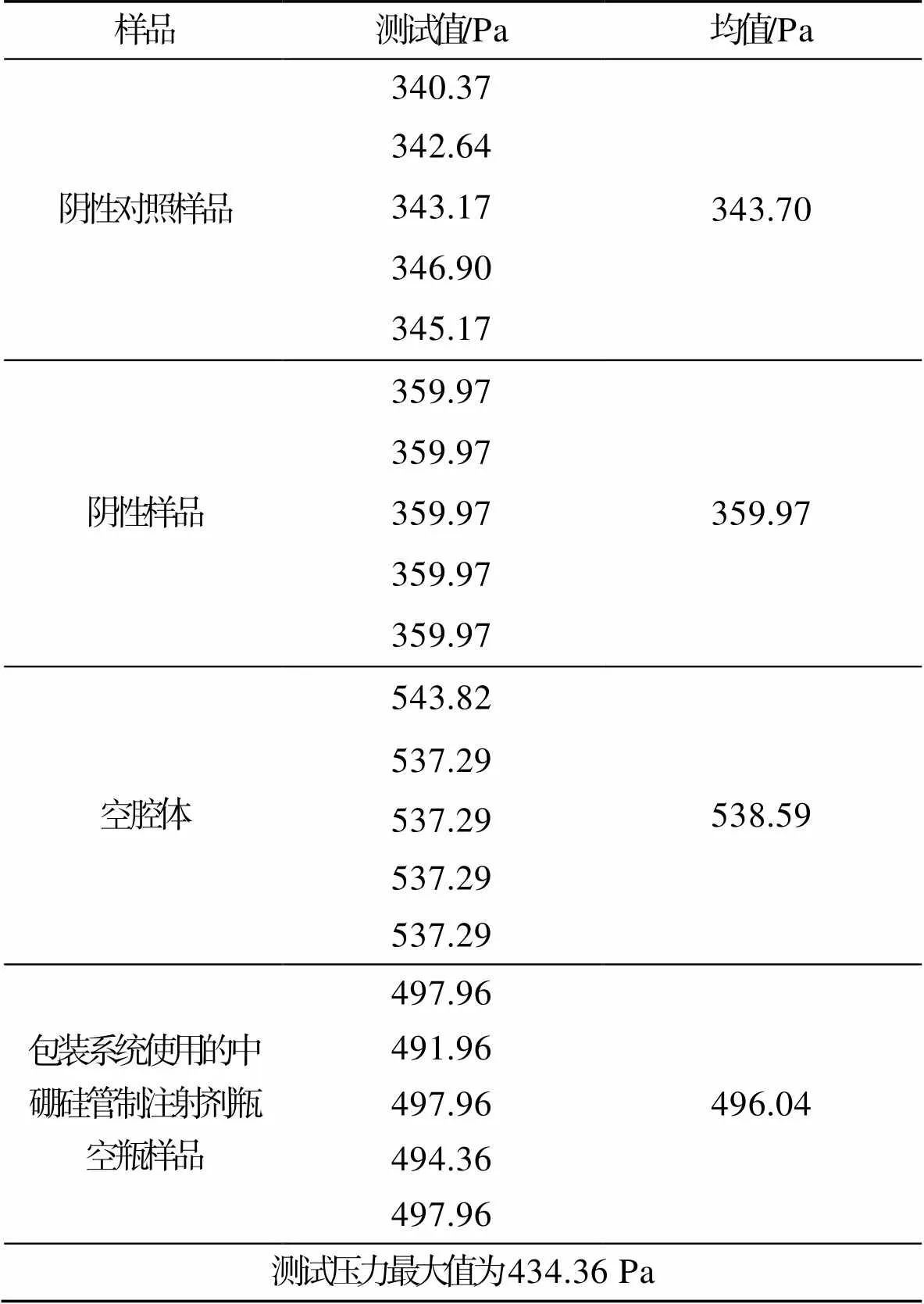
Tab.3 Test results of maximum test pressure
表4 系统适用性试验结果
表5 检出限确认
Tab.5 Detection limit confirmation
表6 大漏样品检测范围确认
Tab.6 Detection range confirmation of sample with large leakage
3.4 方法验证小结
系统适用性验证中阴性对照及2 μm标准孔径阳性对照的检测准确率均为100%,表明系统适用性符合要求。检测限确认中阴性样品、2 μm标准孔径阳性对照,以及2 μm、5 μm和8 μm阳性样品检测准确率均为100%;大漏样品检测准确率为100%。故针对本次试验样品,质量提取法可有效检出2 μm及以上漏孔的泄漏。
4 样品测定
在温度为(40±2)℃、相对湿度为(75±5)%的加速条件下,对存放了0月、3月和6月的注射用头孢他啶样品进行测试,试验结果见表7。
本试验对注射用头孢他啶产品进行包装系统密封完整性验证。对在加速条件下存放的0月、3月、6月的6批样品进行测试,加速条件为温度(40±2)℃、相对湿度(75±5)%。试验结果表明,6批药品包装系统均无2 μm及以上泄漏,说明生产过程中包装工艺稳定可靠,产品密封性能良好。
5 试验结果小结
本试验所采用的质量提取法为《化学药品注射剂包装系统密封性研究技术指南(试行)》推荐的确定性方法,验证了2、5、8 μm阳性对照(激光打孔样品)的检验准确性,并对1个药品规格的6批样品在0月、3月、6月加速储存时间点进行了抽样检测,其产品合格率为100%,试验结果表明,6批药品均无2 μm及以上泄漏,说明生产过程中包装工艺稳定可靠,产品密封性能良好。
在测试过程中发现,由于质量提取法的检测限较低,而对试验结果的影响因素众多,如果药品包装系统外表面带有标签,标签胶水层可能含有少量的水分,对测试结果会有较大的影响,甚至导致假阳性结果,因此建议在测试之前去除外包装标签。另外,本次试验的阳性对照样品为激光打孔,对于测试易堵塞的阳性微孔的黏性药液,该方法不适用。
表7 样品试验结果

Tab.7 Sample test results
6 结语
本研究采用了质量提取法对注射用头孢他啶药品包装系统进行了密封完整性验证。该方法的检测限为2 μm,符合《化学药品注射剂包装系统密封性研究技术指南(试行)》中3级要求,该方法的检测限度高于微生物挑战法(4级),且耗时更短。另外,该检测过程为无损检测,这对昂贵且样本量较小的样本尤为重要。综上所述,文中方法的检测灵敏度高,且方法简单有效、操作方便,可建议作为企业在商业生产中密封性抽样检测放行方法。
[1] 邹文博, 冯艳春, 胡昌勤. 注射用头孢他啶中头孢他啶、水分和精氨酸近红外定量模型的更新[J]. 光谱学与光谱分析, 2014, 34(10): 2617-2622.
ZOU Wen-bo, FENG Yan-chun, HU Chang-qin. Update of Near-Infrared Models for Testing Ceftazidime, Water and Arginine in Ceftazidime for Injection[J]. Spectroscopy and Spectral Analysis, 2014, 34(10): 2617-2622.
[2] 陈莉, 钱啸, 朱乃军. 拉曼光谱法快速测定注射用头孢他啶溶液的含量[J]. 中国药事, 2015(8): 874-878.
CHEN Li, QIAN Xiao, ZHU Nai-jun. Rapid Determination of Ceftazidime Solution for Injection by Raman Spectroscopy[J]. Chinese Pharmaceutical Affairs, 2015(8): 874-878.
[3] 李进, 姚尚辰, 尹利辉, 等. 注射用头孢他啶阿维巴坦钠的聚合物杂质分析[J]. 中国新药杂志, 2021, 30(12): 1117-1125.
LI Jin, YAO Shang-chen, YIN Li-hui, et al. Analysis of Polymer Impurities in Ceftazidime Averbatan Sodium for Injection[J]. Chinese Journal of New Drugs, 2021, 30(12): 1117-1125.
[4] 肖燕, 龚浩, 易秋艳, 等. 注射用头孢他啶中吡啶的检测方法研究[J]. 现代医药卫生, 2015, 31(12): 1773-1776.
XIAO Yan, GONG Hao, YI Qiu-yan, et al. Study of Pyridine Detection Method in Ceftazidime for Injection[J]. Journal of Modern Medicine & Health, 2015, 31(12): 1773-1776.
[5] USP, Package Integrity Testing in the Product Life Cycle-Test Method Selection and Validation <1207. 1>[S]. 2016.
[6] USP, Package Integrity Leak Test Technologies <1207. 2> S].
[7] USP, Package Seal Quality Test Technologies <1207. 3>[S].
[8] 骆鸿谈, 张才贤, 冯凤桃. 真空衰减法应用于顶空无菌药品包装密封性检测[J]. 海峡药学, 2022, 34(5): 74-76.
LUO Hong-tan, ZHANG Cai-xian, FENG Feng-tao. Studies on Tightness of Sterile Drug Packaging with Headspace Gas by Vacuum Decay Method[J]. Strait Pharmaceutical Journal, 2022, 34(5): 74-76.
[9] 王颖, 杨梦雨, 赵霞, 等. 质量提取法测试直立式聚丙烯输液袋包装的葡萄糖注射液密封完整性[J]. 药学研究, 2022, 41(5): 299-302.
WANG Ying, YANG Meng-yu, ZHAO Xia, et al. Mass Extraction Method for the Closure Integrity Testing of Upright Polypropylene Infusion Bag[J]. Journal of Pharmaceutical Research, 2022, 41(5): 299-302.
[10] 陆维怡, 蔡荣. 国内外药品包装系统密封完整性研究与保障药品质量安全的思考[J]. 中国药事, 2021, 35(7): 828-834.
LU Wei-yi, CAI Rong. Research on Sealing Integrity of Pharmaceutical Packaging System at Home and Abroad and Consideration on Ensuring Drug Quality and Safety[J]. Chinese Pharmaceutical Affairs, 2021, 35(7): 828-834.
[11] 姚琳, 咸富荣, 张芳芳. 质量提取法测试西林瓶包装系统密封性[J]. 中国医药工业杂志, 2022, 53(7): 1013-1017.
YAO Lin, XIAN Fu-rong, ZHANG Fang-fang. Mass Extraction Method for the Package Integrity Testing of Vials[J]. Chinese Journal of Pharmaceuticals, 2022, 53(7): 1013-1017.
[12] 郭涤亮, 董武军, 马骏威, 等. 《美国药典》〈1207〉无菌药品包装系统密封性评估的介绍与解读[J]. 中国新药杂志, 2021, 30(10): 880-885.
GUO Di-liang, DONG Wu-jun, MA Jun-wei, et al. Introduction and Interpretation of USP〈1207〉package Integrity Evaluation for Sterile Products[J]. Chinese Journal of New Drugs, 2021, 30(10): 880-885.
[13] 姚振, 卢志明, 余涛涛, 等. 卡贝缩宫素注射液容器密封性方法学验证[J]. 中国药业, 2022, 31(3): 84-86.
YAO Zhen, LU Zhi-ming, YU Tao-tao, et al. Methodology Validation for Container Closure of Carbetocin Injection[J]. China Pharmaceuticals, 2022, 31(3): 84-86.
[14] PELÁEZ S S, MAHLER H C, HERDLITSCHKA C, et al. Comparing Physical Container Closure Integrity Test Methods and Artificial Leak Methodologies[J]. PDA Journal of Pharmaceutical Science and Technology, 2019, 73(3): 220-234.
[15] MOGHIMI N, SAGI H, PARK S I. Leakage Analysis of Flexible Packaging: Establishment of a Correlation between Mass Extraction Leakage Test and Microbial Ingress[J]. Food Packaging and Shelf Life, 2018, 16: 225-231.
[16] BROWN H, MAHLER H C, MELLMAN J, et al. Container Closure Integrity Testing-Practical Aspects and Approaches in the Pharmaceutical Industry[J]. PDA Journal of Pharmaceutical Science and Technology, 2017, 71(2): 147-162.
[17] MATHAES R, MAHLER H C, ROGGO Y, et al. Influence of Different Container Closure Systems and Capping Process Parameters on Product Quality and Container Closure Integrity (CCI) in GMP Drug Product Manufacturing[J]. PDA Journal of Pharmaceutical Science and Technology, 2016, 70(2): 109-119.
[18] YOON S Y, SAGI H, GOLDHAMMER C, et al. Mass Extraction Container Closure Integrity Physical Testing Method Development for Parenteral Container Closure Systems[J]. PDA Journal of Pharmaceutical Science and Technology, 2012, 66(5): 403-419.
[19] 杨梦雨, 贾菲菲, 赵霞, 等. 质量提取法检测直立式聚丙烯输液袋密封完整性研究[J]. 中国药学杂志, 2022, 57(18): 1565-1570.
YANG Meng-yu, JIA Fei-fei, ZHAO Xia, et al. Container Closure Integrity of Upright Polypropylene Infusion Bags by Mass Extraction Method[J]. Chinese Pharmaceutical Journal, 2022, 57(18): 1565-1570.
Container Closure Integrity of Packaging System of Ceftazidime for Injection by Mass Extraction Method
GUO Yan-yan,ZHANG Wan-ying, QIU Yi-ting, REN Kun, WANG Xiao-lan, JIANG Yan*, PU Xiao-cong*
(Sichuan Institute for Drug Control, Chengdu 611731, China)
The work aims to establish a complete set of mass extraction method to study the container closure integrity of the packaging system of ceftazidime for injection (specification: 15 mL; 1.0 g). The experimental parameters were optimized by testing the negative control samples, negative samples and positive samples to complete system suitability confirmation, detection limit confirmation and methodological confirmation of mass extraction method, and test the 6 batches of samples after storage at acceleration conditions (temperature: 40 ℃±2 ℃ and relative humidity 75%±5%)for 0, 3 and 6 months. This method had a detection limit of 2 μm, which was sensitive and convenient and the container enclosure integrity of the product complied with the requirements. The mass extraction method can be used to study the container closure integrity of ceftazidime for injection in the headspace aseptic packaging system.
mass extraction method; ceftazidime for injection; container closure integrity; headspace aseptic packaging system
TB487
A
1001-3563(2023)21-0273-06
10.19554/j.cnki.1001-3563.2023.21.034
2023-02-20
四川省科技厅重点研发项目(2021YFG0089)
通信作者
责任编辑:曾钰婵

