强直性脊柱炎合并坏疽性脓皮病1例并文献复习
孙博 ,万志红 ,赵清
1 河南大学淮河医院 风湿免疫科,河南 开封 475000;2 周口市第一人民医院,河南 周口 466700
1 病例资料
陈某,男性,51岁,因“腰背痛20年余,右下肢红肿、破溃6个月”于2019年10月10日入住我院风湿免疫科。患者20余年前无明显诱因出现腰背痛,夜间痛为主,翻身困难,晨起背部僵硬,伴双髋关节疼痛,活动后减轻,反复发作,未诊治,于2015年因上述症状加重至我科门诊就诊,完善相关检查,诊断为强直性脊柱炎,并给予甲氨蝶呤(MTX)10 mg Qw 皮下注射,柳氮磺胺吡啶1.0 g Bid口服,注射用重组人II型肿瘤坏死因子受体-抗体融合蛋白(TNFi)50 mg Qw 皮下注射,以及碳酸钙等抗骨质疏松治疗,症状缓解。2016年至2018年期间,因经济原因自行停用TNFi,之后反复关节肿痛,药物自行调整为泼尼松10~15 mg Qd,MTX 15 mg Qw口服。2019年4月出现右下肢红肿、皮温高,当地医院诊断为丹毒,停用泼尼松、MTX,给予头孢菌素类、阿莫西林克拉维酸钾、去甲万古霉素等抗菌素抗感染治疗,伤口迅速扩大并形成巨大溃疡,溃疡表浅,疼痛剧烈,转至我科住院治疗。
1.1 既往史
否认高血压、高尿酸血液、高血脂、冠心病等慢性疾病。
1.2 专科查体
脊柱生理弯曲消失,后凸畸形,颈椎、胸椎、腰椎前后、侧屈均受限,双髋、膝关节屈伸均受限,双侧“4”字试验不能配合,右下肢胫骨前皮肤可见长约10 cm,宽约5 cm的破溃面,表面有黄白色渗出(图1A)。
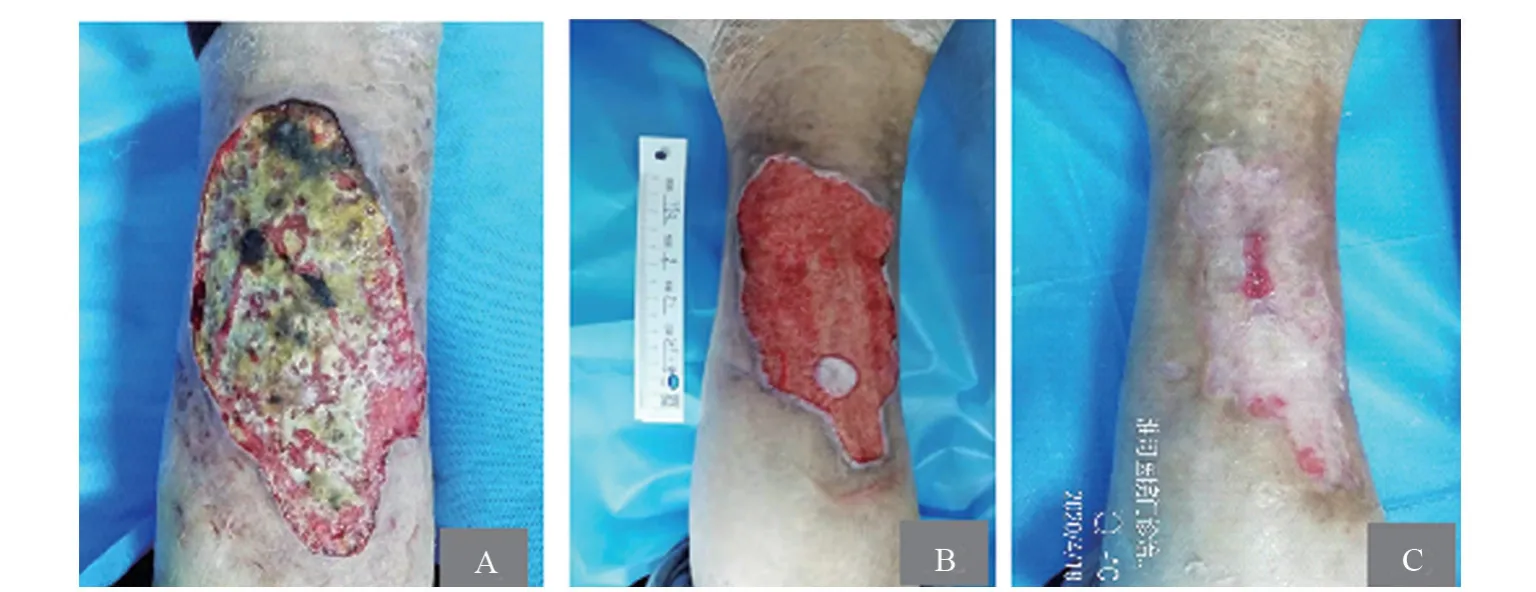
图1 治疗前后皮损对比
1.3 实验室检查
红细胞沉降率(ESR):92 mm/1 h末。血常规:HGB 89 g/L,PLT 344×109/L。生化:白蛋白(Alb)33.1 g/L,C反应蛋白(CRP)42.4 mg/L,白细胞介素(IL-6)45.1 pg/mL,肿瘤坏死因子α(TNF-ɑ)19.2 pg/mL。伤口分泌物培养:假单胞菌种。药敏:对左氧氟沙星敏感。肝功能、肾功能、血糖、免疫球蛋白、补体、心肌酶、电解质、小便常规、大便常规、降钙素原、血清铁蛋白、血清固定电泳未见异常,乙肝表面抗原、丙肝抗原及抗体、梅毒螺旋体抗体、人免疫缺陷病毒、结核感染T 淋巴细胞检测实验(T-spot TB)阴性,真菌(1-3)-β-D 葡聚糖实验(G实验)阴性、曲霉菌半乳甘露聚糖实验(GM)阴性,抗核抗体谱+抗中性粒细胞胞浆抗体均阴性,肿瘤标志物(甲胎蛋白、癌胚抗原、前列腺特异抗原、神经元特异性烯醇化酶、糖类抗原CA199、CA125、CA153)、血培养3次均阴性,双下肢血管彩超、心脏彩超、胸部CT、骨髓穿刺等未见异常。四肢肌电图检查示神经传导未见异常。
1.4 诊断与治疗
给予左氧氟沙星抗感染治疗无效,皮损快速进展,进行皮肤活检。病理:(右下肢)皮肤组织,表皮角化过度伴角化不全,局部表皮增厚,真皮浅层胶原纤维增生,伴散在急慢性中性粒细胞浸润,真皮深层可见大片炎性坏死。诊断坏疽性脓皮病(Pyoderma Gangrenosum,PG),治疗上给予泼尼松60 mg Bid、环磷酰胺50 mg Qd口服以及左氧氟沙星0.5 g Qd静脉滴注。治疗1周,皮损仍在加重,治疗方案调整为托法替布5 mg Bid口服,泼尼松30 mg Qd口服,环磷酰胺(CTX)0.2 g Qod静脉推注及清创换药。治疗1周后皮损面积缩小,渗出明显减少(图1B)。出院后规律我科门诊随诊,因肝损害停用CTX(累及共1.8 g),改为MTX 15 mg Qw口服,因恶心、呕吐严重停用,继续托法替布5 mg Bid、泼尼松30 mg Qd口服,泼尼松每周减5 mg,减至20 mg/d后每周减2.5 mg,直至10 mg Qd。出院2个月后复查ESR 13 mm/L,CRP 2.4 mg/L,IL-6 18.8 pg/mL,TNF-α 7.67 pg/mL,ALB 42.1 g/L,Hb 117 g/L,皮肤破溃明显缩小,疼痛感减轻,渗出减少。出院半年后复诊,患者下肢溃疡基本愈合,瘢痕表面呈白色(图1C),复查ESR13 mm/L,CRP2.4 mg/L,IL-6 18.8 pg/mL,TNF-α 7.67 pg/mL,ALB 42.1 g/L,Hb 117 g/L,患者至今仍规律我科门诊随诊,皮肤溃疡完全愈合。目前使用托法替布5 mg Bid,泼尼松5 mg Qd,同时使用碳酸钙600 mg Qd,阿法骨化醇0.25 μg Qd预防骨质疏松。
2 讨论
坏疽性脓皮病(PG)是一种少见的非感染性、嗜中性皮肤病,常表现为不同程度的皮肤破溃,多发于躯干与下肢[1]。一般PG患者会出现极度疼痛的红斑,红斑边缘呈紫罗兰色,参差不齐,并快速出现水疱或坏死性溃疡,也有大疱型、脓皮型、脓疱型、造口周围型和浅表肉芽肿型等分型[2]。虽然患者全身都可以受影响,但通常以小腿为主,约占86.1%[3]。PG病变经常被误诊为简单的不愈合溃疡,尤其合并感染的溃疡,鉴别更加困难。本例患者因下肢出现浅表性溃疡,被诊断为简单的不愈合溃疡,使用抗生素治疗后,效果不佳,转入我院后,根据本例患者的临床症状,经过皮肤活检最终诊断为经典型PG。
PG 常伴有潜在的系统性疾病,文献[3]报道,50%~70%的PG 患者与潜在的自身免疫性疾病(AID)相关。特别是在65岁以上的PG 患者更容易合并AID,约41.0%的PG患者合并炎症性肠病(IBD),13.4%的患者合并类风湿关节炎(RA),约1.8%的患者合并AS[4]。因此,可以看出PG 合并AS十分罕见,临床上更容易被忽视。AS合并PG的发病机制尚未明确,有研究发现相对于HLA-B27阴性的AS患者,HLA-B27阳性的AS患者在体内及体外均可观察到嗜中性粒细胞的运动性和趋化性增加,导致非特异性IgM 和补体沉淀在真皮小血管上,进而引发嗜中性粒细胞外渗[5],同时发现患者血液、皮肤和滑膜中IL-23、IL-17A增加[6]。在典型溃疡性PG患者中的病变皮肤中也发现了TNF-α、IL-1、IL-6、IL-8、IL-17A 和IL-23等细胞因子明显升高[7]。因此,IL-23和IL-17A 可能是AS及PG 的共同发病机制。
通常AID出现皮肤病变时首先考虑到合并血管炎,合并血管炎时镜下皮肤、皮下组织、血管周围可见大量淋巴细胞浸润,而典型的PG 组织病理学表现为大量无菌中性粒细胞浸润,缺乏血管纤维蛋白样坏死[8]。因此,皮肤活检是鉴别血管炎与PG的重要手段,该患者皮肤活检提示大量中性粒细胞浸润,不符合血管炎的病理表现,符合PG 表现,最终确诊为PG。
众所周知,TNF-α抑制剂、IL-17抑制剂是治疗AS的有效手段,对于上述两种生物制剂治疗失败的AS患者Janus激酶抑制剂也被证明是安全有效的[9]。约40.6%的AS患者使用托法替布治疗后ASAS 20反应率显著提高[10]。由于PG临床罕见,缺少大样本临床研究,大多数关于PG 的治疗是病例报告或小样本研究,PG 患者的治疗分为局部治疗及全身治疗,局部治疗包括创面清创、外科手术、植皮等,系统治疗仍是重中之重,糖皮质激素是目前治疗PG最有效的药物,对于不能耐受糖皮质激素者免疫抑制剂包括CTX、环孢素、他克莫司等常作为辅助药物,重症患者可使用免疫球蛋白(IVIg)冲击,生物制剂对大部分PG 患者也有一定的疗效[11]。英夫利昔单抗等对绝大部分PG 患者疗效显著[12],Janus激酶抑制剂对于治疗难治性PG 有一定效果。但PG 患者往往合并感染,创面微生物培养阳性,对于这类患者治疗难度更大,需权衡抗感染利弊及强度。研究[13]表明,对于感染较轻的PG患者一般无须使用抗菌素,因为这类患者大多是慢性创面在局部破坏后,创面外露引起的继发感染,而不是原发细菌所致的皮肤破溃,因此局部感染对创面进展危害较小,加强局部换药后即可好转,在系统治疗后,创面常常自愈。本例患者前期使用抗感染无效,使用激素以及MTX及CTX等免疫抑制剂疗效仍不佳,因经济原因不能继续使用TNFi,结合文献报道以及权衡患者的经济选用托法替布,皮损明显改善。因此,感染在该患者中致病性并不强,通过治疗PG取得了明显疗效,而对于像本例难治性且经济条件受限的PG患者托法替布也可能是一种选择。
总之,PG临床表现多样诊断困难,通常是排除性诊断,特别是非风湿科医师,而AS合并PG患者更是少之又少,增加了诊断的难度。因此,对于合并有炎症性疾病合并有皮肤溃疡的患者,在抗感染治疗效果不佳的情况下,应及时行病理活检,结合经验丰富的皮肤病学和伤口护理团队、风湿病学、疼痛管理、传染病和皮肤病理学家的意见非常重要,排除任何其他溃疡过程并彻底评估患者潜在的全身合并症,早期诊断,制定个体化治疗方案。特别是对一些合并有感染的PG 患者,应综合考虑抗感染药物的选择及抗感染力度,并注意免疫抑制剂、生物制剂的选择,以获得最大收益。

