不同粒径薄水铝石微晶的合成及其脱水动力学分析
田 朋,周若辉,徐前进,刘坤吉,庞洪昌,宁桂玲
(1.大连理工大学化工学院,辽宁大连 116023;2.江西宝弘纳米科技有限公司,江西宜春 336000)
薄水铝石(也称一水铝石、勃姆石或软水铝石)在工业上用来描述氧化铝的水合物[1-2],化学式可写作AlOOH·xH2O。晶粒尺寸小于10 nm、结晶不完全的薄水铝石被称为拟薄水铝石;晶粒尺寸为10~50 nm 的薄水铝石被称为薄水铝石准晶;晶粒尺寸大于50 nm、结晶完全的薄水铝石被称为薄水铝石微晶,其广泛应用于催化剂载体、电路板印刷、阻燃剂和锂电池等领域[3-10]。以薄水铝石为前驱体,经煅烧生成的氧化铝是非常重要的无机功能材料,其应用涉及复合材料、催化、微电子、精细研磨、新能源汽车等诸多高新科技领域[11-19]。
目前,精细氧化铝生产领域面临形貌和粒径难调控、颗粒易团聚及杂质含量高等技术难题[20]。薄水铝石因其颗粒尺寸和形貌易调控,且相较于其他前驱体在热分解过程中表现出更好的烧结性,已成为制备精细氧化铝最重要的前驱体之一。深入探究薄水铝石粒径和形貌控制机理及其转变成氧化铝的热分解机理对精细氧化铝的合成具有重要意义。科学工作者们对如何有效调控薄水铝石尺寸和形貌进行了一系列研究,内容涵盖了反应温度、反应时间、溶剂体系、pH、金属离子、表面活性剂、晶种等的影响[21-22]。固相体系的热分解反应机理通常采用多重扫描速率法(Popescu法)[23]进行动力学分析处理,其优势较为明显[24-27]。XU 等[28]通过动力学分析得出分散性较差的薄水铝石在非等温条件下转变成γ-Al2O3的平均活化能为198 kJ/mol,且活化能随着反应程度的变化而变化;这种高的活化能及其对反应度的依赖性表明此脱水过程属于化学控制过程,涉及质子和羟基形成水的脱出及Al3+的迁移。彭志宏等[29]通过计算得出工业氢氧化铝在746.29~821.66 K下脱水过程的活化能为501.47 kJ/mol,属于化学反应机制;该活化能远高于薄水铝石脱水的活化能,说明薄水铝石作为氧化铝前驱体具有优越性。
研究人员通过煅烧实验认为薄水铝石在573.15~973.15 K下会转变成γ-Al2O3,其转变机制及γ-Al2O3的性能主要与薄水铝石的结晶度和粒径有关[30-35],且氧化铝的形成温度随着薄水铝石粒径的减小而降低[36-38]。考虑到粒径对氧化铝前驱体的脱水过程有较大影响,黎少华等[39]通过1 473.15 K 的煅烧实验确定了薄水铝石粒径对α-Al2O3形貌及转变时间的影响,但并没有对其热分解机制进行探究。关昕等[40]计算出粒径为300 nm 左右的薄水铝石的脱水活化能为160.34 kJ/mol,属于固相反应的三维扩散过程,其活化能及脱水过程机制均与普通薄水铝石不同。目前,对于不同粒径的薄水铝石脱水转变成γ-Al2O3的动力学机理探究缺乏报道。最近,YANG 等[21]报道了以拟薄水铝石为晶种辅助氢氧化铝水热调变薄水铝石粒径的工作。在此基础上,本文采用拟薄水铝石为晶种辅助氢氧化铝水热制备不同粒径的薄水铝石微晶,并考察不同粒径氢氧化铝及不同工艺生产的拟薄水铝石对合成薄水铝石的影响,进而证明该方法的普适性;同时探讨薄水铝石转变成γ-Al2O3的机理模型及活化能,重点探究粒径对薄水铝石转变过程的影响机理,为薄水铝石作为前驱体制备高性能氧化铝提供理论基础。
1 实验部分
1.1 样品制备
本实验采用拟薄水铝石作为晶种辅助氢氧化铝水热合成不同粒径的薄水铝石粉体,同时考察不同粒径氢氧化铝原料及不同工艺生产的拟薄水铝石晶种对合成薄水铝石的影响,以证明该方法的普适性,最后将薄水铝石粉体在823.15 K 下煅烧,得到不同粒径的γ-Al2O3粉体,具体步骤如下。
1)合成不同粒径薄水铝石。采用电子称称取氢氧化铝粉体AH-01DG(由洛阳中超新材料股份有限公司提供),采用电子天平称取拟薄水铝石晶种Seed1(由江西宝弘纳米科技有限公司提供),两者质量比分别为1∶0、150∶1、15∶1,两种粉体质量和为4 kg;在常温下使用双轴机械搅拌机将4 kg 粉体与16 L 去离子水混合并连续搅拌30 min;随后将浆料转移到25 L高压水热反应釜中,在300 r/min的速率下搅拌并升温至453.15 K,保温4 h;反应结束后,向反应釜内置盘管通冷却水,使浆料冷却至333.15 K以下,导出浆料过滤,并将滤饼置于鼓风干燥箱中干燥;最后采用气流粉碎机(GTM-50)对干燥后产物进行气流粉碎。
2)考察原料粒径及不同晶种对合成薄水铝石的影响。不同粒径的氢氧化铝由中国铝业山东分公司提供,牌号分别为H-WF-1、H-WF-5、H-WF-10、H-WF-25-SP,如表1 所示;拟薄水铝石晶种Seed1、Seed2、Seed3、Seed4 分别由江西宝弘纳米科技有限公司、扬州中天利新材料股份有限公司、中国铝业山东分公司、淄博南韩化工有限公司提供;晶种与氢氧化铝的质量比设定为1∶50,其他合成条件同步骤1)。

表1 不同原料的性质Table 1 Properties of different raw materials
3)薄水铝石煅烧。分别取一定量的薄水铝石样品置于刚玉坩埚中,在马弗炉中823.15 K下煅烧4 h后得到白色粉体。
1.2 样品表征
使用激光粒度分析仪(Bettersize 2000)对样品的粒度分布进行测试;采用扫描电子显微镜(SEM,Tescan Vega3)对样品进行形貌表征,加速电压为20 kV;采用X 射线粉末衍射仪(XRD,SmartLab 9KW)对样品的物相结构进行分析,扫描步长为0.02°,扫描角度2θ为5°~80°,扫描速率为10 (°)/min;采用同步热分析仪(TGA-DSC 3+)对样品进行热重-差示扫描量热分析(TG-DSC),空气流量为50 mL/min,升温速率为5、10、15、20、25 K/min,温度范围为303.15~1 073.15 K。
2 结果与讨论
2.1 物相与形貌分析
根据前期报道[21],以拟薄水铝石为晶种,采用水热法合成了不同粒径的薄水铝石(当氢氧化铝与晶种质量比为1∶0、150∶1、15∶1时,所得样品分别标记为1#、2#、3#),并对其进行物相与形貌分析,结果如图1所示。图1a为未加晶种和加入不同量晶种的氢氧化铝经453.15 K水热4 h后所得产物的XRD谱图。从图1a可知,样品1#、2#、3#的各衍射峰与薄水铝石的标准卡片(PDF 21-1307)一致,没有其他杂峰,证明氢氧化铝已经完全转化为薄水铝石;未加晶种的样品1#衍射峰强度最高,随着晶种加入量的增加,样品衍射峰强度逐渐下降,表明加入晶种后样品的晶化程度降低、晶粒变小,从而影响了产物晶粒的生长。图1b~d 为薄水铝石样品1#、2#、3#的SEM图。从图1b~d可知,在未加晶种条件下氢氧化铝水热所得薄水铝石为形貌规整、大小均匀的菱形块状结构,颗粒尺寸在2 μm 左右;加入晶种且当氢氧化铝与晶种质量比为150∶1 时,薄水铝石颗粒仍为大小均匀的菱形块状(图1c),但颗粒尺寸下降到1 μm左右;当氢氧化铝与晶种质量比为15∶1 时,薄水铝石依然为块状结构(图1d),颗粒尺寸进一步减小到600 nm左右,这与XRD谱图中衍射峰的变化规律一致。样品的粒度分布见表2。由表2可知,样品1#、2#、3#的平均粒径D50分别为2.02、0.96、0.66 μm,与SEM 结果基本相同;此外D90/D10 小于3,说明颗粒大小比较均匀。根据文献[21-22]报道,氢氧化铝的水热合成过程经历晶体溶解、成晶络离子形成、新相薄水铝石晶核出现及其在薄水铝石晶核上外延生长。拟薄水铝石是结晶不完整的薄水铝石,其与薄水铝石具有相同的晶体结构,符合晶种条件。将拟薄水铝石作为晶种,一方面会降低饱和溶液均相成核的活化能,加快转化速率,缩短晶体的生长期;另一方面,形成了额外的成核位点,增加了薄水铝石晶粒的成核数量,使得氢氧化铝水热生成薄水铝石晶体的尺寸下降。因此,通过改变原料中的晶种比例可以在不增加复杂设备的情况下更容易地实现薄水铝石粒径的精细调控,为进一步制备不同颗粒尺寸的氧化铝奠定基础。
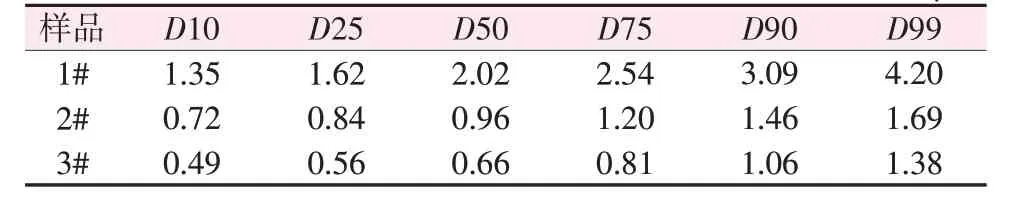
表2 样品的粒度分布Table 2 Particle size distribution of samples μm
为了验证拟薄水铝石晶种辅助调变薄水铝石粒径方法的普适性,进一步考察了晶种和氢氧化铝粒径对产物形貌的影响:1)在氢氧化铝粉体(牌号AH-01DG)中加入不同工艺生产的拟薄水铝石作为晶种[m(氢氧化铝)∶m(拟薄水铝石)为50∶1]水热生成薄水铝石;2)以不同粒径的氢氧化铝(由中国铝业山东分公司提供,粒径分布见表1)为原料,在不加晶种的条件下水热生成薄水铝石;3)以不同粒径的氢氧化铝为原料,加入同一种拟薄水铝石作为晶种[Seed1,m(氢氧化铝)∶m(拟薄水铝石)为15∶1]水热生成薄水铝石。水热产物的SEM 结果如图2 所示。由图2a~d可知,在同种氢氧化铝原料中加入不同工艺生产的拟薄水铝石晶种后均生成粒径在700 nm 左右、颗粒大小均匀、分散性良好的薄水铝石;尽管不同企业的生产工艺和参数不同,但生产出的均是结晶不完整的拟薄水铝石,且晶粒尺寸相近,均在10 nm 以下[1]。因此,不同工艺生产的晶种对产物的粒径没有明显影响。由图2e~h可以看出,以不同粒径的氢氧化铝为原料,在不加晶种的条件下产物薄水铝石的尺寸随着原料粒径的增加而增大,甚至出现团聚现象;加入相同比例的拟薄水铝石晶种Seed1后,产物薄水铝石的一次颗粒(团聚前的颗粒)尺寸均下降到500 nm 左右(图2i~l),与未加晶种的产物相比有明显差别。在加入晶种的条件下,H-WF-1 水热后产物分散比较均匀,随着原料颗粒尺寸的增加,产物的团聚程度也增加,但一次颗粒尺寸变化不明显。这是因为氢氧化铝原料颗粒越大,表面吸附的拟薄水铝石晶种数量就越多,而大量薄水铝石在一起成核生长很容易团聚,该现象佐证了前期报道的结论[21-22]。

图2 氢氧化铝加入不同晶种(a~d)、不同氢氧化铝不加晶种(e~h)及不同氢氧化铝加入同种晶种(i~l)后产物的SEM图Fig.2 SEM images of products of aluminum hydroxide after adding different types of seeds(a~d),SEM images of products of different aluminum hydroxide without seeds(e~h),and SEM images of products of different aluminum hydroxides with same seeds(i~l)
以薄水铝石为前驱体,考察其粒径和形貌对生成γ-Al2O3的影响。图3为样品1#、2#、3#经823.15 K煅烧所得粉体的XRD谱图和SEM图。由图3a可知,样品各衍射峰与γ-Al2O3标准卡片(PDF#10-0425)一致,说明薄水铝石样品1#、2#、3#经823.15 K 煅烧后均已转化为γ-Al2O3。通过与图1对比得出,薄水铝石的晶面和γ-Al2O3的晶面在拓扑规则上有着精确的对应关系。通过对比图3b~d和图1b~d可看出,当薄水铝石(1#)粒径约为2 μm 时,经煅烧生成的γ-Al2O3颗粒尺寸同样在2 μm左右,且形貌完整、分散性良好,与薄水铝石保持一致;当薄水铝石(2#)粒径约为0.96 μm 时,γ-Al2O3颗粒尺寸在1 μm 左右,形貌基本完整,且分散性较好;当薄水铝石(3#)粒径降到0.66 μm 时,γ-Al2O3基本上保持了薄水铝石的颗粒尺寸及形貌特征,但同时也出现了较严重的烧结现象,颗粒分散性变差。以上结果说明,γ-Al2O3与其前驱体薄水铝石在粒径大小和形貌特征上具有一致性,但当薄水铝石粒径减小到0.66 μm时,生成的氧化铝更容易出现颗粒烧结、形貌破损等现象。
综上可知,通过调控薄水铝石的粒径可以合成不同粒径的氧化铝,这也体现了薄水铝石作为氧化铝前驱体的优越性;但同时也发现薄水铝石的粒径大小对氧化铝的合成过程存在影响。通过下文中的动力学计算,将进一步探究其原因。
2.2 热重-差示扫描量热分析
为了进一步探究薄水铝石粒径对其转变为γ-Al2O3的转化温度及脱水过程的影响,以合成的1#、2#、3#薄水铝石为原料进行了TG-DSC分析。图4为不同粒径的薄水铝石在升温速率为15 K/min 下的TG-DSC 曲线。由4 图可知,样品1#、2#、3#均有2个失重阶段,以样品2#为例,第一阶段在637.14 K之前,为薄水铝石中吸附水的脱除,质量损失率约为0.4%,说明样品中吸附水较少;第二阶段在650.31~852.04 K,质量损失率约为14.8%,失重较为明显,说明在此阶段薄水铝石发生热分解,逐渐脱除结构水形成γ-Al2O3。因此,选择在823.15 K左右煅烧薄水铝石具有合理性。两个阶段的具体失重参数如表3所示,该结果与薄水铝石的理论热失重数据相当。整理分析不同粒径薄水铝石样品在第二阶段的DSC曲线中吸热峰参数,结果如表4所示。由表4可知,随着薄水铝石粒径的减小,DSC 曲线中吸热峰对应的温度逐渐降低,表明薄水铝石粒径越小,温度对其影响越明显,越容易脱水形成γ-Al2O3。

图4 不同样品在升温速率为15 K/min下的TG-DSC曲线Fig.4 TG-DSC curves of different samples at heating rate of 15 K/min
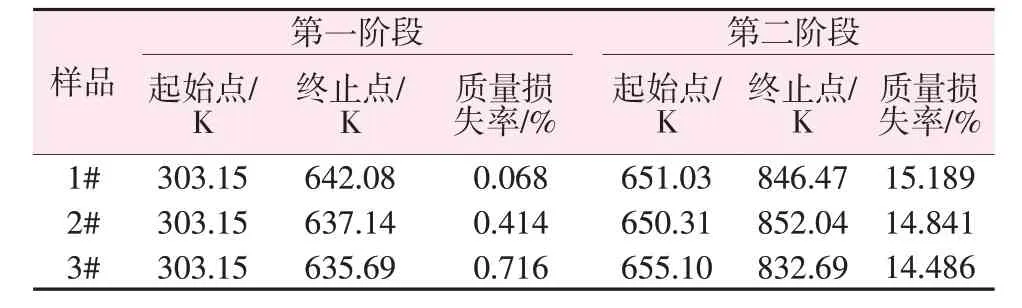
表3 TG-DSC曲线中不同样品的失重参数Table 3 Weight loss parameters of different samples in TG-DSC curves

表4 DSC曲线中不同样品的第二吸热峰特征参数Table 4 Characteristic parameters of second endothermic peak of different samples in DSC curves
2.3 脱水动力学分析
图5 为不同样品在不同升温速率下的TG-DSC曲线。从图5可以看出,随着升温速率的增加,DSC曲线上吸热峰逐渐变窄,说明升温速率的增加能使热反应更活跃,脱水过程更迅速;从TG 曲线上还可以看出,随着升温速率的增加,吸热峰对应的质量损失率也逐渐增大,表明薄水铝石脱水更加彻底。
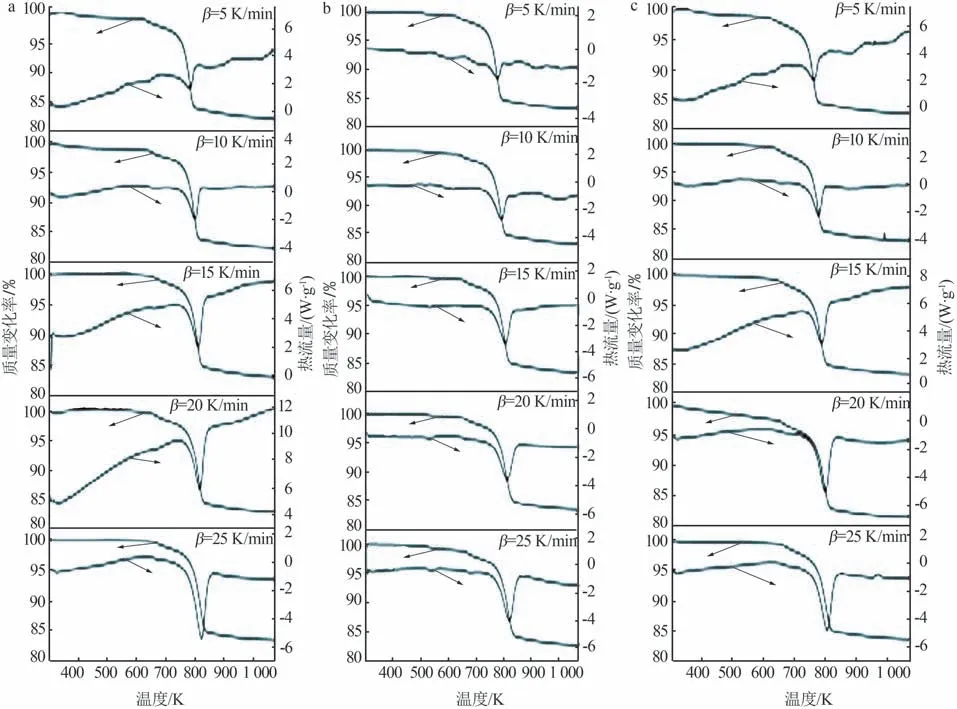
图5 不同样品在不同升温速率下的TG-DSC曲线Fig.5 TG-DSC curves of different samples at different heating rates
为了进一步探究不同粒径的薄水铝石对煅烧生成γ-Al2O3过程的影响机理,对薄水铝石脱水动力力学进行了分析计算。采用多重扫描速率法(Popescu法)研究薄水铝石脱水转化为γ-Al2O3的动力学过程(TG曲线第二失重阶段)。通过对图5中3种样品(1#、2#、3#)在不同升温速率下的TG 曲线上同一温度处的反应度进行动力学分析,可获得反应机理函数及反应过程的活化能E和指前因子A。
Popescu法所使用的方程如下所示:
式中:G代表反应机理函数的积分式;α代表反应度;β为升温速率,K/min;E为相变活化能,kJ/mol;A为指前因子,min-1;R为普适气体常数;T为绝对温度,K;Tξ=(Tn+Tm)/2;I是和温度相关的函数;K(T)是速率常数。
在不同升温速率下,将DSC 曲线上第二吸热峰所对应的TG曲线上的质量损失率设定为单位1,分别求取反应度α=0.05、0.15、0.25、...、0.95时的温度,并作出3 种样品在不同升温速率下的α-T曲线,如图6所示。在保证图6任意曲线的反应度均在0.05~0.95 的前提下,给定一组温度(Tm,Tn),可以从不同升温速率下的α-T曲线中找到一组数据(αm,βi)和(αn,βi),结果如表5所示。

图6 不同样品在不同升温速率下的α-T曲线Fig.6 α-T curves of different samples at different heating rates

表5 样品1#、2#、3#在不同升温速率下的反应度数据Table 5 Reactivity data of samples 1#,2# and 3# at different heating rates
将得到的(αm,βi)和(αn,βi)代入用于解释固体材料动力学过程的17种机理函数中[41],可得到不同升温速率β下的G(α)mn值,由此可做出G(α)mn-1/β曲线。图7 是样品1#、2#、3#不同动力学模型的G(α)mn-1/β曲线图。用最小二乘法对G(α)mn-1/β曲线进行线性拟合,结果如表6所示。

表6 样品1#、2#、3#的线性拟合结果Table 6 Linear fitting results of samples 1#,2# and 3#
选择相关性最高的模型作为样品的动力学模型,即选择表6 中相关系数最大的模型。由表6 可知,样品1#在脱水转变成γ-Al2O3(第二失重阶段)的热分解过程属于R3模型,其积分形式为G(α)=3(1-α)2/3,是球形对称的相边界反应;样品2#在脱水转变成γ-Al2O3的热分解过程属于A1.5 模型,其积分形式为G(α)=[-ln(1-α)]2/3,属于随机成核和随后成长的过程;样品3#在脱水转变成γ-Al2O3的热分解过程属于A2模型,其积分形式为G(α)=[-ln(1-α)]1/2,属于随机成核和随后成长的过程。从确定的机理函数可知,薄水铝石粒径越小,其表面性质越活跃,晶格缺陷导致的活性位点越密集,γ-Al2O3更容易在薄水铝石表面成核,并围绕核不断向其内部生长,因此更易受随机成核和随后生长机理模型的控制。
确定最概然机理函数之后,分别给定反应度α=0.4、0.5、0.6、0.7,得到不同升温速率下各转化率对应的温度,将温度值及确定的机理函数代入公式(3)中,进行ln[β/(Tn-Tm)]对1/Tξ的线性回归计算,由直线的斜率求得活化能E,由截距求得指前因子A。对反应度αm-αn为0.4-0.5、0.5-0.6、0.6-0.7 3个阶段的过程进行线性回归和动力学参数计算,求取3 个阶段的平均值。样品1#、2#、3#的线性回归及动力学参数平均值如表7所示,其中a、b分别指线性回归方程的斜率和截距,R2指相关系数。由表7可知,随着薄水铝石粒径的减小,其热分解活化能也逐渐降低,这有利于γ-Al2O3的形成。

表7 样品1#、2#、3#动力学参数计算和回归结果Table 7 Kinetic parameters calculation and regression results of samples 1#,2# and 3#
3 结论
1)以粒径约为2 μm的氢氧化铝为原料,加入不同比例的拟薄水铝石晶种可成功水热合成出平均粒径D50 分别为2.02、0.96、0.66 μm 的薄水铝石;煅烧所得γ-Al2O3与其前驱体薄水铝石在粒径和形貌上具有一致性,且不同工艺生产的拟薄水铝石作为晶种时对氢氧化铝水热产物晶粒控制的效果相同。该研究为调变薄水铝石和氧化铝颗粒尺寸提供一条新的有效途径。
2)随着薄水铝石粒径的减小,热分解过程所需温度逐渐降低,转变成γ-Al2O3的活化能也逐渐减小,且动力学过程受不同机理模型的控制。粒径约为2.02 μm 的薄水铝石转变成γ-Al2O3的机理函数为G(α)=3(1-α)2/3,属于R3 模型,是球形对称的相边界反应过程,该过程的活化能为227.732 kJ/mol,指前因子为2.366×1014min-1;当薄水铝石粒径约为0.96 μm 时转变成γ-Al2O3的机理函数为G(α)=[-ln(1-α)]2/3,属于A1.5模型,是随机成核和随后成长的过程,该过程的活化能为200.326 kJ/mol,指前因子为1.270×1013min-1;当薄水铝石粒径约为0.66 μm时转变成γ-Al2O3的机理函数为G(α)=[-ln(1-α)]1/2,属于A2 模型,是随机成核和随后成长的过程,该过程的活化能为191.992 kJ/mol,指前因子为3.094×1012min-1。该研究为薄水铝石作为前驱体制备高性能氧化铝提供理论基础。

