草鱼肌纤维原代培养的适宜培养基筛选
张浩,龙鲜梅,陈旺旺,胡广文,谭青松
(华中农业大学水产学院,水产养殖国家级实验教学示范中心,湖北 武汉 430070)
草鱼(Ctenopharyngodon idellus)属鲤形目、鲤科、雅罗鱼亚科、草鱼属,具有生长快、肉质鲜美、价格亲民等特点,是我国重要的经济鱼类[1]。随着水产业发展和配合饲料的普及,草鱼产量大幅度提升,养殖效益逐年递增,但草鱼肌肉品质也有所降低[2]。骨骼肌是鱼体可食部分的主要组成,占鱼体总质量的30%~80%,肌肉的基本组成单位是肌纤维,肌纤维特性是肉质的组织学基础,细胞结构、肌纤维密度、横截直径和面积等都会影响肌肉品质[3]。随着动物细胞体外培养研究的深入,骨骼肌细胞为动物肌肉生长研究提供了重要技术手段[4]。1965 年,GRAVELL 等[5]对黑头软口鲦(Pimephales promelas)建立了第一株鱼类肌肉细胞系—FHM,FHM目前仍是鱼类肌细胞相关实验的首选细胞系。草鱼的肝原代细胞[6]、前体脂肪细胞[7]以及肠上皮细胞[8]等组织细胞已被分离培养,并应用到病理学、营养代谢及遗传育种等研究,但草鱼肌肉细胞用于营养生理、肌肉品质等研究仍然缺乏。
目前DMEM、M199、DMEM/F12、L-15 以及F12等普遍应用于鱼类细胞培养[9],而在鱼类原代细胞培养中,最常用的培养基是L-15 和M199[10]。这些培养基含有细胞生长所需的多种营养成分,但不含蛋白质、脂类或任何生长因子,需要添加血清以支持长期培养。其中M199 培养基含有较多氨基酸、维生素以及其它营养成分,且含有胸腺嘧啶、腺嘌呤、腺苷等独有成分,因此M199 培养基可用于培养多种种属来源的细胞,现也常用于淡水鱼类细胞的培养。DMEM(高糖型)是一种应用十分广泛的培养基,普遍适用于生长快、主要以糖代谢为主的组织细胞的培养[11]。L-15 培养基用半乳糖作为碳源,有利于减少细胞代谢过程中产生对细胞有毒性的酸性代谢副产物,而且其培养基的缓冲系统是由磷酸盐和高浓度的碱性氨基酸组成,这些特性使得L-15 培养基不需要在CO2环境中进行细胞培养,更加简化了细胞培养条件,近些年广泛应用于鱼类细胞培养[12]。不同培养基的物质组成比例及含量存在较大区别,关于不同培养基对草鱼肌纤维原代培养的作用效果缺乏直接研究。为了确定草鱼肌纤维原代培养的最佳培养基,本实验选用3 种应用范围较广的M199、DMEM 和L-15 培养基进行草鱼肌纤维的培养,通过探究在不同培养基条件下的培养情况,从而筛选适合进行草鱼肌肉细胞原代培养的培养基。
1 材料与方法
1.1 实验用鱼
实验所用草鱼均来自黄冈市太白湖渔场。在华中农业大学水产养殖基地养殖缸里统一饲养一段时间。在实验开始前挑选无病无伤,体质健康,体长10~15 cm 的草鱼苗。
1.2 主要试剂
培养基M199、DMEM、0.25%胰蛋白酶、胎牛血清(FBS)、磷酸盐缓冲液(PBS)购自Gibico 公司;二甲亚砜(DMSO)、培养基L-15 购自浙江吉诺生物医药技术有限公司;硫庆大霉素、两性霉素B、青霉素/链霉素双抗溶液、噻唑蓝(MTT)购自Sigma 公司。
AIM 培养基:以体积比计,在(DMEM、M199 或L-15)培养基中加入5%的青霉素/链霉素双抗溶液,5%的两性霉素B(250 μg/mL)和1%的硫庆大霉素(10 mg/mL);完全培养基配置:以体积比计,在DMEM、M199 或L-15 培养基中加入2%的青霉素/链霉素双抗溶液,5%的两性霉素B(250 μg/mL)和1%的硫庆大霉素(10 mg/mL),20%的胎牛血清;MTT 溶液配置:500 mg 的MTT 溶于100 mL 的PBS。
1.3 方法
草鱼肌肉原代细胞分离和传代培养 用解剖针破坏鱼脑,并用75%酒精消毒。剪取鱼体侧线以上白肌,置于盛有AIM培养基的培养皿内消毒。后将组织块切成1 mm3的小块,接种于25 mL 培养瓶中。将培养瓶置于28 ℃、含5%CO2的培养箱内,使组织小块贴附瓶底,然后将残余液体吸出,再加入4~5 mL 完全培养基,将培养瓶放入培养箱继续培养。每2~3 d 换液一次。待细胞出现大量集落,即进行传代。当细胞培养至80%~90%的融合时,弃培养液,剥离组织块,PBS 清洗去除死细胞,加入0.25%胰蛋白酶消化,待细胞由梭形变为圆形,立即加入含20%胎牛血清的培养基终止消化,收集单细胞悬液,1 200 r/min 离心5 min,弃上清液,加10 mL 含20%胎牛血清的培养液重悬细胞,按照1∶1 传代,培养条件与原代培养相同。
1.3.1 不同培养基培养对草鱼肌纤维生长情况及形态的影响
分别用DMEM、L-15 和M199 三种完全培养基培养草鱼肌纤维,在倒置显微镜下观察组织块细胞在小块贴壁后开始沿瓶壁向外生长的时间以及细胞形态,计数细胞开始迁出组织块和达到第一次传代条件(即培养瓶中的肌细胞达到80%~90%的融合状态)所需时间。
1.3.2 不同培养基对草鱼肌纤维增殖的影响
分别取用DMEM、L-15 和M199 三种完全培养基培养的P2代生长良好的草鱼肌纤维,向培养瓶里加入2 mL 0.25%的胰蛋白酶溶液消化,离心分离制成细胞悬液,以5.0×105/mL 接种于24 孔板,每孔0.5 mL,接种时间记0 h,自接种时算起,每24 h 用细胞计数仪计数3 孔细胞密度,算出均值,绘制细胞生长曲线。另取三种完全培养基分离培养的P2代生长良好的草鱼肌纤维细胞,0.25%胰蛋白酶消化后,以4.2×104/mL 接种于12 孔板,每种培养基3孔,72 h 取样,用流式细胞仪计数细胞数量,计算不同培养基培养的草鱼肌纤维的扩增倍数(扩增倍数=n 代收获的细胞数/n 代接种的细胞数)。
1.3.3 不同培养基对草鱼肌细胞贴壁的影响
分别取用DMEM、M199 和L-15 培养基培养的P3代草鱼肌纤维,用0.25%胰蛋白酶消化,以2.0×105/mL 浓度接种于24 孔板中,每孔2 mL,置于28℃5% CO2培养箱中;每隔2 h,用0.25%胰蛋白酶消化细胞并计算贴壁率,贴壁率(%)=贴壁细胞数/接种细胞数×100%。
1.3.4 不同培养基培养细胞对细胞活力的影响
分别取用DMEM、M199 和L-15 培养基培养的P3代草鱼肌纤维,以2.0×106/mL 浓度接种于96 孔板,每孔150 μL。用无血清培养基设置对照组。各处理细胞放入5%CO2,28 ℃的恒温培养箱培养48 h后,吸出培养液,采用MTT 法检测细胞活力。
1.4 数据分析
实验数据均用平均值±标准差(mean±SD)来表示。实验数据在Excel 2019 中初步处理后,采用SPSS 25.0 对实验数据进行单因素方差分析(one-way ANOVA)判定处理的效果,若组间有显著性差异,再进行Duncan’s 多重比较。P<0.05 被认为差异显著。
2 结果与分析
2.1 草鱼肌肉细胞原代培养形态学及传代后的形态学观察
用DMEM和M-199 培养6 d 后,组织块周围逐渐有细胞迁移出来,迁出细胞贴壁生长良好,透明折光性好,细胞多呈上皮样、少数呈不规则星形,上皮样细胞的分裂速度较快,生长迅速;培养至10 d后,贴壁细胞开始逐渐向周围呈放射状增大铺开,形成生长晕,边缘细胞排列疏密大小不等;培养至14 d 后,肌纤维细胞开始形成比较均一的细胞群落,细胞形态明显变细长,贴壁细胞基本铺满培养瓶底;培养至22 d 后,离组织块近的区域比边远区域细胞生长密集,使得不同区域单层细胞的密度显著不同,少数细胞因发生接触抑制而凋亡。而L-15组在培养6 d 后,未见细胞从组织块边缘迁出;在10 d 后,组织块边缘迁出比DMEM 和L-15 中贴壁细胞透明的细胞,贴壁细胞不及DMEM 和L-15 培养基明显,细胞长势缓慢;培养22 d 后,肌纤维才形成比较均一的细胞群落(图1)。

图1 草鱼肌肉组织块细胞在不同培养基中肌细胞的生长情况(×4)Fig.1 The growth of muscle cells of grass carp in different media
图2 为肌纤维在经过第一次传代后在不同培养基中的生长情况,传代后培养3 天的细胞大部分贴壁生长,部分细胞死亡悬浮在培养液里面。细胞形态为主要呈上皮样。
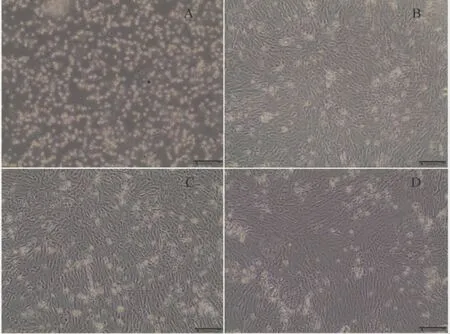
图2 草鱼肌肉组织块细胞首次传代后在不同培养基中的生长情况(×4)Fig.2 The growth of muscle cells of grass carp muscle in different media after the first passage
2.2 不同培养基对草鱼肌纤维迁出时间和第一次传代时间的影响
M199 原代培养的草鱼肌肉组织开始迁出细胞的耗时最短,平均时间为(4.00±0.82)d,其次为DMEM组的(5.50±0.58)d,而L-15 组耗时最长,平均为(10.00±1.83)d(P<0.05)。同时,不同培养基对第一次传代时间的影响结果显示,M199 培养的草鱼肌纤维在(15.50±1.29)d 时达到首次传代的亚融合状态(80%~90%),而用DMEM和L-15 培养的草鱼肌纤维分别在(24.75±1.50)d 和(30.00±1.83)d 后达到首次传代的亚融合状态,且三者之间相互差异显著(P<0.05,图3)。

图3 不同培养基培养对草鱼肌纤维迁出时间和达到首次传代时间的影响Fig.3 Effects of different media on the time of muscle fiber migration and first passage of grass carp
2.3 不同培养基对草鱼肌纤维贴壁率的影响
草鱼肌纤维在接种2 h、4 h、6 h、8 h 和10 h 后的贴壁率情况如图4 所示。不同培养基的贴壁率曲线均呈现先快速后逐渐变缓的上升趋势,均在10 h达到最大值(P<0.05)。对比同一时间节点不同培养基中细胞的贴壁率,可以看出,在各个时间节点M199 和DMEM 的草鱼肌纤维贴壁率显著高于L-15,而除2 h 和6 h 的时间点外,M199 要显著高于DMEM(P<0.05)。

图4 不同培养基对草鱼肌纤维贴壁率的影响Fig.4 The effect of different media on the adhesion rate of grass carp muscle fibers
2.4 不同培养基对草鱼肌纤维生长的影响
由图5 可见,DMEM、M199 和L-15 培养的P2代草鱼肌纤维细胞生长曲线基本都呈S 型,DMEM、M199 和L-15 培养的细胞分别在5 d、3 d、5 d 进入对数生长期,细胞增殖加速,细胞密度快速升高,分别在6 d、5 d、6 d 达到峰值,随后呈下降趋势(P<0.05)。不同培养基的细胞扩增数量不同,对比同一培养基不同时间点的细胞密度,在进入第4 d 以后,均以L-15 培养的最低,M199 最高,DMEM居中(P<0.05)。

图5 草鱼肌纤维在不同培养基中的生长曲线Fig.5 Growth curve of grass carp muscle fibers
如图6 所示,M-199 和DMEM培养的草鱼肌纤维72 h 平均扩增倍数分别为(20.58±4.67)和(18.66±4.33),二者差异不显著,但均显著高于L-15 组的(8.19±4.17,P<0.05)。
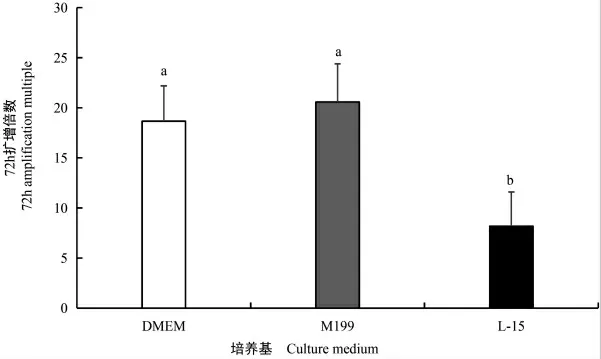
图6 不同培养基培养对草鱼肌纤维增殖的影响Fig.6 The effect of different media on the proliferation of grass carp muscle fibers
2.5 不同培养基培养对细胞活力的影响
不同培养基在培养草鱼肌纤维72 h 后的细胞活力结果显示,M199 培养的草鱼肌纤维平均OD 值为(1.03±0.17,P<0.05),显著高于DMEM 和L-15的平均OD 值(0.06±0.02)和(0.05±0.02)(P<0.05),而后两者吸光度值没有明显区别(图7)。

图7 不同培养基培养对细胞活力的影响Fig.7 The effect of different culture media cultures on cell viability
3 讨论
用于鱼类细胞原代培养的方法主要有酶消化法和组织块法。组织块法简单、高效、便捷,适合于各种组织细胞的原代培养。组织块给细胞提供了适宜的生存环境,使迁出的细胞更容易贴壁和生长[13],与酶消化法相比,组织块法培养的细胞具有更高的增殖速率和细胞活力[14]。这得益于组织块培养的细胞减少了机械分离所带来的损害,没有离开稳定的生长环境,较好地保存了细胞的完整性[15],且组织块可以释放促进细胞增殖和生长的生长因子和细胞因子到培养液中刺激细胞生长[16]。但组织块培养存在培养周期长、培养液的浮力容易使部分组织块浮起而致细胞活力丧失等不足[17]。此外,组织块剪切的大小以及组织块之间的间距也会对培养效果造成较大影响[18]。
在细胞体外培养的诸多影响因素中,培养基是最直接的影响因素,对细胞生长状态和增殖潜力都有明显影响,因此,寻求适合草鱼肌纤维体外培养的培养基以在短时间内得到细胞形态好、数量较多的草鱼肌纤维用于草鱼营养生理,肌肉品质等的研究就显得异常关键。实验表明,DMEM(高糖)、M199和L-15 三种培养基均能够促进草鱼肌纤维的贴壁和生长增殖,但不同培养基中的草鱼肌纤维细胞形态、细胞开始迁出时间、第一次传代时间、细胞增殖速度、贴壁率以及细胞活力等方面都存在差异。其中M199 促进草鱼肌纤维贴壁以及生长增殖的效果最好,表现在较高的细胞贴壁率、细胞扩增倍数以及OD 值。谭风霞[19]在胭脂鱼肌肉细胞原代培养中发现M199 和L-15 中的肌肉细胞培养效果最好,且两者细胞培养效果没有明显差异;祝冬梅[20]发现,相比 于L-15、DMEM-F12、MEM 和RPMI-1640 四种培养基,团头鲂肌肉细胞在M199 中增殖速度最快,培养效果最好;而付思思等[21]用L-15 原代培养锦鲤肌肉组织15 d 后,肌肉细胞才开始从组织块中迁移出来,这与本实验结果类似,可以看出L-15 并不是鱼类肌肉细胞的首选培养基;焦健刚[26]发现,草鱼肌肉细胞在20%FBS 的DMEM 高糖培养基中正常贴壁,增殖适中,通过提高DMEM 高糖培养基中FBS 的浓度,细胞的增殖速度会相应提高。本实验发现在含20%FBS 的M199、DMEM和L-15 三种培养基中,草鱼肌肉细胞的原代培养在M199 培养基中增殖速度快,可以缩短草鱼肌肉细胞原代培养时间。
细胞培养需要足够的维生素和氨基酸等营养成分以满足细胞生长需求。氨基酸作为蛋白质的构件分子,在细胞培养中是不可缺少的成分。氨基酸的缺乏会造成蛋白质的合成受阻,进而影响到这些蛋白质所承载的生理功能,对细胞的状态,细胞高密度的维持,以及蛋白产量等方面都产生重要影响。而维生素是一类维持细胞生长增殖的生物活性物质,在细胞代谢方面有重要作用[22],如在细胞中形成酶的辅酶或辅基,没有它们,酶便没有活性,代谢活动将无法进行。血清是氨基酸和维生素等营养物质的重要来源,但是许多合成培养基中添加了各种氨基酸和维生素以适合更多的细胞系生长。相比于DMEM 和L-15 培养基,M199 培养基中添加了更多种类的氨基酸和维生素,含有22 种氨基酸和17 种维生素。据有关研究表明,氨基酸和维生素品类丰富的培养基更加有利于细胞生长[23]。
培养中的细胞可以进行有氧与无氧酵解,六碳糖是主要能源。对于单糖而言,细胞对葡萄糖的吸收能力最高,半乳糖最低,但培养基高浓度的葡萄糖添加会对细胞生长产生影响。高浓度葡萄糖代谢会产生较多对细胞有毒性的酸性的代谢产物,这些代谢产物降低了营养物质的代谢效率,降低培养基pH,破坏细胞生存环境,从而抑制了细胞的生长[24]。而较低浓度的葡萄糖在提供给细胞充足能量的同时又减少了酸性代谢产物的产生,有利于细胞的生长增殖,减少细胞的凋亡[25]。焦健刚[26]在进行草鱼肌肉组织的原代培养时发现,DMEM高糖培养基不利于草鱼肌肉细胞的生长,而草鱼肌肉细胞在低糖乃至无糖的DMEM中可以较好生长。L-15 用半乳糖替代葡萄糖作为碳源,可以有效减少培养液中乳酸累积的浓度,维持细胞正常生长的生理pH,有利于细胞生长。但是在用半乳糖作为替代碳源的情况下,会对细胞产物的表达和糖基化修饰造成不利影响,这可能与细胞内能量供应不足以及细胞代谢产生较高浓度的氨有关[27]。本实验中M199、DMEM培养基中的葡萄糖质量浓度分别为1 000 mg/L 和4 500 mg/L,而L-15 用半乳糖替代葡萄糖,这可能是造成细胞生长分化能力在不同培养基中出现较大差异的原因之一。
综上所述,培养基是细胞体外培养的重要生长环境,本实验表明,相比于DMEM和L-15,M199 对于草鱼肌纤维的生长具有更好的促进作用,是比较适合草鱼肌纤维的原代培养的培养基。

