双通道结构光照明超分辨定量荧光共振能量转移成像系统*
罗泽伟 武戈 陈挚 邓驰楠 万蓉 杨涛 庄正飞 陈同生†
1)(华南师范大学生物光子学研究院,教育部激光生命科学重点实验室,广州 510631)
2)(华南师范大学生物光子学研究院,广东省激光生命科学重点实验室,广州 510631)
基于结构光照明(structured illumination,SI) 的超分辨荧光共振能量转移(super resolution fluorescence resonance energy transfer,SR-FRET) 成像技术(SISR-FRET) 可以通过解析活细胞内亚衍射区域的FRET 信号来研究细胞器精细结构上的分子结构与功能.SISR-FRET 成像中激发发射通道切换导致成像速度较慢,限制了SISR-FRET 在快速成像中的应用.针对此问题,本文提出一种双通道结构光照明超分辨定量FRET 成像系统和方法,通过在成像光路中加入FRET 双通道成像和配准模块,实现了SISR-FRET 激发发射通道的空分切换以及通道复用.结合通道亚像素配准校正的图像重建算法,双通道SISR-FRET 可以在保持定量超分辨FRET 分析的同时提升了3.5 倍时间分辨率.利用搭建的多色SIM 系统进行了活细胞表达靶向线粒体外膜FRET 标准质粒的超分辨成像实验,验证了双通道SISR-FRET 的时空分辨率增强和FRET 定量分析的保真度.
1 引言
荧光共振能量转移(fluorescence resonance energy transfer,FRET) 显微成像术在活细胞中原位定量检测生物大分子间动态相互作用及空间分布方面具有独特优势.在细胞生命活动中,蛋白质与其他生物分子形成复杂相互作用和调节网络,原位研究蛋白质-蛋白质相互作用的时空分布和功能关系是目前生命科学的重要课题之一[1,2].尽管荧光显微成像技术和荧光标记技术的发展为研究蛋白质-蛋白质相互作用提供了有利的条件,目前已有的蛋白间互作研究方法仍无法在活细胞内同时实现蛋白结构功能和空间分布动态变化的解析[3].FRET 利用分子间共振能量转移速率与距离6 次方反比的关系来度量1—10 nm 尺度分子的接近程度,该物理过程非常适合于表征分子构象变化和分子间相互作用[4].通过定量计算FRET 表观效率(ED,EA) 和总受体与供体的浓度比(RC),定量FRET 实现了活细胞内动态蛋白互作的“可视化”,并为揭示蛋白复合物形成过程中亲和力和化学计量比的测量提供了独特见解[5,6].以上优势使得定量FRET 显微成像技术正成为研究蛋白质调控网络和信号转导途径、疾病机制和药物筛选的重要工具[7-9].
超分辨FRET 显微成像术(super resolution FRET,SR-FRET) 为研究亚细胞器精细结构上的分子结构及其功能开辟了新道路.受限于衍射极限对显微成像空间分辨率的约束,FRET 显微成像分辨能力存在瓶颈,这使得传统FRET 显微成像在观测亚细胞区域内蛋白分子相互作用及空间定位时只能解析常规荧光显微镜分辨率约束下多分子事件的平均行为[10].近年来超分辨荧光显微成像技术的发展极大提升了亚细胞器精细结构动态变化的解析力,因此将超分辨显微与FRET 成像功能融合并实现SR-FRET 显微成像获得了学界的广泛关注[11,12].实现超分辨FRET 显微成像的难点主要包括:1) 如何从重新分布的超分辨光场中定量解析出FRET 信号;2)如何在有限光通量和光漂白条件下平衡时空分辨率提升与FRET 定量计算保真度.目前,基于单分子定位显微术(single molecule localization microscopy,SMLM) 和受激发射耗尽显微术(stimulated emission depletion microscopy,STED) 的SR-FRET 成像技术利用有机荧光染料标记的FRET 固定样品实现了FRET信号的超分辨解析[13-15].然而基于SMLM 的SRFRET需要收集供体和受体分子同时处于光激发活化状态时的FRET 信号,这对于互相独立闪烁的供受体对来说十分困难,极长的成像时间也使得该技术与研究活细胞中发生的动态过程很难兼容[10].对于基于STED 的SR-FRET,STED 损耗光改变了供体的激发态寿命并导致供体和受体分子的不均匀光漂白,这种调制过程使得STED FRET 只能得到半定量的FRET 指数而不能完成定量FRET测量[15].针对以上问题,本课题组开展了结构光照明显微术(structured illumination microscopy,SIM)和定量FRET 融合的探索[16].由于SIM 显微术相比其他SR 成像技术具有照明光强度低、成像速度快的优势,融合SIM 和FRET 技术可能实现目前最佳平衡时空分辨率和光漂白影响的SR-FRET成像术[17-22].为了消除SIM 重建伪影对定量FRET的影响,本课题组设计了一种基于结构光照明超分辨FRET 两步重建方法(SISR-FRET),该方法依次完成三通道SIM 图像的线性重建和基于共同定位掩模滤波的FRET 定量解析.两步过程可以确保重建的SR-FRET 信号的保真度,同时可以精确去除由SIM 伪影引起的假阳性FRET 信号.与传统的宽场FRET 成像相比,SISR-FRET 保持了定量特性并实现了活细胞中120 nm 空间分辨率解析亚细胞器精细结构上的FRET 信号[23].
实现快速结构光照明超分辨定量FRET 成像是目前活细胞SR-FRET 研究的迫切需要.对于SISR-FRET,完成一次成像需要采集结构光调制下的三通道27 张原始图像组,如果被成像的FRET样本在拍摄总时间内移动距离超出了系统点扩散函数(point spread function,PSF) 范围,则重建的超分辨图像就会出现运动伪影并导致FRET 结果失真[24].尽管传统基于滤光片转轮的时分FRET三通道切换方案具有切换灵活、无需通道对准等优点,机械转盘切换速度慢的缺点限制了SISR-FRET快速成像[25].针对以上问题,本文提出一种双通道结构光照明超分辨定量FRET 成像系统和方法,通过在成像光路中引入FRET 双通道探测和对准模块,双通道SISR-FRET 系统实现了FRET 通道的空分切换.进一步地,通过优化系统时序控制以及加入通道亚像素对准算法,双通道SISR-FRET系统实现了快速三通道成像并保持通道亚像素精度对准,最终相比于基于滤光片转轮的时分FRET三通道切换方案有效提升了3.5 倍的时间分辨率.利用该系统对活细胞表达靶向线粒体外膜的FRET标准质粒进行成像,验证了双通道SISR-FRET 的时空分辨率增强和FRET 定量分析的保真度.
2 双通道SISR-FRET 系统与方法
2.1 成像系统设计与搭建
完成一次SISR-FRET 成像首先需要收集供体激发供体发射(DD 通道)、供体激发受体发射(DA 通道) 和受体激发受体发射(AA 通道) 3 个通道结构光照明调制的原始图像组.每一个激发发射通道的原始图像组由3 个不同结构光方向角,每个结构光方位角包含3 个不同相位差的余弦结构光调制的宽场荧光图像构成.三通道原始数据的强度分布可以由下式表示:
其中下标θ(1,2,3)和n(-1,0,1) 表示余弦照明的方向角和相位差,上标X(=DD,DA,AA) 表示FRET 通道,S(r) 表示样本荧光信号的空间分布,分别是余弦结构光场的调制深度、照明频率矢量和初相位,HX(r) 表示不同FRET 通道X(=DD,DA,AA) 对应的点扩散函数(PSF).

图1 双通道SISR-FRET 系统光路示意图Fig.1.Schematic diagram of dual-channel SISR-FRET system.
2.2 双通道SISR-FRET 重构方法
在进一步FRET 计算之前,需要对三通道SRFRET 图像进行预处理.由于双通道成像系统存在通道配准的问题,除了在系统硬件配准模块上进行像素级别的通道对准,还需要通过配准算法实现FRET 三通道进一步的亚像素级对准,以保证FRET逐像素计算时的精度.DA 和AA 通道图像由于通道的复用关系不需要额外对准,因此配准算法以DD通道SR 重建图像为基准,通过将DA,AA 通道图像与仿射变换相乘来实现与DD 通道图像的亚像素级对准.仿射变换矩阵T通过以下最优化方法获得:
其中xt,yt为仿射变换矩阵的平移参数,θ,s分别表示旋转和缩放补偿参数.
另一方面,FRET 定量计算需要考虑背景灰度的影响.实验中对每个FRET 成像通道的超分辨图像进行逐像素灰度值统计,并以灰度值直方图中第1 个峰值对应的灰度值作为该视野的背景灰度值(XDD,DA,AA).接着对图像进行背景修正并将负的像素灰度值置零,得到每个成像通道的修正图像.具体过程表示为
FRET 三通道原始图像组在采集过程中不可避免产生噪声,这些噪声会经过SR-SIM 线性重建放大产生重建伪影并严重影响FRET 定量分析.由于噪声伪影是随机叠加在FRET 三通道图像上,其空间分布彼此独立,因此这种伪影在三通道图像间具有非常低的相关性.相反,当FRET 发生的必要条件是供受体荧光分子靠近到10 nm 尺度内,这样供体和受体分布将展现出极强的共定位特征,即超过随机噪声图像间的强相关性.因此可以利用以上先验信息设计共同定位掩模来抑制重建伪影的干扰.为了定量表征FRET 信号和噪声在不同成像通道之间差异,逐像素的共定位分析可以表示如下:
其中 PCCmap(r) 是供体和受体图像中每个像素对皮尔逊相关系数(PCC)的权重分布图,MOCmap(r)是供体和受体图像中每个像素对曼德斯相关系数(MOC)的权重分布图.是经过背景扣除后的DD 通道图像的灰度平均值,经过背景扣除后的AA 通道图像的灰度平均值.将 PCCmap(r) 和MOCmap(r)相乘得到混合共定位权重矩阵,并通过自适应阈值处理算法进行混合共定位权重矩阵的分割生成二值化掩膜板Bcolocalmask(r),可以如下表示:
经过以上图像预处理后,SISR-FRET 计算供体为中心的FRET 表观效率ED和总受体与供体的浓度比RC由如下公式得到:
其中,FcSIM为受体敏化发射荧光强度,G为敏化淬灭转化因子,K为供受体浓度转化因子,a,b,c,d为系统串扰系数.
总结双通道SISR-FRET 算法流程图如图2所示,实施SISR-FRET 需要以下3 个步骤:1)使用三通道原始数据重建三通道SR 图像(XDD,DA,AA);2) 通过图像预处理过程,对重建的三通道SR 图像进行背景扣除,通道对准和共定位掩膜滤波模板生成;3) 对预处理后的三通道SR 图像中定量计算FRET 效率(ED)和受供体浓度比(RC).
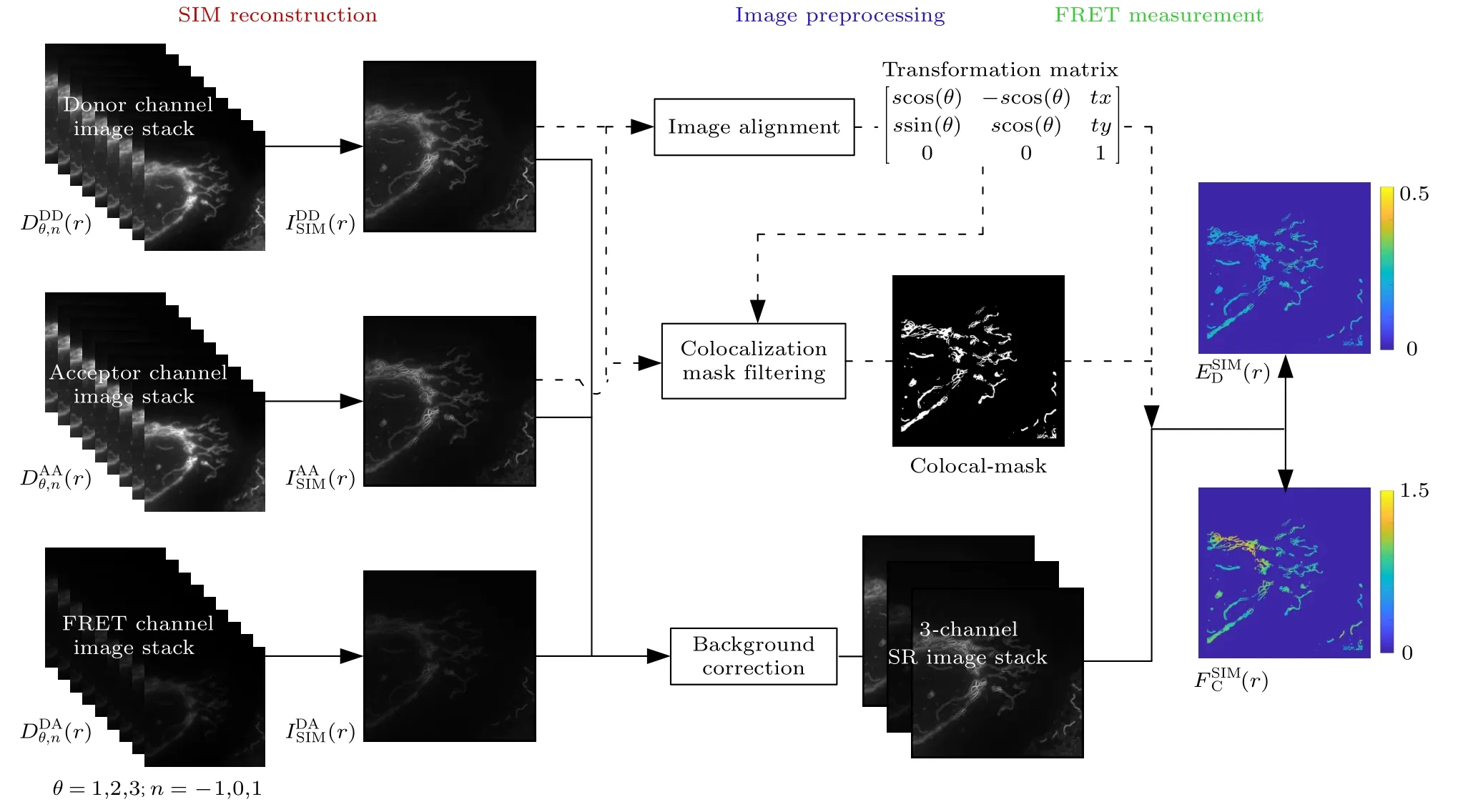
图2 双通道SISR-FRET 的算法流程图Fig.2.Flow chart of dual-channel SISR-FRET algorithm.
2.3 控制系统的设计与优化
根据2.1 和2.2 节的内容,完成一次SISRFRET 成像需要采集结构光调制下的三通道27 张原始图像组.其中一组典型的FERT 三通道原始数据采集时序如图3 所示.采集过程首先由上位机发送指令给下位机,随后下位机发出精确同步控制信号给SLM、激光器、机械转盘以及两台sCMOS相机.对于单通道SISR-FRET,下位机发出同步信号给SLM 进行结构化图案显示,同时开启激光器并打开相机曝光完成一次拍摄.在等待相机读出以及SLM 暗图像刷新的时间内,下位机发送触发信号关闭激光器并使能机械转盘完成FRET 通道切换,重复以上过程3次,即可完成一组FERT 原始数据采集并将数据传输给上位机.为了加快转盘切换速度,单通道SISR-FRET 采用快速机械转盘(FW103,Throlabs),该器件的最小通道的切换时间为50 ms.根据经验设定相机典型单帧曝光时间为10 ms,图像采集区域大小为512×512@16 bit,此时转盘完成切换的时间制约了整个系统成像速度,该方案可实现的一组FERT 三通道原始数据采集时间为140 ms(图3(a)).由于双通道SISRFRET 将基于滤光片转轮的时分FRET 三通道切换方案替换为基于二项色镜分光的空分方案,期间无需转动机械转轮来切换不同波长的发射滤光片,此时制约成像系统进行下一组曝光的等待时间则由相机的读出时间和SLM 的负图像显示时间来确定.另一方面,由采用双通道方案,一次激发可以在两个发射通道实现同时成像(DD&DA).相比传统基于滤光片转轮的时分FRET 三通道切换方案需要切换3 次才能完成图像采集,双通道FRET成像系统只需两次成像即可完成,从而将相机曝光读出时间占比进一步减少了1/3.在此方案下,双通道方案在曝光时间相同的情况下完成一组FRET三通道原始数据采集时间为40 ms,相应系统时间分辨率从原来的约1 帧/s 提升为3 帧/s,实现了约3.5 倍的时间分辨率提升.
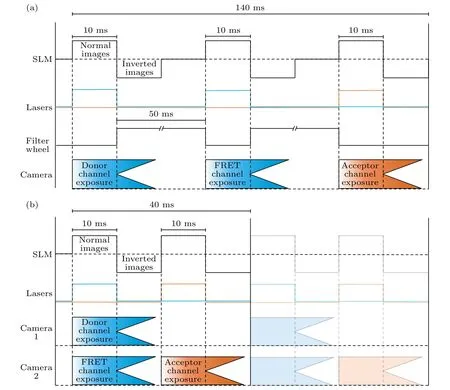
图3 双通道SISR-FRET 与单通道SISR-FRET 时序图对比(a)单通道SISR-FRET 在一个FRET 采集周期的时序图;(b)双通道SISR-FRET 相同周期的时序图Fig.3.Comparison of timing sequence of dual-channel SISR-FRET and single-channel SISR-FRET:(a) Timing sequence of singlechannel SISR-FRET in one FRET acquisition cycle;(b) timing sequence of dual-channel SISR-FRET in the same cycle.
3 成像结果与讨论
为了验证双通道SISR-FRET 系统在活细胞中超分辨FRET 成像能力,使用表达靶向线粒体外膜的FRET 标准质粒(ActA-G17M) 的MCF-7 细胞样本进行系统测试.ActA-G17M 融合了线粒体外膜靶向蛋白ActA 和FRET 标准质粒G17M,其中G17M 由GFP 和mCherry 之间连接17 个氨基酸构成.该质粒的理论FRET 表观效率(ED)为0.2,受体与供体的浓度比(RC) 为1.
利用该样本首先对系统双相机超分辨成像结果的通道对准进行标定,结果如图4 所示.图4(a)为样本在DD 和AA 通道超分辨成像的伪彩图,图4(b)为DD 和AA 通道超分辨成像只经过系统硬件进行通道对准时的叠加效果图,可以明显观察到AA 通道对比DD 通道图像像素的整体向下的错位.经过双通道SISR-FRET 图像对准算法处理后,可计算得到最优对准效果的仿射变换矩阵T为[1,0,-0.85],[0,1,-3.32],[0,0,1].此时经过仿射变换矩阵校正后的DD&AA 叠加效果图如图4(c) 所示,其相比于图4(b) 对准效果明显提升,在整个视野内DD&AA 通道线粒体外膜精细结构表现出很好的重合,证明了对准算法在进行亚像素精度对准的有效性以及SISR-FRET 成像系统的成像质量.

图4 双通道SISR-FRET 通道对准效果(a) DD 通道和AA通道成像结果的伪彩图,绿色为DD 通道,红色为AA 通道;(b)未经过算法对准的DD 通道和AA 通道成像结果叠加图;(c)经过仿射变换矩阵对准的DD 通道和AA 通道成像结果叠加图.比例尺:2 μmFig.4.Dual-channel SISR-FRET alignment results:(a) Pseudo-color image of DD channel and AA channel imaging results,green is DD channel,red is AA channel;(b) overlay of the imaging results of DD channel and AA channel without algorithm alignment;(c) overlay of DD channel and AA channel imaging results after affine transformation matrix alignment.Scale bar:2 μm.
为了测试双通道SISR-FRET 系统的超分辨成像能力,对表达ActA-G17M 质粒的MCF7 细胞进行了定量超分辨FRET 成像.为获得采样速度和收集光子计数之间的最佳平衡,单帧图像的曝光时间设置为10 ms,相应总的双通道SISR-FRET测量时间分辨率约360 ms.在此参数设置下,三通道超分辨图像重建结果如图5 所示.图5(a)—(c)分别为DD,DA,AA 通道对ActA-G17 M 宽场成像结果,图5(d)—(f) 分别为DD,DA,AA 通道对ActA-G17M 超分辨成像结果.一些在宽场成像中无法区分的相邻线粒体外膜精细结构在超分辨图像得到清晰解析.证明当前系统进行FRET 三通道超分辨成像时分辨率提升的有效性.

图5 双通道SISR-FRET 成像系统对ActA-G17 M 样本成像结果(a)—(c) DD,DA,AA 通道宽场成像结果;(d)—(f) DD,DA,AA 通道超分辨成像结果.比例尺:2 μmFig.5.Imagingresultsofthedual-channelSISR-FRETimaging systemfor the ActA-G17Msample:(a)-(c)Wide-fieldimagingresults intheDD,DA,andAAchannels;(d)-(f)super-resolution imagingresults in theDD,DA,and AAchannels.Scalebar:2μm.
为了测试双通道SISR-FRET 系统的超分辨定量FRET 分析能力,对图5 中三通道超分辨FRET图像进一步进行定量FRET 分析,结果如图6 所示.图6(a) 和图6(c) 分别展示了宽场FRET 和超分辨FRET 效率ED和受供体浓度比RC的空间分布,可以清晰看到双通道SISR-FRET 重建算法对FRET 空间分辨能力的提升.另一方面图6(b),(d)分别展示了宽场FRET 和超分辨FRET 效率ED和受供体浓度比RC的逐像素统计结果,可以看出SISR-FRET 和宽场FRET 一样可以正确解析ActA-G17 M 质粒的ED和RC,但是由于SISRFRET 组DA 通道的信噪比较低,最终导致SISRFRET 统计直方图的半高全宽相比传统宽场FRET 结果得到了展宽.

图6 双通道SISR-FRET 成像定量FRET 分析结果对比(a)宽场FRET 和超分辨FRET 效率ED 的伪彩图;(b)图(a)中结果的统计直方图;(c)宽场FRET 和超分辨FRET 受供体浓度比 RC 的伪彩图;(d) 图(c)中结果的统计直方图.比例尺:2 μmFig.6.Comparison of quantitative FRET analysis results from dual-channel SISR-FRET imaging:(a) Pseudo-color map of ED for wide-field FRET and super-resolution FRET;(b) corresponding statistical histograms;(c) pseudo-color plot of RC for wide-field FRET and super-resolution FRET;(d) corresponding statistical histograms.Scale bars:2 μm.
为了定量比较双通道SISR-FRET 成像分辨率对比宽场FRET 的提升,现将图5 和图6 结果进行了重叠比较,结果如图7(a),(b) 所示,线粒体外膜的结构分布和经过共定位掩膜滤波的FRET效率空间分布有着良好的重合,证明SISR-FRET具备在活细胞中定量解析精细结构上FRET 信号的能力.其中图7(a),(b) 局部放大的线粒体外膜结构FRET 信号在宽场FRET 成像下无法分辨,而在SISR-FRET 成像下可以清晰区分(图7(c)—(f)).
4 结论
本文提出和搭建了一套双通道结构光照明超分辨定量FRET 成像系统.该系统实现了SISRFRET 激发发射通道的空分切换以及通道复用,提升了约3.5 倍的时间分辨率.相比传统的宽场FRET 技术,双通道SISR-FRET 具有更高的时空分辨率,能够更准确地定位和解析供受体之间的FRET 信号,从而提高解析活细胞内精细结构上分子互作的能力.通过将双通道SISR-FRET 技术应用于亚细胞器尺度的蛋白相互作用过程的精确定量检测中,可以直观地展示亚细胞器的空间结构变化以及蛋白的定位关系.这对于揭示活细胞中细胞核、线粒体和内质网等生物大分子生成和执行功能的场所精细结构上的分子结构及其功能具有重要意义.通过这项技术,能更深入地了解细胞内复杂的分子动态过程,为研究生物体的功能和机制提供有力的工具.

