亚麻木酚素干预下ApoE基因敲除小鼠肝脏转录组分析*
谢懿德,杨奕樱,徐昌君,陈宏宇,胡 碟,胡明补,夏一霞,胡英潭,于 莹
(贵州中医药大学,贵州 贵阳 550025)
高脂血症(Hyperlipidemia,HLP)是一种脂质代谢异常的疾病,是诱发冠心病、脑血栓、动脉粥样硬化等心脑血管疾病的重要危险因素。近年来,临床上用于治疗高脂血症的药物主要包括他汀类、胆固醇吸收抑制剂、胆酸螯合剂类、贝特类、烟酸类等药物。虽然这些药物疗效显著,但已发现具有一定的不良反应,如肝肾损伤、横纹肌溶解、诱发糖尿病等[1]。越来越多的学者开始关注临床疗效良好、且不良反应小的天然降血脂生物活性物质,如苦菜黄酮[2]、葡萄多酚[3]、黑木耳多糖[4]、火麻籽多肽[5]、亚麻木酚素[6]等。
亚麻木酚素是一种存在于亚麻籽种皮中的活性物质,被认为是一种植物雌激素,具有多种药理作用。研究表明,亚麻木酚素在改善高脂血症方面具有良好的作用。Prasad[7]实验表明,对高胆固醇膳食饲养的家兔给予亚麻木酚素干预,明显降低了血浆中丙二醛、总胆固醇(Total cholesterol,TC)和低密度脂蛋白胆固醇(Low-density lipoprotein cholesterol,LDL-C)的水平,并增加了高密度脂蛋白胆固醇(High-density lipoprotein cholesterol,HDL-C)的水平。Zhang等[8]以高胆固醇血症患者为研究对象,发现与对照组相比亚麻木酚素治疗组患者血中甘油三酯(Triglyceride,TG)、TC、HDL-C、LDL-C均显著降低。Pan等[9]研究发现,经过12周试验较安慰剂组,每天接受360 mg亚麻木酚素干预的2型糖尿病患者的TC、LDL-C、HDL-C和血糖均显著下降。我们前期实验也发现,亚麻木酚素组中HDL-C含量增加,LDL-C、TG、TC含量降低,推测亚麻木酚素具有一定的调节血脂的作用。但关于亚麻木酚素降血脂的分子机制研究报道较少。
肝脏是脂质代谢的重要器官,一方面可以通过极低密度脂蛋白受体摄取富含TG的脂质颗粒,另一方面可在内质网上通过微粒体三酰甘油转运蛋白,将PL(Phospholipid,PL)、TC、Apo(Apolipoprotein,Apo)、TG形成极低密度脂蛋白分泌出肝细胞,从而维持血浆中TG、TC等脂质平衡[10]。分析高脂血症小鼠肝脏中基因表达的变化对于研究高脂血症小鼠血脂变化机理具有重要作用。随着高通量测序技术的发展,组学技术已经被广泛的应用到人类疾病的研究中。哥伦比亚大学的研究人员[11]基于转录组测序及组织特异性基因表达数据库,有效地提高了罕见遗传病的检测效率。瑞典的研究团队[12]利用转录组测序技术对人类血细胞开展了全面的表达分析,有助于人们更好地了解免疫系统疾病。Styrkarsdottir等[13]利用基因组和转录组测序技术,联合分析了基因型与髋关节骨关节炎患病风险之间的关系。组学技术使得我们可以在分子水平上获得大量与疾病相关的基因,利于疾病分子机制的研究。
本文利用野生型C57BL/6J小鼠和ApoE-/-高脂血症小鼠,以亚麻木酚素作为干预药物,利用转录组测序技术分析了亚麻木酚素干预下高脂血症小鼠肝脏基因表达的情况,鉴定了关键差异表达基因和富集的信号通路,为深入研究亚麻木酚素改善高脂血症小鼠的作用机制提供更多依据。
1 材料与方法
1.1 材料与试剂
亚麻木酚素(40%),西安圣青生物科技有限公司;高脂饲料(40 kcal 1%脂肪、1.25%胆固醇、0.5%胆酸钠,货号D12109C),重庆腾鑫生物技术有限公司;辛伐他汀,上海源叶生物科技有限公司;TRIzol,美国Invitrogen公司;DNase I,美国Promega公司。
1.2 仪器与设备
Agilent 2100,美国安捷伦公司;Illumina HiSeq2000测序仪,美国Illumina公司;H1850-R台式高速冷冻离心机,湖南湘仪离心机仪器有限公司。
1.3 方法
1.3.1 动物实验设计及样品采集
8周龄的野生型C57BL/6J SPF级雄性小鼠和ApoE-/- SPF级雄性小鼠购买于重庆腾鑫生物技术有限公司(实验动物质量合格证编号:No.110324210102443554)。分笼喂养,自由饮水。普通饲料适应性喂养1周后随机分成4组:正常对照组(CG,野生型C57BL/6J小鼠10只),模型组(HG,ApoE-/-小鼠10只),辛伐他汀干预组(SG,2 mg/kg,ApoE-/-小鼠10只),亚麻木酚素干预组(FLG,0.6 g/kg,ApoE-/-小鼠10只)。给药方式采取每天灌胃,正常组给予等容量生理盐水灌胃。干预4周后,12 h禁食不禁水。小鼠麻醉后颈椎脱臼处死,解剖后迅速取出肝脏。肝脏装于EP管中,经液氮速冻处理后放置于-80 ℃冰箱保存,以备转录组测序检测。
1.3.2 小鼠肝脏RNA提取和转录组建库测序
采用TRIzol试剂提取小鼠肝脏总RNA,并用DNase I消化基因组DNA,再使用Oligo(dT)磁珠分离mRNA。将mRNA消化成短片段,以mRNA片段为模板合成cDNA。纯化cDNA,进行末端修复和单核苷酸腺嘌呤添加,然后将短片段连接到接头上。选择合适大小的片段,进行PCR扩增。构建好的文库用Agilent 2100生物分析仪质检合格后,使用Illumina HiSeq 2000测序仪进行高通量测序,以上内容在深圳华大基因科技服务有限公司进行。
1.3.3 转录组数据分析
将测序得到的原始数据进行控制评估,通过去接头、低质量数据过滤筛选等步骤,得到高质量的数据(clean reads)。将clean reads与参考基因组注释信息(http://www.phytozome.net/)进行比对[14],基因的表达水平通过RSEM来计算[15]。差异基因的表达量用DESeq2软件进行计算,Q值(校正的P值)≤0.05为阈值,将满足此条件的差异表达基因DEGs(Differentially expressed genes,DEGs)进行统计分析。根据GO(Gene ontology,GO)分类数据库(http://www.geneontology.org/),将DEGs分类富集到相应的特定生物功能的类别中。首先把所有候选基因向GO数据库的各个条目映射,计算每个条目的基因数,然后应用超几何检验,找出与本物种所有背景基因相比,在候选基因中显著富集的GO条目。使用R的基础函数phyper(https://stat.ethz.ch/R-manual/R-devel/library/stats/html/Hypergeometric.html)计算P值。然后对P值进行多重检验较正,校正软件包是qvalue(https://bioconductor.org/packages/release/bioc/html/qvalue.html)。最后以Q值≤0.05为阈值,满足此条件的GO term定义为在候选基因中显著富集的GO term。利用KEGG(Kyoto encyclopedia of genes and genomes,KEGG)数据库(http://www.genome.jp/kegg/)对DEGs进行代谢途径或信号通路富集分析[16]。以KEGG Pathway为单位,应用超几何检验,找出与整个基因组背景相比,在候选基因中显著性富集的Pathway。该分析与GO功能富集分析使用同样的方法。最后Q值≤0.05的Pathway定义为在差异表达基因中显著富集的Pathway。通过Pathway显著性富集能确定候选基因参与的最主要生化代谢途径和信号转导途径。
1.4 数据释放
本研究结果的数据已提交保存在CNSA(China Nucleotide Sequence Archive ,CNSA)中(https://db.cngb.org/cnsa/),注册号CNP0003322。
2 结果与分析
2.1 转录组测序数据概况
为了研究亚麻木酚素对肝脏脂质代谢功能的影响,我们利用转录组测序技术对各组小鼠肝脏的差异表达基因进行了分析。构建了12个小鼠肝脏cDNA文库,利用Illumina HiSeq2000技术测序平台进行转录组测序。对测序数据进行质量评估和基础分析。结果表明,测序样品平均产出6.65G数据,样品比对基因组的平均比对率为94.64%,比对到参考基因组唯一位置的比对率均大于81%,Q20值均大于96%,Q30值均大于91%(表1),这表明测序的数量和质量达到了后续分析的要求。

表1 转录组数据过滤及参考基因组比对结果
2.2 差异表达基因分析
为了进一步了解不同小鼠肝脏中差异表达基因情况,我们分析了不同样本间显著差异表达基因,包括上调基因和下调基因,基因差异表达分析时以Q值(校正的P值)≤0.05为阈值进行统计分析。结果表明,亚麻木酚素组和模型组之间的DEGs最多,有372个(234个上调,138个下调),说明亚麻木酚素的干预产生了一定的效果;亚麻木酚素组和辛伐他汀组之间的DEGs最少,只有7个(4个上调,3个下调),说明亚麻木酚素干预和辛伐他汀干预效果类似(图1)。

注:X轴代表每组差异比对方案;Y轴代表相应的差异基因(DEGs)数量;黑色代表上调的DEGs数,灰色代表下调的DEGs数。
为了进一步分析亚麻木酚素干预和辛伐他汀干预效果的情况,我们将辛伐他汀组/模型组和亚麻木酚素组/模型组的差异表达基因进行了比较分析,列出了两组间相同的上调和下调的前十个基因(表2)。结果表明,亚麻木酚素组/模型组差异基因上调幅度大于辛伐他汀组/模型组,下调幅度小于辛伐他汀组/模型组。这些共同上调表达的差异基因包括羟基-δ-5-类固醇脱氢酶(Hydroxy-delta-5-steroid dehydrogenase,Hsd3b5)、酰基辅酶A硫代酯酶1(Acyl-CoA thioesterase 1,Acot1)、超长链脂肪酸的伸长蛋白(Elongation of very long chain fatty acids-like 3,Elovl3)等与脂质代谢相关的基因,说明在亚麻木酚素干预下,小鼠肝脏中与脂质代谢相关的基因表达发生了显著变化。

表2 差异表达基因列表
2.3 差异表达基因的GO分类及富集分析
利用GO数据库进行亚麻木酚素组和模型组之间差异表达基因的富集分析,将排名前20的生物学过程、细胞组分、分子功能的分组进行汇总(图2)。结果表明,生物学过程的分组包括脂肪酸代谢过程、脂质代谢正调控、脂质生物合成的负调控等,细胞组分的分组包括细胞外间隙、内质网、细胞器膜等,分子功能的分组包括单加氧酶活性、氧化还原酶活性、类固醇羟化酶等。其中与脂质代谢相关的富集分组中的差异表达基因是我们重点关注的内容。

注:X轴代表候选基因数目,Y轴代表GO term。
2.4 差异表达基因的KEGG代谢途径富集分析
利用KEGG数据库进行亚麻木酚素组和模型组之间差异表达基因代谢通路的富集分析,将排名前20的信号通路进行汇总(图3)。结果表明,凝血级联途径、ECM受体互作途径和PPAR信号通路是富集差异表达基因最多的三个路径。其中PPAR信号通路被认为与血脂调节密切相关,该通路中的差异表达基因有脂肪酸结合蛋白(Fatty acid binding protein,Fabp)、细胞色素P450家族(Cytochrome P450,Cyp)、长链酰基辅酶A合成酶(Acyl-CoA synthetase long-chain,Acsl)、烯酰辅酶A 水合酶/3-羟酰基辅酶A脱氢酶(Enoyl-Coenzyme A,hydratase/3-hydroxyacyl Coenzyme A dehydrogenase,Ehhadh)、脂肪酸去饱和酶(Fatty acid desaturase,Fads)、乙酰辅酶A酰基转移酶(Acetyl-Coenzyme A acyltransferase,Acaa)、固醇载体蛋白质(Sterol carrier protein,Scp)、磷脂转移蛋白(Phospholipid transfer protein,Pltp),这些基因将是我们未来研究的重点(图4)。

注:X轴代表富集比例;Y轴代表KEGG Pathway;气泡的大小表示注释到某个KEGG Pathway上的基因数目;颜色代表富集显著性值(Qvalue),颜色越深代表显著性值越小。
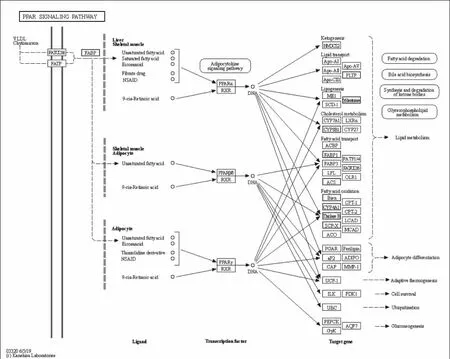
图4 PPAR信号通路
3 讨论与结论
肝脏在脂质代谢过程中发挥重要作用,肝脏中关键基因的表达可以反应出脂质代谢的情况。转录组技术已被广泛用于研究基因表达的变化。杨鹤利用转录组技术分析了肝脏中差异表达基因,以探究薏苡脂的降脂效果[17]。刘浩利用转录组测序技术分析了金钗石斛总生物碱对高胆固醇血症小鼠肝脏脂肪代谢的影响[18]。马菲菲利用转录组测序技术对肝脏的差异表达进行分析,研究了绞股蓝总皂苷治疗小鼠高脂血症过程中肝脏免疫相关基因转录水平的调控[19]。本研究对亚麻木酚素干预的ApoE-/-小鼠肝脏进行了转录组测序,结果表明,亚麻木酚素组和模型组之间,共有372个差异表达基因,其中包括234个显著上调基因,138个显著下调基因。这些关键的差异基因包括Hsd3b5、Acot1、Elovl3等与脂质代谢相关的基因。GO富集分析发现差异表达基因主要富集在脂肪酸代谢过程等生物过程、细胞外间隙等细胞组分以及单加氧酶活性等分子功能。KEGG信号通路富集分析表明,差异表达基因在PPAR信号通路被富集,该通路被认为与血脂调节密切相关。
过氧化物酶体增殖物激活受体(PPARs)是由脂肪酸及其衍生物激活的核激素受体。PPARs作为脂肪传感器调节脂肪代谢酶的转录,参与胆固醇的合成与分解、脂肪酸氧化等多种生物学过程,调节脂质代谢及脂肪形成,从而调节血脂水平[20]。Tu等研究发现,红树莓提取物通过激活PPARα通路调控关键基因的表达,从而降低高脂小鼠的血脂水平[21]。蒲施臣[22]研究发现青蒿琥酯通过PPAR等信号通路中靶点的基因表达对脂质代谢进行调节。Shi等[23]研究发现,芝麻酚通过激活PPAR信号通路显著上调了影响脂肪酸氧化、胆固醇流出和分解代谢等相关基因和蛋白的表达,从而达到抑制诱导细胞中脂质堆积和肝脏脂肪变性的效果。本研究表明,亚麻木酚素在调控高脂血症小鼠血脂水平时,PPAR信号通路的多个基因的表达被激活,如Fabp、Cyp、Acsl、Ehhadh、Fads、Acaa、Scp、Pltp等,推测亚麻木酚素是通过PPAR信号通路调节小鼠血脂水平的。
综上所述,本研究以亚麻木酚素作为干预药物,探讨了其对高脂血症小鼠肝脏差异表达基因及信号通路的影响,根据转录组测序结果我们推测亚麻木酚素可能通过PPAR信号通路调节小鼠肝脏中脂质代谢关键基因,进而达到调节血脂的效果。未来需要进一步验证转录组测序的结果,用更多的实验证据来揭示亚麻木酚素通过PPAR信号通路调节血脂的分子机制。

