经颈静脉肝内门体静脉分流预限流技术治疗继发性肝静脉-门静脉瘘一例
黄一 孟志华
肝内门-体静脉分流(intrahepatic portosystemic venous shunt,IPSVS)是指肝内门静脉与腔静脉之间通过异常的肝内静脉通道相连。按引流静脉分为两型,一种是通过肝周静脉(肾上腺静脉或膈下静脉)在肝内门静脉和下腔静脉之间进行的连通,而另一种是肝内门静脉和肝静脉之间的连通,亦称肝静脉-门静脉瘘,受累的肝、门静脉增粗,两者多以小瘘口沟通,少数瘘口呈动脉瘤样或管状、囊状扩张[1]。
1 病例资料
患者,男,49 岁,因反复牙龈出血8 年,头晕,胸闷半个月入院。患者8 年前无明显诱因下出现反复牙龈出血,尿黄,乏力,未予重视;半个月前出现头昏,胸闷,纳差,乏力,右上腹隐痛等症状来诊。既往有慢性乙肝、肝硬化、脾亢病史,否认高血压、冠心病、精神病、脑血管病史,否认外伤史、手术史。行上腹部CT 血管成像(图1)提示肝硬化、脾大、动脉瘤样门静脉右支-肝右静脉瘘,门静脉主干约为20 mm,胃左静脉、食管胃底静脉迂曲扩张。查体:右上腹轻度压痛,无反跳痛及肌紧张,肝、脾肋未触及。实验室检查:白细胞总数3.56×109/L,红细胞总数3.92×1012/L,血小板总数36×109/L,谷草转氨酶62.20 U/L,总胆红素33.55 μmol/L,直接胆红素17.58 μmol/L;血氨155.6 μmol/L。经多学科会诊意见为继发性肝静脉-门静脉瘘,肝门体分流性脑病,肝炎后肝硬化,肝多发囊肿,门静脉主干扩张,脾功能亢进,高氨血症,低蛋白血症,胃底食管静脉迂曲扩张。
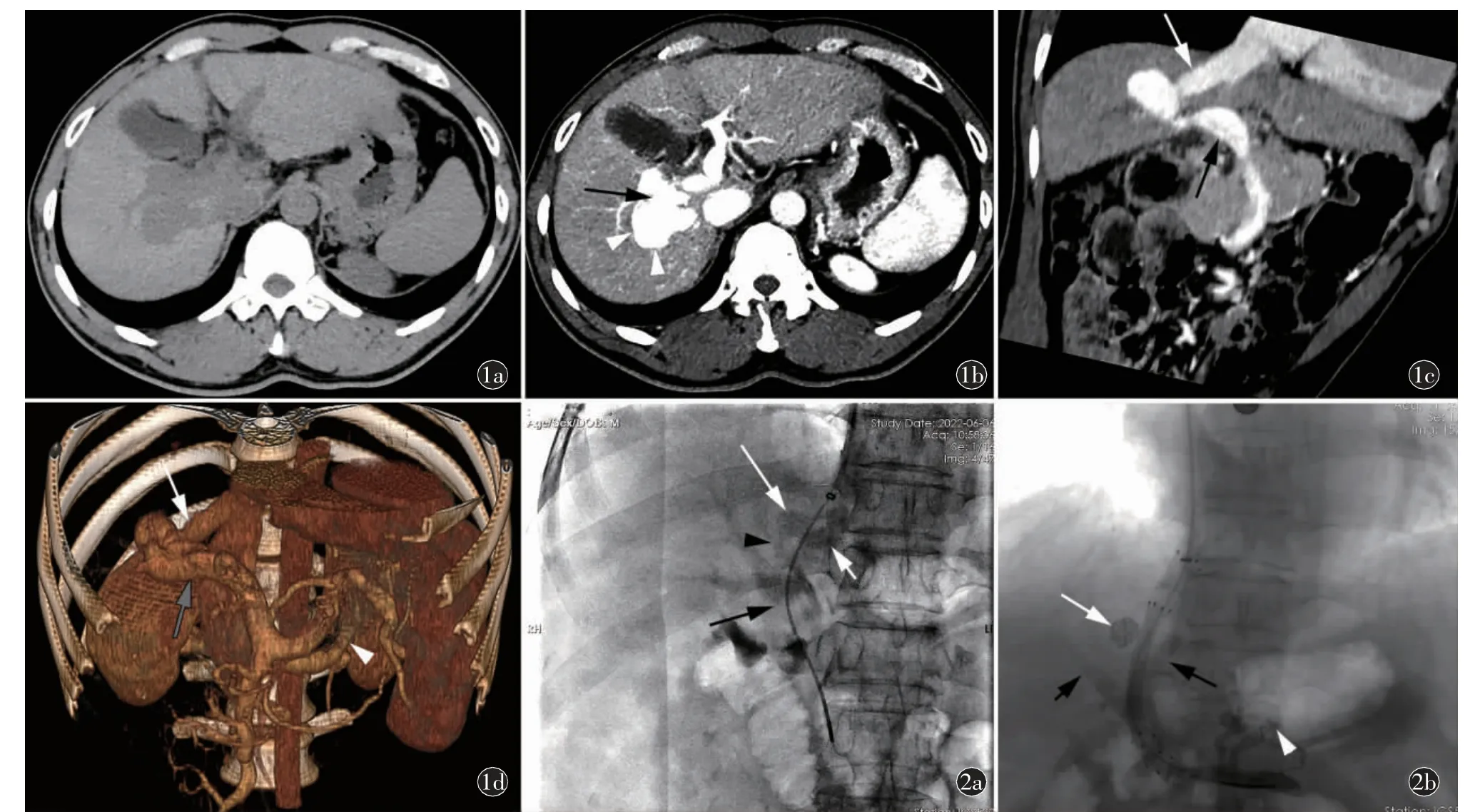
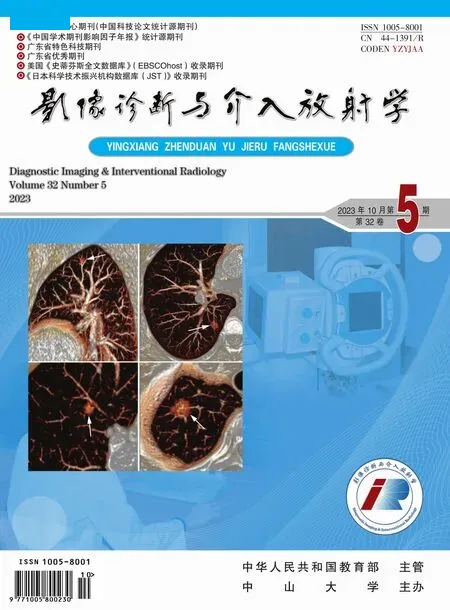
图1 IPSVS,头晕,胸闷半个月。a)术前上腹部平扫;b)增强静脉期CT 轴位,肝右后叶区域可见类圆状,呈迂曲扩张的血管团(箭头),最大层面范围约33 mm×24 mm,门静脉右前支(黑箭)、门静脉左支纤细;c)上腹部增强CT 静脉期CPR、d)VR 重组冠状位,血管团为IPSVS动脉瘤样瘘口,分别与肝右静脉(白箭)和门静脉右后支(黑箭)相连;肝右静脉及门静脉右后支明显增粗,门静脉主干轻度扩张,胃左静脉(箭头)迂曲扩张。图2a)TIPS 预限流术中门静脉造影示门静脉血流经门静脉右后支-肝右静脉瘘口回流至下腔静脉,分流量较大,动脉瘤样瘘口(长箭)、肝右静脉(短箭)、门静脉主干(黑箭)及右后支(箭头)显影浅淡;b)术毕脾静脉DSA 示TIPS 分流道,血流顺畅,支架外动脉瘤样瘘口(白箭)未见显影,局部见弹簧圈填充,门体分流量较前明显减少,门静脉右前支(黑箭)及左支(短箭)显影较前明显,胃左静脉(箭头)远端血管未见显影,食管胃底静脉显影较前减少。
外院多次反复保肝、降氨、降黄、补充白蛋白等治疗后肝功能虽好转,但肝性脑病(hepatic encephalopathy,HE)仍反复发作。入院后采用保守治疗效果不佳,患者不愿行切除术,强烈要求介入治疗,遂选择尝试行经颈静脉肝内门体静脉分流术(transjugular intrahepatic portosystemic shunt,TIPS)预限流技术。
穿刺右颈静脉成功,0.038in 泥鳅导丝引导5F-椎动脉管进入下腔静脉,经门静脉右后支-肝右静脉瘘口顺利进入门静脉后,行门静脉主干造影(图2a)明确动脉瘤样瘘口位置、大小及与相连静脉的角度,并评估门静脉主干、肝右静脉血流量及瘘口分流量。后引入14 mm 球囊导管到肝右静脉进行球囊临时闭塞试验,试验前门静脉压约13mmHg,试验后即刻门静脉压为26 mmHg,阻断15 min 后为35 mmHg。预埋2.7F-Progreat 微导管在动脉瘤样瘘口处,在瘘口段位置依次植入6 mm×60 mm Fluency 覆膜支架和12 mm×80 mm ZVL 裸支架,互相嵌套,缩小瘘口同时隔绝瘤腔;后用数枚微弹簧圈及弹簧圈封堵填塞支架外瘤腔,进而使其血栓化;且同时用微弹簧圈栓塞明显迂曲扩张的胃左静脉。栓塞成功后行脾静脉造影(图2b)确认门静脉-肝静脉瘘口处支架在位,瘘口处瘤腔已栓塞,分流道构建成功,限流满意,测门静脉压力为20mmHg;术中术后患者生命体征平稳。
术后三天,患者头晕、胸闷症状明显减轻,复查血常规:白细胞总数3.59×109/L,红细胞总数3.67×1012/L,血小板总数40×109/L,血氨70.00 μmol/L,总胆红素67.00 μmol/L,直接胆红素30.70 μmol/L。予以护肝、抗凝、抗炎治疗好转后出院。长期服用抗病毒药物及低蛋白、低脂饮食。半年后复查:白细胞总数2.02×109/L,红细胞总数3.92×1012/L,血小板总数29×109/L,血氨50.36 μmol/L;上腹部CT 血管成像(图3)提示门静脉-肝静脉瘘口内TIPS 分流道通畅,支架内最窄处约4 mm,支架外瘤腔未见对比剂填充,门静脉主干直径约13 mm,门静脉扩张较前减轻。
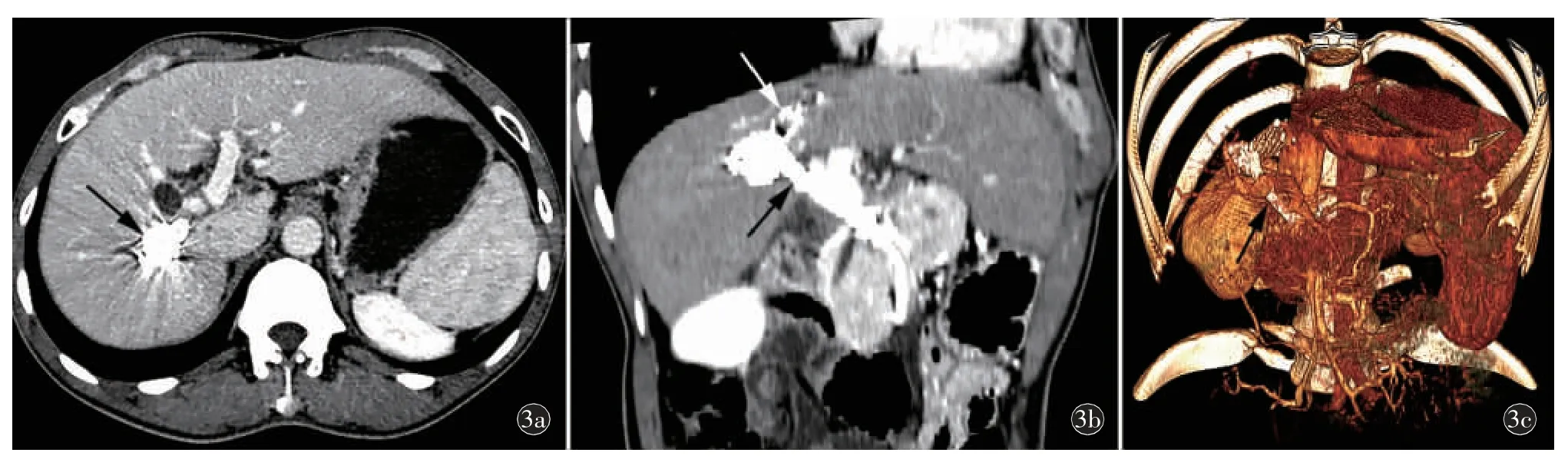
图3 TIPS 预限流术后半年复查。a)上腹部增强CT 静脉期轴位,IPSVS 动脉瘤样瘘口内弹簧圈填塞(箭),增强后未见强化;b)上腹部增强CT 静脉期CPR、c)VR 重组冠状位,肝右静脉(白箭)-门静脉右后支(黑箭)瘘口内TIPS 分流道支架在位,顺应性良好;门静脉右前支及左支显影良好。
2 讨论
2.1 IPSVS 流行病学和临床表现
IPSVS 通常在影像学上偶然发现,或在HE 出现后确诊。病因尚不完全清楚,无肝硬化或外伤史的患者发生IPSVS 被认为是先天性的[1,2],发病率仅约0.0235%[3],以儿童病例的超声影像表现和治疗的报道居多,早期多伴有并发症,包括神经认知功能障碍、发育迟缓、缺氧和局灶性肝脏病变(如肝癌、腺瘤、局灶性结节增生)[4,5]。相比之下,张翔等[6]统计后天性IPSVS 发生率约为0.179%(6/3360例),较先天性多见,但鲜有报道。后天性(获得性)常继发于肝硬化、门静脉高压等慢性肝损伤、外伤或医源性有创操作。其中肝硬化继发的IPSVS 主要是由于肝内门静脉分支长期持续的高压作用下,机体代偿形成门-体静脉间的直接沟通,可出现低血糖、高血氨症,甚至继发HE 等症状[7]。本例患者被确诊乙肝20 余年,合并肝硬化、脾大,并发长期HE 症状。在Chevallier 等[8]制定IPSVS 分型中,属于Ⅱ型(一个门静脉分支与邻近肝脏的肝静脉段之间的连接)。而在Park 等[9]分型中,则属于最常见的Ⅲ型[10](门静脉与肝静脉外周支通过血管瘤相交通),此型IPSVS 对肝功能影响小,但出现HE 的概率大[11]。瘘口的分流量决定临床表现,分流量超过门静脉血流60%时患者即为HE 高危人群,且随年龄增长,脑对高血氨的耐受力下降,发生HE 的概率增加[12-14]。
2.2 IPSVS 的临床治疗
自从IPSVS 被报道后,其治疗方式目前仍没有形成统一的标准[4]。分流瘘口的类型、位置和功能程度、患者年龄及症状和并发症的程度决定了治疗策略,基本原则是破坏门静脉与体循环之间的异常沟通,恢复门静脉血流流向肝脏。
针对无症状的患者,多通过限制蛋白质摄入、预防胃肠道出血、口服乳果糖及不可吸收类抗生素等方式采取保守治疗,但有学者提出相对激进的观念,即所有1 岁以后仍然存在的分流都应关闭,而不是等待并发症出现后再干预[5]。此外,干预措施还有手术切除,包括门静脉结扎、相应肝叶切除及肝移植等方式。因其创伤大,肝功能要求相对严格,并非所有患者都适合手术,特别是后天性IPSVS,所以肝切除与肝移植应用受限,多用来治疗不适合介入栓塞的肝外或肝内大型、多发性分流,或介入干预失败,或怀疑合并恶性肿瘤,需要切除并行病理学检测和欲行进一步治疗的IPSVS[15],特别是肝外门体分流合并肝肿瘤或门静脉压力升高,切除是首选疗法[2]。经导管栓塞为主的介入治疗已广泛使用,已成为首选的侵入性疗法,多处分流的患者除外[16,17]。具体的介入疗法有经回结肠静脉插管栓塞、经皮经肝门静脉穿刺栓塞和逆行经腔静脉插管栓塞等。经回结肠静脉插管是最具侵入性的,需要在全身麻醉下对患者进行腹部切口,该过程存在肠粘连的风险,且局限应用于肝双叶多处分流的患者[17]。Ohta 等[18]报道使用经皮经肝导管栓塞治疗中有16.5%患者出现了手术相关并发症,如腹痛、腹腔出血、门静脉高压及肝内门静脉分支血栓形成,且需要栓塞穿刺道,势必会损伤部分肝组织。逆行经腔静脉插管栓塞术是侵入性最小的技术,但在肝内门静脉系统分流的类型、数量和位置方面存在局限性,如在具有相对较大直径的下腔静脉和肝静脉的近端,存在释放栓塞材料时导管难以支撑的风险;对手术医师也有较高的经验要求;能否合理选择适宜的导管类型和型号及栓塞材料也是手术成败的关键,Tanoue 等[17]认为这项技术应该应用于少量分流的患者。
本例分流瘘口较大,最大径约33 mm,术前造影显示门静脉系统血流大部分直接分流进入下腔静脉,入肝血流减少,考虑为高分流量的IPSVS。采用栓塞术弹簧圈无法有效停留,容易逃逸进入腔静脉[19]。文献已报道多例采用Amplatazer 血管塞成功栓塞大分流量或高分流量的IPSVS,Amplatazer 血管栓塞虽具有释放前重新定位和释放后再回收,稳定锚定于靶点,能在高流量状态下抵抗迁移,可实现精确栓塞的优势[20],但是在本例大直径、短长度的瘘口伴角度较大,需要多个血管及额外的栓塞辅助,手术时间更长,在技术上具有很大挑战性[21-24]。
TIPS 是一种用于治疗门静脉高压症及相关并发症的介入治疗技术,临床上广泛用于治疗门静脉高压合并食管胃静脉曲张破裂出血及顽固性腹腔积液,但术后HE 的发生率为25%~45%[25,26],虽然多数患者可采取保守及对症治疗改善症状,但部分病例由于分流量过大仍需进行手术。目前手术治疗方式主要包括分流道封堵术及分流道限流术[27],封堵术可采用弹簧圈或可脱球囊阻塞分流道,其缺点在于术后易引起门静脉高压症状,造成出血、腹腔积液等并发症的发生率进一步升高以及急性肾衰竭[28]。限流术通过缩小分流道直径减少门体分流量,减少有毒物质进入体循环,改善肝灌注,从而降低HE 的发生率[29,30]。
本例中,按照TIPS 操作思路,经颈静脉穿刺插管,导丝一次顺利通过瘘口进入门静脉主干,极大减轻术中疼痛不适,避免了多次操作造成的肝损伤,将已形成的瘘口等同于TIPS 术后建立的分流道,因分流量过大并发HE[31]。根据对TIPS 分流道限流的处理原则,瘘口处采用小口径的支架建立分流道,术中预先设计分流道大小,限制门体分流量,进而缓解HE 及改善肝功能。同时预防性栓塞胃左静脉,可避免限流后或支架内急性闭塞造成门静脉压力增高导致胃食管静脉破裂,也可防止患者自发形成门体分流通路(如胃食管静脉、脾肾静脉分流)增加TIPS 术后并发症[32]。术后三天患者血像指标轻度升高,而半年复查血常规部分指标较术前轻度下降,考虑术后限流及胃左静脉栓塞导致门静脉高压、脾亢进一步加重;也有文献报道[31,33,34]IPSVS 可致肝硬化,长期大量门静脉血液分流可导致肝细胞慢性缺血、缺氧,肝脏解毒、转化及合成能力下降,肝细胞可发生脂变、肝硬化,故不排除尚未完全封堵的分流道加重肝硬化、脾亢程度,从而致血像进一步下降。9、12、15个月后分别电话随诊,患者目前病情相对稳定,偶感上腹隐痛,未出现其他明显不适,目前从事日常重体力劳动。
就目前患者长期随访结果与个人体验而言,TIPS 预限流技术在本例具有一定的优势,整个手术流程类似于TIPS操作,技术、操作流程及相应材料使用更加成熟;且较常规TIPS 减少操作难度较大的穿刺环节。尽管技术的难点在于预限流量在实际操作中难以控制,且目前缺乏统一标准,何创业等[35]报道采用过小的支架建立分流道并发出血、腹腔积液甚至死亡;虽然IPSVS 因发病率低,临床病例较少,文献未报道此类治疗操作,未进行大规模临床试验,临床论证及更长远的疗效评价不足,笔者仍认为TIPS 预限流技术治疗IPSVS 具有潜在的推广价值。即使行限流后未能成功缓解或者部分缓解HE,仍可作为桥接二次栓塞前的过渡治疗,使肝脏能适应血液动力学的改变。相较术前,无论分流道内是否再发狭窄,分流道直径都明显缩小,本例限流所使用腹膜支架直径规格为6 mm,半年后复查支架直径约为4 mm,同时血氨水平降至正常水平,这与术前预期一致,达到稳定低分流的状态。甚至期待在理想状态下,支架构建的小分流道内慢性血栓形成堵塞血流,从而自发封闭分流道,即取得与栓塞同等的效果。即使支架未闭塞,形成较小的分流道也有助于二次栓塞或手术的成功实施,有效规避了栓塞物无法固定在瘘口处等风险,有文献报道术前门静脉压测量值高于32 mmHg,有发生严重急性门静脉高压的风险,本例中使用球囊临时阻断模拟瘘口栓塞封堵后血流动力学改变,发现门静脉压力急剧升高,在这种情况下,建议分两个阶段逐步关闭,也有文献报道建议手术捆扎分流道管,然后进行血管内栓塞[36,37]。目前的主流治疗策略是分1~2 个阶段对分流道进行血管内闭塞,从而为那些不适合或无法栓塞或与肝肿瘤相关的分流器保留更多选择(结扎、切除、移植)[5,38,39]。
总的来说,对于肝硬化、门静脉高压患者如能通过稳定分流来缓解氨水平升高,内科治疗控制症状,可不行侵入性治疗,且血氨应作为常规多次复查。而在非肝硬化患者中,当分流比超过60%,即使没有HE,也需要进行治疗干预[6,14],且长时间随访是非常必要的。TIPS 预限流技术在高流量、单处分流且以高氨血症、HE 为症状的IPSVS 病例中具有突出的优势,手术操作简单、方便、创伤小且效果显著[31,40]。以采用覆膜及裸支架相结合构建小TIPS 分流道,维持原瘘口存在的同时又缩小瘘口,达到稳定低分流却无并发HE 的状态。通过长时间的演变,支架[1,2]内可能形成血栓或者支架内再狭窄,其分流道直径也随之不断缩小,进而使肝脏血流动力学达到缓慢改变的效果,让肝脏不断适应、代偿,最后达到相对稳定的状态,而非栓塞闭塞后的急性不良改变[5]。