PET/CT 与淋巴瘤(六):中期18F-FDG PET/CT 在淋巴瘤治疗响应预测中的作用之二
李周雷 易韵琪 陈明杰 陈仲本
1 18F-FDG PET/CT 在霍奇金淋巴瘤中的预测
霍奇金淋巴瘤(Hodgkin lymphoma,HL)约占所有淋巴瘤的10%。在组织学上,霍奇金淋巴瘤有两种主要亚型:经典型和淋巴细胞为主的霍奇金淋巴瘤。使用改进的Ann Arbor 分期系统和额外的预后因素,霍奇金淋巴瘤患者被归类为早期(Ⅰ/Ⅱ)或晚期(Ⅲ/Ⅳ)。早期霍奇金淋巴瘤进一步分为有利和不利风险亚组,为治疗策略制定提供了有效依据。虽然其定义在各复杂型淋巴瘤组分期中略有不同,但这些风险亚组可通过纵隔分布情况、B 症状、红细胞沉降率、年龄和淋巴结部位及数量来进一步描述[1]。经典型霍奇金淋巴瘤是FDG 亲和型淋巴瘤,因此使18F-FDG PET/CT 成为肿瘤评估的敏感工具。多项研究表明,中期PET/CT是评估早期和晚期HL 患者预后的独立因素[2-5]。其中,对中期PET 预测价值的最早和最关键的一项研究显示,中期PET 阳性的晚期霍奇金淋巴瘤患者2 年无进展生存期(progression free survival,PFS)率为12.8%,而阴性结果的PFS 率要高得多(95%,P<0.0001)[2]。这项研究记录的总体准确率为92%,阴性预测值(negative predictive value,NPV)为92%,阳性预测值(positive predictive value,PPV)为93%。后来的研究证实了中期PET/CT 具有很高的NPV,但也显示了高达12%~25%的先前中期PET/CT 扫描阴性的患者复发[4-7]。相比之下,HL的中期PET/CT 的PPV 往 往较低且变化更大。尽管存在不确定性,但中期扫描阳性患者的PFS 和总体生存期(overall survival,OS)均低于阴性患者。
2 18F-FDG PET/CT 在弥漫大B 细胞淋巴瘤中的预测
弥漫大B 细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是NHL 最常见的亚型,占病例的30%~40%。大约60%~70%的患者通过一线免疫化疗[最常见的是利妥昔单抗、环磷酰胺、多柔比星、长春新碱和泼尼松龙(rituximab,cyclophosphamide,doxorubicin,vincristine and prednisolone,R-CHOP 方案)]可实现持续缓解[8,9]。然而,依然 存在约30%~40%的患者对一线治疗表现出耐药性,通常需要接受嵌合抗原受体T 细胞(chimeric antigen receptor-engineered T cell,CAR-T)细胞疗法或挽救性化疗和高剂量化疗加自体干细胞移植治疗,少数患者中可达治愈效果[8,9]。
在大多数情况下,DLBCL 往往具有较高的FDG 摄取率。因此,可使用18F-FDG PET/CT 进行初始分期和治疗反应评估。然而,中期PET/CT 在DLBCL 中的应用仍具争议性,由于疾病本身及研究的异质性,其预后价值仍不稳定且不如霍奇金淋巴瘤[10]。
鉴于结局和对治疗反应的显著异质性,研究者认为使用生物标志物来识别预后差的患者对DLBCL 的管理更精准。目前,已有多个关于使用生物标志物作为中期PET/CT预 测DLBCL 患者治疗响应的报道,但结果不一[11-17]。其中,一项针对138 名DLBCL 患者的前瞻性研究结果显示中期PET 阳性患者的2 年无事件生存期明显短于阴性患者,但在OS 中没有差异[14]。另一项针 对DLBCL 患者的3 期随机前瞻性临床研究CALGB 50303,显示经过两个标准一线化疗周期后,PET/CT 阳性患者的OS 显著降低,但PFS没有变化[15]。如果使用多维尔评分来定义PET 阳性,则患者的结局没有统计学差异。最近,两项研究显示生物标志物中期PET 对于DLBCL 患者2 年PFS 预测的NPV 大于80%和PPV 为30%~100%[11,16]。
另外,评估中期PET/CT 在DLBCL 治疗中作用的高质量临床试验并不多。PETAL 是一项3 期前瞻性研究,评估中期PET 靶向治疗DLBCL(占纳入患者的82.7%)和其他侵袭性B 细胞、T细胞淋巴瘤的疗效[12]。经过两个周期的RCHOP 治疗后,只有12.5%患者为中期PET/CT 阳性,且被随机分配到标准R-CHOP 治疗或使用升级治疗,结果显示升级治疗方案不仅对改善研究终点无效,而且还导致毒性增加。当然,这些方案的比较受到样本量的限制,结果可能出现偏差[12]。
总体而言,中期PET/CT 目前在指导DLBCL 治疗方面的作用有限,并且可能很难改变。只有出现新的治疗方法,才有可能进一步改善高风险患者的预后。大量研究探索了各种策略,以加强中期PET/CT 在DLBCL 群体中的预后价值,总体结果好坏参半。例如,一些研究人员提出增加预后因素,如基线期的肿瘤代谢体积值、特定靶向基因的状态和肿瘤表达水平[18,23],研究表明纳入这些预后因素,与单独的中期PET/CT 阴阳性质相比,预后风险有所改善。
另一种研究的策略是使用半定量和定量参数进行中期PET/CT 结果解析。虽然多维尔评分在评估HL 患者时,中期PET/CT 阴性与良好预后结果之间的一致性得到了很好的验证。但DLBCL 的数据却更加不一致,许多研究甚至质疑视觉评分对该患者群体的预后价值[24-26]。多项研究表明,通过在DLBCL 评估中应用更多的定量方法,观察者间一致性更高,假阳性率更低[12,24]。研究需要进一步完善和优化中期PET/CT 技术,以更好地适应DLBCL 的独特生物学行为,而不是简单套用HL 的技术。
虽然识别高危患者至关重要,但不足以改善结局,还需要有效的治疗策略。开发高效的非化疗治疗方案,如CAR-T 细胞和双特异性抗体,也为这一患者群体提供有效的治疗策略。随着这些较新的治疗方案的出现,需要进行前瞻性试验来评估中期PET/CT 阳性患者在升级治疗策略规划中的潜力。ZUMA-12 是一项前瞻性多中心2 期临床研究,研究了中期PET/CT 在自体抗CD19 CAR-T 细胞疗法中的作用[27]。在这项试验中,患者接受了两个周期的标准治疗后行PET/CT 扫描,中期PET 阳性(多维尔评分4~5 分)的患者随后接受细胞治疗。所有患者的CAR-T 细胞均稳定扩增,达峰值时间中位数为8 d。其中,完全缓解率为78%(95%CI:62~90),首次完全缓解的中位时间为30 d(27~207 d),客观缓解率为89%(95%CI:75~97)。在随访时间中位数15.9 个月时,73%的患者有持续的客观缓解,在85%的患者中观察到大于等于3 级的不良事件;在8%和23%的患者中分别注意到大于等于3 级细胞因子释放综合征和神经系统事件,但通常是可控和可逆的[27]。
3 18F-FDG PET/CT 在其他淋巴瘤中的预测
目前,已经有一部分关于经典HL 和DLBCL以外的淋巴瘤亚型使用中期18F-FDG PET/CT 的数据进行预后评估的研究,特别是滤泡性淋巴瘤(follicular lymphoma,FL,图1)和外周T 细胞淋巴瘤(peripheral T-cell lymphomas,PTCL,图2)。滤泡性淋巴瘤是惰性淋巴瘤中FDG 含量摄取较高的一种,因此,18F-FDG PET/CT 在初始分期和治疗后评估中都有重要作用,治疗后PET/CT 对FL 的预后具有高度预测价值。一项多中心前瞻性3 期随机临床研究表明,与单独使用CT 相比,治疗后PET/CT 更适合疗效评估[28]。此外,结果还显示治疗后PET/CT 在FL 治疗中的具有有效预后价值。在随访中位数43.3 个月时,PET 阴性患者2.5 年PFS 为87.4%(95%CI:83.7~90.2),而阳性患者的2.5 年PFS 为54.9%(95%CI:40.5~67.3)。另一方面,中期PET/CT目前在FL 的管理中未发挥重要作用[28]。
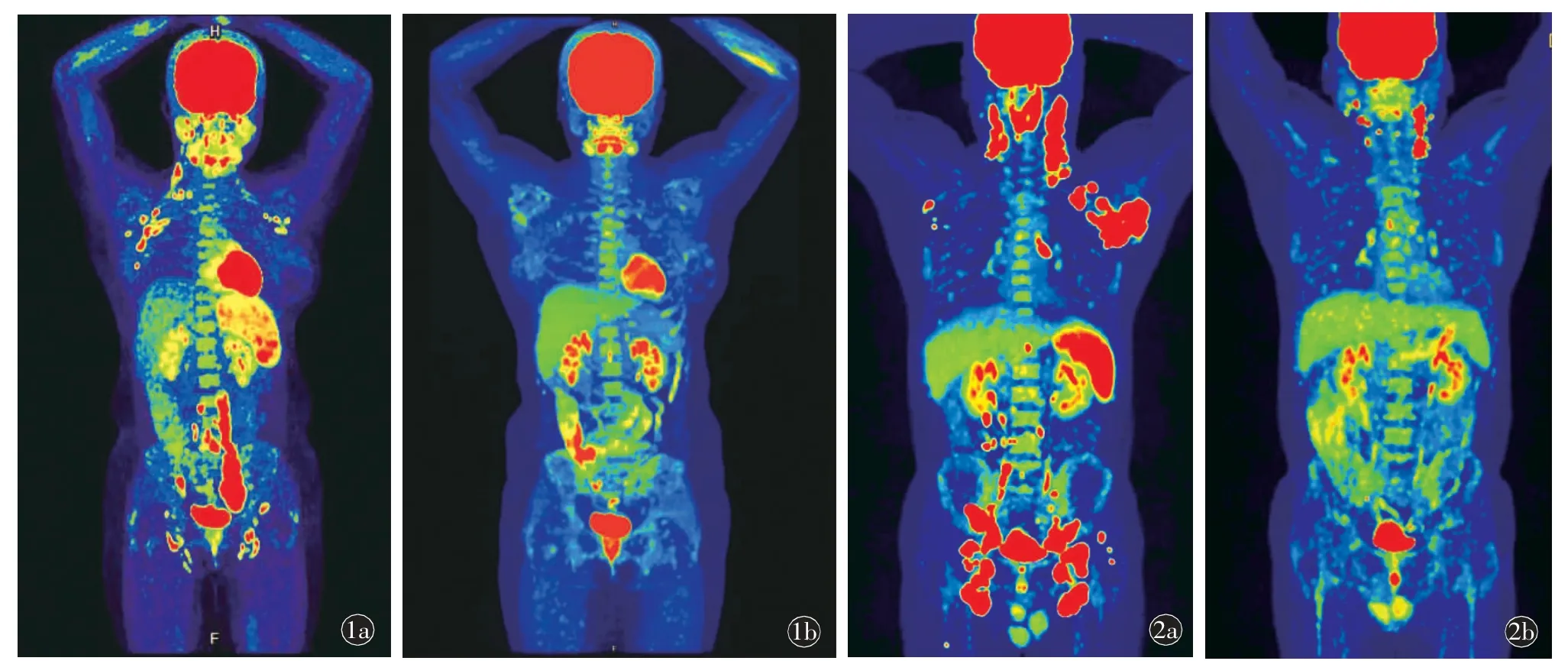
图1 女,滤泡性淋巴瘤。a)治疗前18F-FDG PET/CT 图像;b)治疗后18F-FDG PET/CT 图像。图2 男,外周T 细胞淋巴瘤。a)治疗前18F-FDG PET/CT 图像;b)治疗后18F-FDG PET/CT 图像。
还有少数研究证实了中期PET 在FL 治疗预后方面的效用,这些研究结果不一[29,30]。在一项针对121 名治疗前高FGD 摄取FL 患者的临床研究中,Dupuis 等[31]结果显示,在四个周期的R-CHOP 治疗之后,中期PET 可以预测2 年 的PFS 率,但预测总生存期不准确。然而,Lu 等[32]研究指出中期PET 不能预测FL 治疗后无进展生存期或总生存期。
PTCL 是一种罕见的异质性T 细胞恶性肿瘤,通常具有高侵袭性,且结局不良。PTCL 中更常见的亚型包括非特征型PTCL、血管免疫母细胞性T 细胞淋巴瘤和间变性大细胞淋巴瘤。虽然目前不是指南规定的标准显像技术,但中期PET/CT 对PTCL 患者预后具有较高的价值[33-38]。
另外,还有研究分析了中期PET/CT 在原发性纵隔B细胞淋巴瘤、结外NK/T 细胞、Burkitt 淋巴瘤和边缘区淋巴瘤诊疗中的作用[39-44]。目前,尚无指南规定中期PET/CT 作为这些淋巴瘤亚型治疗的标准显像技术。
总之,中期PET/CT 在淋巴瘤患者中的作用因淋巴瘤亚型而异。而其也被认为是霍奇金淋巴瘤常规管理的标准显像技术,有强有力的证据支持其预后价值。相比之下,指南目前不建议在临床研究之外的其他淋巴瘤亚型患者的常规管理中使用中期PET/CT。尽管结论不一,但中期PET/CT 在DLBCL 和其他淋巴瘤亚型中可能存在一定程度的预后作用,需要做更多的工作来提高中期PET/CT 的预测价值。