柿叶黄酮通过激活自噬与抗氧化应激协同作用改善NAFLD大鼠肝脏脂肪变性
王莲,肖继椿,田垚,李锡晶,王璐瑶,王岚,杨博涵,张荣泉
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是全球流行的慢性肝病,随着人们饮食结构和生活方式的改变,其患病率逐年增高,全球的患病率高达17%~33%[1],高风险人群可达25%~40%[2]。该病是指除酒精和其他明确的损肝因素所致的肝细胞内脂肪过度沉积为主要特征的临床病理综合征[3-4];病程包括肝脏脂肪变性、脂肪性肝炎、肝纤维化、肝硬化和肝细胞肝癌[5-6];病因机制复杂,涉及胰岛素抵抗、内质网应激、氧化应激、自噬等多个因素。近年的研究表明,自噬与氧化应激关系密切,极有可能是通过自噬受体蛋白Sequestosome-1/Protein62(SQSTM-1/P62)相关联,刺激释放核转录因子E2相关因子2(Nrf2),激活下游基因表达,提高肝细胞抗氧化应激能力[7];两者作为人体2个主要细胞防御机制,是NAFLD 发病的重要因素,也是改善NAFLD 的潜在治疗靶点。柿叶黄酮(persimmon leaf flavonoids,PLF)是柿叶提取物中的主要活性成分,具有抗氧化[8]、抗炎[9]、降血脂[10]、降血糖、保护肝脏[11]等多种药理作用。本实验旨在研究PLF是否通过激活自噬与抗氧化应激的协同作用促进NAFLD大鼠抗氧化能力,从而对肝脏起到保护作用。
1 材料与方法
1.1 实验动物 SPF级SD雄性大鼠34只,6~7周龄,体质量90~110 g,购自北京华阜康生物科技股份有限公司,动物生产许可证号:SCXK(京)2019-0008。于天津市医药科学研究所实验动物中心SPF 级环境内饲养,温度20~25 ℃,相对湿度40%~70%,光照/黑暗12 h交替。
1.2 试剂与仪器 PLF、高脂饲料(配方为基础饲料88%、猪油10%、胆固醇2%)由天津市医药科学研究所天然产物与功能性食品研究室提供;水飞蓟宾胶囊(水林佳,35 mg/粒,国药准字H20040299)购自天津天士力圣特制药有限公司;超氧化物歧化酶(SOD)活性检测试剂盒、丙二醛(MDA)含量检测试剂盒、BCA蛋白定量试剂盒、RIPA蛋白裂解液购自北京索莱宝科技有限公司;自噬抑制剂3-甲基腺嘌呤(3-MA),兔源微管相关蛋白1 轻链3-Ⅱ(LC3-Ⅱ)、Nrf2 一抗购于Immunoway 公司;P62 抗体、山羊抗兔二抗购于Boster 公司;β-actin 抗体购于CST 公司。TOSHIBATBA40-FR 全自动生化分析仪购于日本东芝公司;Mini-protean Tetra System 电泳仪购于美国Bio-Rad公司;LAS500凝胶成像发光一体机购于美国GE公司;Eclipse Ci-L显微镜、NIS-BRML图像分析系统购于日本尼康公司;EG1150H自动生物组织包埋机购于德国徕卡公司。
1.3 研究方法
1.3.1 PLF的制备 以河北产干燥柿叶为原料,使用70%乙醇回流提取3次,过滤。在滤液中加入20%NaOH 至pH值为9~10,以石油醚反复萃取后,向水相中加入15%HCl 调至pH值为5~6,以乙酸乙酯反复萃取,收集乙酸乙酯浓缩干燥,得PLF粗样品。以芦丁为对照品,使用紫外分光光度法检测样品中PLF含量为30%。
1.3.2 造模、分组及给药 SD大鼠于实验开始前1周置于实验环境中,自由进食进水,自然昼夜节律。将大鼠按随机数字表法分为对照组(8只)和造模组(26只),对照组予基础饲料喂养,造模组给予高脂饲料喂养,连续12周,期间无死亡。在12周末从对照组和造模组中各随机取2只大鼠麻醉处死,检测血清肝功能。取肝脏组织,苏木素-伊红(HE)染色后进行组织病理学观察,当造模组丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)明显升高,且肝组织呈现明显脂肪空泡时,可确定模型建立成功。
将造模成功的24只大鼠按随机数字表法分为模型组、阳性药物对照组(水林佳组)、PLF 干预组(PLF 组)、PLF+自噬抑制剂组(PLF+3-MA 组),每组6 只。对照组和模型组给予PBS灌胃;水林佳组给予28 mg/kg水林佳灌胃[12];PLF组给予PLF 200 mg/kg 灌胃[13];PLF+3-MA 组给予PLF 200 mg/kg 灌胃及2 mg/kg3-MA 腹腔注射[14]。以上各组均每日给药1 次,干预6周,给药结束后再按照实验路线图对相关检测指标进行测定,见图1。
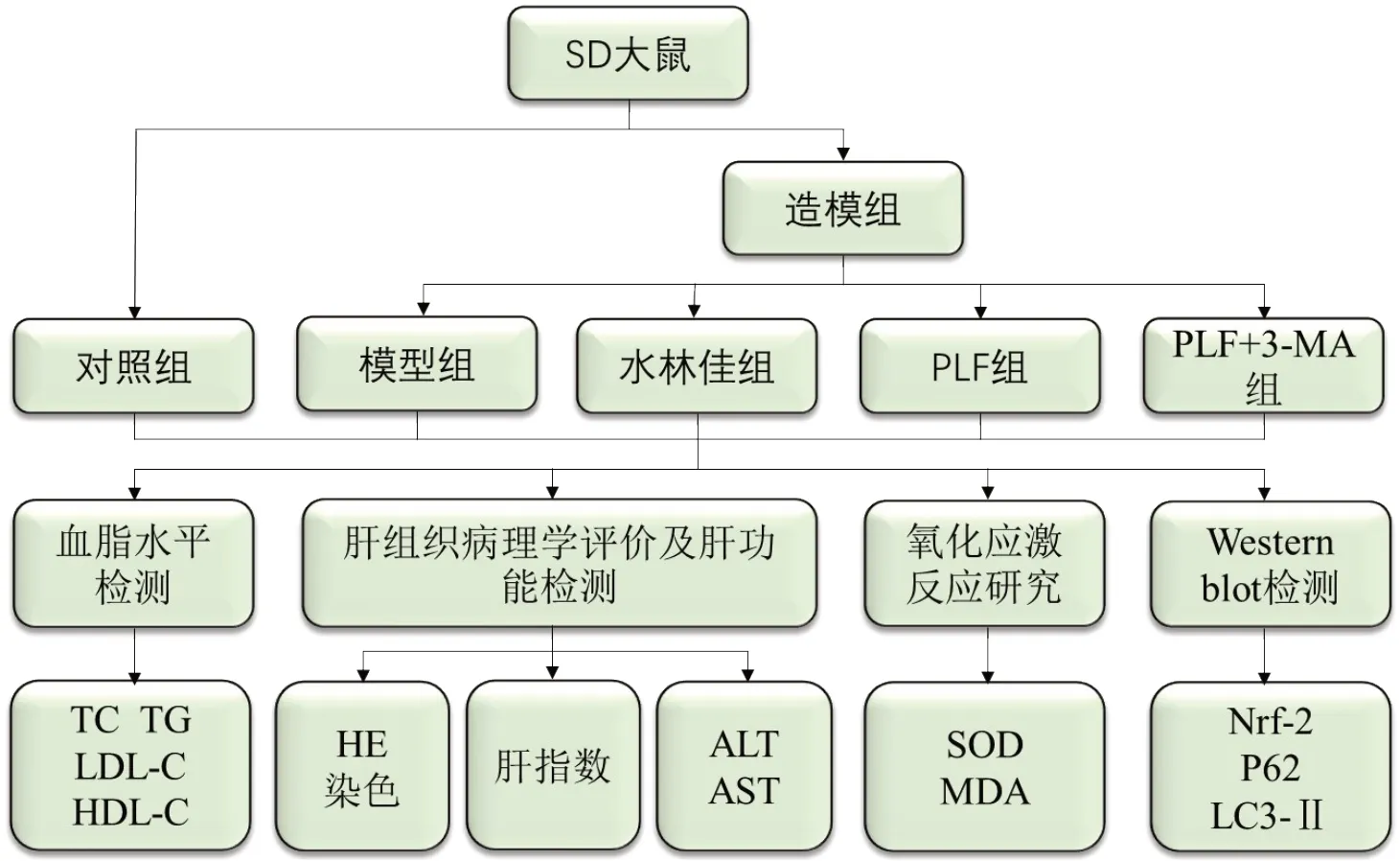
Fig.1 Experimental technology roadmap图1 实验技术路线图
1.3.3 血脂水平检测 于末次给药次日上午空腹取血,以3 000 r/min 离心15 min,分离血清。使用全自动生化分析仪检测大鼠血清中总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)的含量。
1.3.4 肝组织病理学评价及肝功能检测 称取大鼠体质量,解剖分离肝脏,滤纸吸净残余血液,称取肝质量,比较各组大鼠体质量和肝质量水平,计算肝指数(肝指数=肝质量/体质量×100%)。取各组大鼠肝脏右叶组织,一部分于-80 ℃冷冻保存,另一部分于4%中性甲醛固定后,经脱水、透明,石蜡包埋,切片、封片后,进行HE染色,于正置显微镜下观察肝组织病理学改变。使用全自动生化分析仪检测ALT和AST。
1.3.5 氧化应激指标检测 称取适量大鼠肝脏右叶组织,按照质量体积比1︰10加入提取液,进行冰浴匀浆,4 ℃、8 000 r/min离心10 min,取上清液。按照微量法试剂盒说明书检测肝脏组织氧化应激指标SOD和MDA含量。
1.3.6 Western blot 检测肝组织Nrf2、P62、LC3-Ⅱ蛋白表达水平 称取肝脏右叶组织,加入RIPA 蛋白裂解液进行充分碾磨,4 ℃、12 000 r/min 离心15 min,提取上清液制作蛋白样品,采用BCA法测定蛋白浓度。制备SDS-聚丙烯酰胺凝胶,各组取等质量蛋白上样,进行电泳分离,转膜后用5%脱脂奶粉封闭1 h。加入一抗稀释液(1︰5 000),4 ℃孵育过夜,TBST洗膜3次;加入二抗(1︰5 000),室温孵育1 h,TBST洗膜3次。显影剂显影,采用凝胶成像仪分析系统半定量分析各蛋白表达量。
1.4 统计学方法 采用SPSS 17.0 软件进行数据处理,计量数据以表示。组间比较采用单因素方差分析,多重比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 PLF 对NAFLD 大鼠血脂水平的影响 与对照组相比,模型组大鼠血清TC、TG 和LDL-C 水平升高,HDL-C水平降低(P<0.05);与模型组相比,PLF组和水林佳组TC、TG、LDL-C 水平均降低(P<0.05);与PLF组相比,PLF+3-MA组对TC、TG、LDLC 水平的降低作用均减弱(P<0.05);但PLF 组、PLF+3-MA 组和水林佳组均未能升高HDL-C 水平,见表1。
Tab.1 Comparison of serum lipid indexes between five groups表1 各组大鼠血脂水平比较 (n=6,mmol/L,)
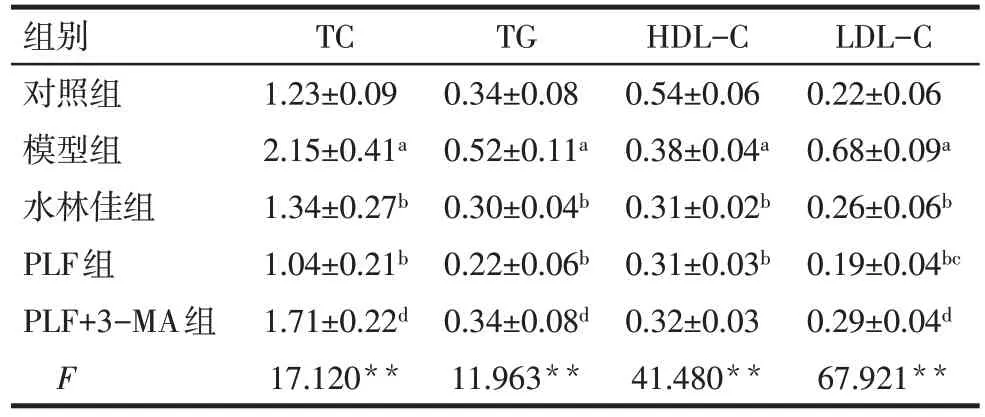
Tab.1 Comparison of serum lipid indexes between five groups表1 各组大鼠血脂水平比较 (n=6,mmol/L,)
**P<0.01;a与对照组比较,b与模型组比较,c与水林佳组比较,d与PLF组比较,P<0.05;表2—4同。
组别对照组模型组水林佳组PLF组PLF+3-MA组F TC 1.23±0.09 2.15±0.41a 1.34±0.27b 1.04±0.21b 1.71±0.22d 17.120**TG 0.34±0.08 0.52±0.11a 0.30±0.04b 0.22±0.06b 0.34±0.08d 11.963**HDL-C 0.54±0.06 0.38±0.04a 0.31±0.02b 0.31±0.03b 0.32±0.03 41.480**LDL-C 0.22±0.06 0.68±0.09a 0.26±0.06b 0.19±0.04bc 0.29±0.04d 67.921**
2.2 PLF对肝组织病理学的影响 肝脏形态观察显示,对照组肝脏颜色暗红,表面光滑完整,弹性好,边缘锐利;模型组肝脏呈现黄白色,表面粗糙,可见颗粒,弹性减弱,边缘钝;与模型组相比,水林佳组和PLF组肝脏颜色呈现暗红,表面粗糙感减弱,颗粒减少,形态明显得到改善;与PLF 组相比,PLF+3-MA组肝脏呈暗红色,但颜色稍浅,表面颗粒较多,见图2。HE染色结果显示,对照组大鼠肝细胞大小均匀,肝细胞内无脂滴,形态未见明显异常;模型组肝脏细胞体积增大,胞质含脂滴,并形成空泡,局部汇管区或肝小叶见炎性细胞浸润;相比于模型组,PLF 组、水林佳组的肝脏细胞明显减小,胞浆内脂肪空泡和脂滴数量减少,炎性细胞浸润情况改善明显;相比于PLF 组,PLF+3-MA 组细胞偏大,胞浆内脂肪空泡和脂滴数量较多,见图3。
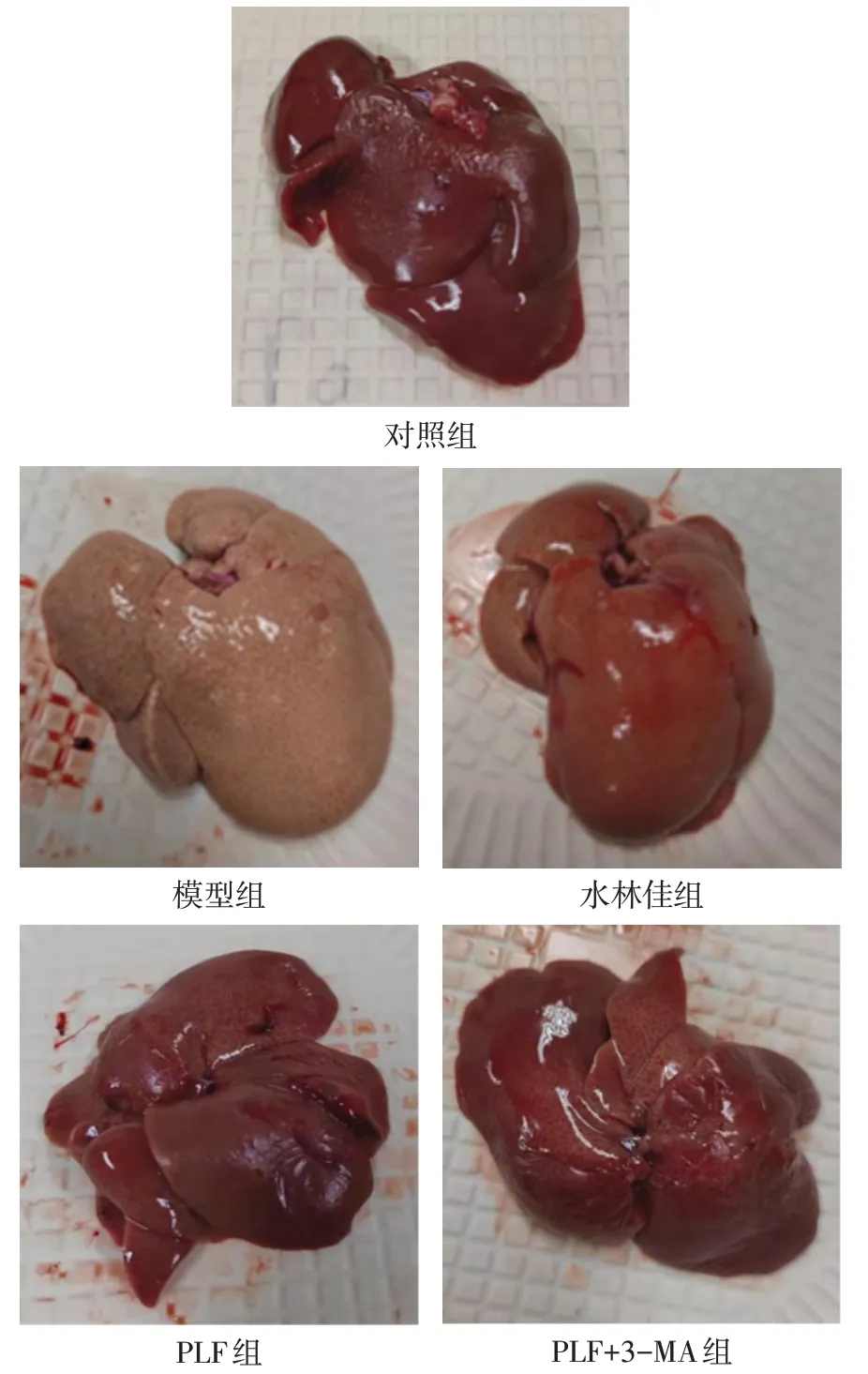
Fig.2 Anatomical morphology of liver in the five groups图2 各组大鼠肝脏解剖形态
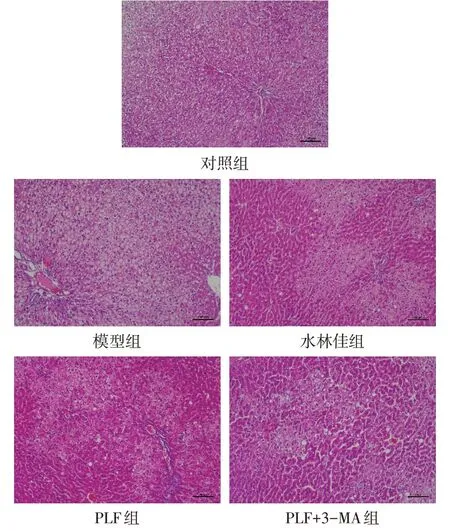
Fig.3 Pathological staining results of liver tissue in the five groups(HE staining,×100)图3 各组大鼠肝脏组织病理染色结果(HE染色,×100)
2.3 PLF 对肝功能的影响 与对照组相比,模型组大鼠肝指数升高(P<0.05);与模型组相比,PLF 组和水林佳组肝指数降低(P<0.05);但PLF+3-MA组与PLF 组肝指数的测定结果相近。与对照组相比,模型组ALT、AST 也明显增高(P<0.05);与模型组相比,PLF 组、水林佳组的ALT、AST 水平下降(P<0.05);且PLF+3-MA 组对AST 的降低作用要弱于PLF组(P<0.05),见表2。
Tab.2 Comparison of ALT and AST contents in serum and liver index between five groups表2 各组大鼠血清ALT、AST含量及肝指数比较(n=6,)
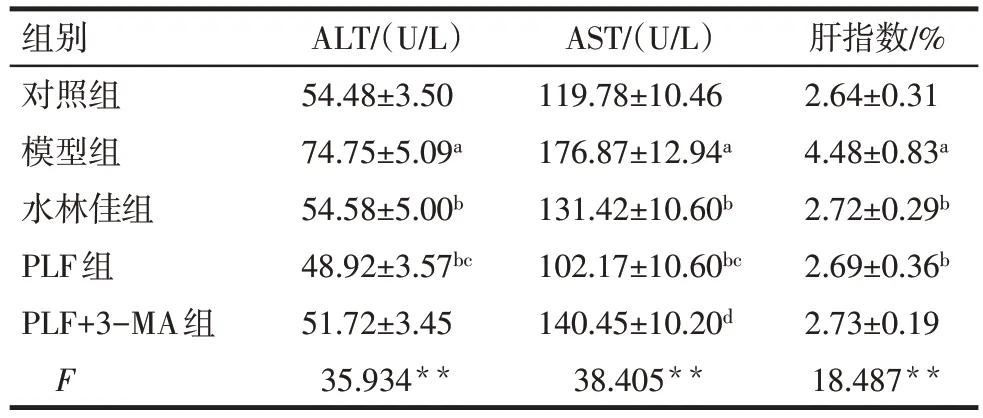
Tab.2 Comparison of ALT and AST contents in serum and liver index between five groups表2 各组大鼠血清ALT、AST含量及肝指数比较(n=6,)
组别对照组模型组水林佳组PLF组PLF+3-MA组F 54.48±3.50 74.75±5.09a 54.58±5.00b 48.92±3.57bc 51.72±3.45 35.934**119.78±10.46 176.87±12.94a 131.42±10.60b 102.17±10.60bc 140.45±10.20d 38.405**2.64±0.31 4.48±0.83a 2.72±0.29b 2.69±0.36b 2.73±0.19 18.487**ALT/(U/L)AST/(U/L)肝指数/%
2.4 PLF 对氧化应激水平的影响 与对照组相比,模型组大鼠肝脏组织中的SOD水平降低,MDA水平升高(P<0.05);与模型组相比,PLF 组和水林佳组均能明显升高SOD水平,降低MDA水平(P<0.05);与PLF 组相比,PLF+3-MA 组对SOD 和MDA 指标的改善作用均减弱(P<0.05),见表3。
Tab.3 Comparison of SOD and MDA contents in liver tissue between five groups表3 各组大鼠肝脏组织中SOD和MDA含量比较(n=6,)
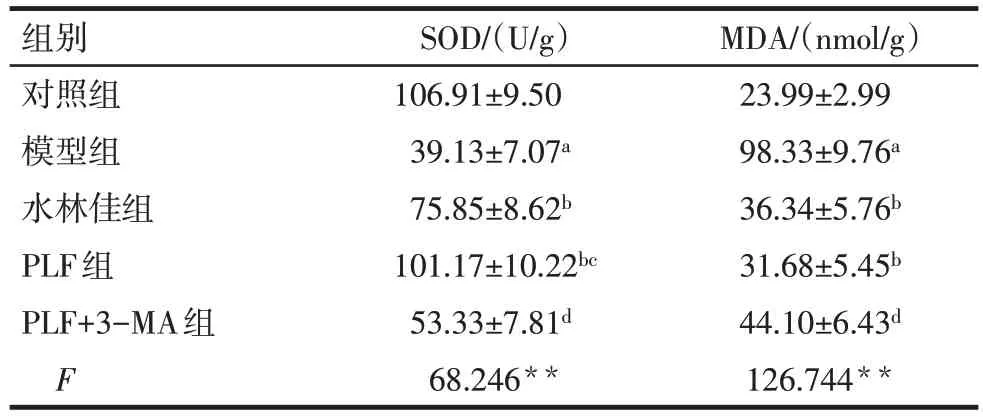
Tab.3 Comparison of SOD and MDA contents in liver tissue between five groups表3 各组大鼠肝脏组织中SOD和MDA含量比较(n=6,)
组别对照组模型组水林佳组PLF组PLF+3-MA组F SOD/(U/g)106.91±9.50 39.13±7.07a 75.85±8.62b 101.17±10.22bc 53.33±7.81d 68.246**MDA/(nmol/g)23.99±2.99 98.33±9.76a 36.34±5.76b 31.68±5.45b 44.10±6.43d 126.744**
2.5 PLF 对肝组织中Nrf2、P62、LC3-Ⅱ蛋白表达的影响 与对照组相比,模型组P62 蛋白表达增加,Nrf2 和LC3-Ⅱ蛋白表达降低(P<0.05);与模型组相比,PLF 组和水林佳组P62 蛋白表达降低,Nrf2、LC3-Ⅱ蛋白表达升高(P<0.05);而PLF+3-MA 组LC3-Ⅱ、Nrf2的蛋白表达低于PLF组,P62蛋白表达高于PLF组(P<0.05),见图4、表4。
Tab.4 Comparison of expression levels of Nrf2,P62 and LC3-Ⅱbetween five groups表4 各组大鼠Nrf2、P62和LC3-Ⅱ蛋白表达水平比较(n=6,)
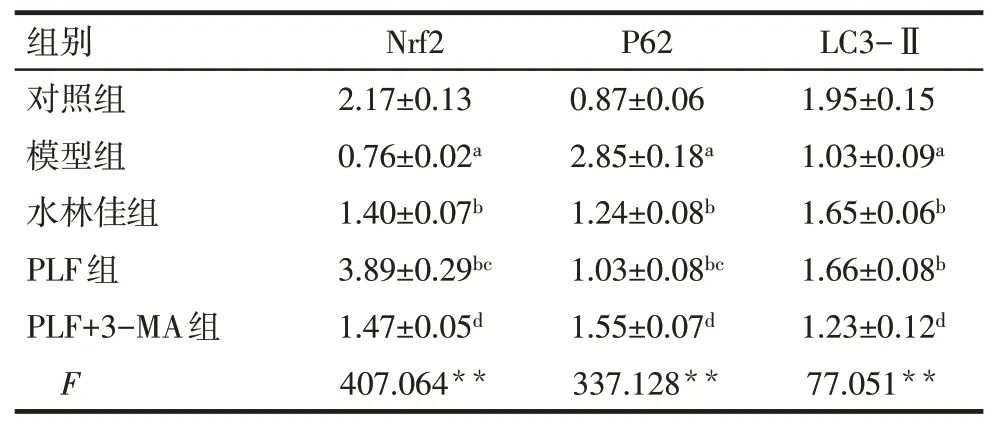
Tab.4 Comparison of expression levels of Nrf2,P62 and LC3-Ⅱbetween five groups表4 各组大鼠Nrf2、P62和LC3-Ⅱ蛋白表达水平比较(n=6,)
组别对照组模型组水林佳组PLF组PLF+3-MA组F 2.17±0.13 0.76±0.02a 1.40±0.07b 3.89±0.29bc 1.47±0.05d 407.064**0.87±0.06 2.85±0.18a 1.24±0.08b 1.03±0.08bc 1.55±0.07d 337.128**1.95±0.15 1.03±0.09a 1.65±0.06b 1.66±0.08b 1.23±0.12d 77.051**Nrf2P62LC3-Ⅱ
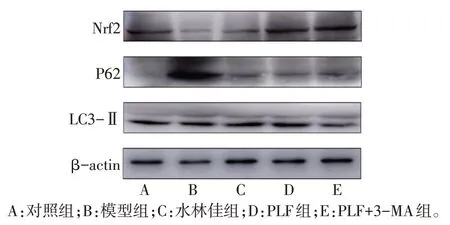
Fig.4 The expression of autophagy and oxidative stress markers detected by Western blot assay图4 Western blot检测自噬、氧化应激标志蛋白的表达
3 讨论
3.1 以高脂饮食建立大鼠NAFLD模型 NAFLD是全球流行的慢性肝病,发病率逐年上升。文献报道许多针对保肝护肝作用的研究多采用化学药物诱导的方法造模,虽具有造模速度快、成本低的特点[8,11],但与NAFLD 的发病机制并不吻合。本研究以高脂饮食喂养大鼠建立NAFLD模型,结果发现大鼠出现肥胖、脂质代谢紊乱、肝脏功能损伤等现象,显示造模成功。该模型更接近于因饮食摄入过多而引起的NAFLD表现,与人类的发病机制更为相似。
3.2 NAFLD的治疗现状 现代医学对NAFLD的治疗以改善生活方式为主,包括调整饮食结构,运动疗法,给予胰岛素增敏剂、降脂药物及对症治疗等。目前尚无获批的特异性药物,临床上用到的治疗药物普遍以改善代谢为主,包括二甲双胍、噻唑烷二酮类、维生素E、人胰高血糖素样肽-1 类似物,这些药物存在不良反应大、依从性差等缺点,效果不甚理想。而许多包括天然产物在内的营养制剂也表现出抑制NAFLD发生和相关并发症的作用[15-16],且具有易于吸收、安全性高的优点[17],因此很多学者致力于从天然产物去探寻NAFLD的有效治疗方法,故针对PLF 治疗NAFLD 的药效和机制研究十分必要。水林佳是水飞蓟宾与磷脂酞胆碱的复合制剂,可显著提高肝脏解毒功能,改善肝脏细胞水变性和脂肪变性,减少脂肪在肝脏内的沉积和浸润,从而减轻NAFLD的病理变化,因此选择该药作为本研究的阳性对照药品[18]。
3.3 NAFLD 发病与氧化应激和自噬有关 NAFLD发病机制复杂,存在“二次打击”、“三次打击”和“多重打击”多个学说,其病因涉及因素繁多,包括胰岛素抵抗、内质网应激、氧化应激、细胞凋亡与自噬、肠道微生物等,在遗传易感个体中,多个并行因素会产生协同作用,参与NAFLD的发生、发展。
氧化应激是指体内氧化与抗氧化作用失衡的一种状态,倾向于氧化,导致中性粒细胞浸润,蛋白酶分泌增加,产生大量氧化中间产物,是目前公认的NAFLD 发病机制之一。有研究表明,Nrf2 是细胞抗氧化应激的中枢调节者,正常情况下,1分子Nrf2和2 分子Kelch 样环氧氯丙烷相关蛋白1(Keap1)以非共价键的形式结合成二聚体存在于细胞浆中,当受到外界氧化应激因子刺激后,二者解离,Nrf2发生核异位,然后通过与抗氧化应激反应元件相互作用,诱导编码抗氧化蛋白和Ⅱ相解毒酶的表达,如γ 谷氨酸合成酶、血红素氧合酶1等,产生相应的自身防御反应[19]。
自噬是一种高度保守的细胞内降解过程,它通过选择性降解来调节肝细胞脂质的积累,在NAFLD过程中起保护作用[20]。抑制自噬会影响脂滴、受损的线粒体和有毒的蛋白质聚集体的降解,加重NAFLD 的发展。自噬和Keap1/Nrf2 氧化应激信号通路关系密切,两者通过通路中的自噬受体蛋白P62 相关联。P62 是一个多功能蛋白质,自噬形成时,LC3-Ⅰ会酶解掉一小段多肽,转变为LC3-Ⅱ,P62作为自噬反应的底物参与自噬反应;而P62还可与Keap1 结合,释放Nrf2,激活下游基因表达,提高肝细胞抗氧化应激能力。自噬和氧化应激作为人体2 个主要细胞防御机制,是NAFLD 发病过程中非常重要的因素,也是改善NAFLD的潜在治疗靶点。
3.4 PLF通过激活自噬与抗氧化应激的协同作用改善NAFLD PLF 对高脂饮食诱导NAFLD 大鼠的肝脏损伤具有明显的保护作用,能够有效降低血脂水平,作用效果与水林佳相近。在探讨PLF 改善NAFLD的作用机制时发现,PLF可升高NAFLD大鼠肝脏组织中的SOD 水平、降低MDA 水平,有效降低大鼠体内氧自由基浓度,改善大鼠氧化应激状态。为进一步探讨PLF 的具体作用机制,本实验中引入了自噬抑制剂3-MA,结果表明加入3-MA 后,PLF降低血脂和改善氧化应激的作用均被削弱,提示PLF 可能是通过激活自噬调节作用来改善NAFLD症状。
Western blot 结果显示,与对照组相比,模型组P62蛋白表达增加,LC3-Ⅱ蛋白表达降低,表明自噬反应受到抑制,同时Nrf2蛋白表达降低,则表明与之关联的Nrf2氧化应激通路受到抑制。给予PLF干预后,Nrf2 和LC3-Ⅱ蛋白水平均升高,P62 水平下降,表明PLF可促进大鼠自噬反应和抗氧化应激。一方面,P62与Keap1结合增加,释放的游离Nrf2增多,提高了抗氧化应激能力;另一方面,LC3-Ⅱ升高,自噬作用增强,P62作为自噬底物与其他降解蛋白结合,在自噬溶酶体中降解,P62 水平下调。自噬抑制剂的加入不仅使自噬作用受到抑制,自噬标志性蛋白水平下降,而且使氧化应激标志物Nrf2 蛋白水平也下调,抗氧化应激作用降低,这又进一步验证了PLF可通过自噬与抗氧化应激的协同作用促进大鼠抗氧化能力,从而对肝脏起到保护作用。
综上所述,本研究证实了PLF 对高脂饮食诱导的NAFLD大鼠肝脏损伤具有保护作用,且可有效改善其脂质代谢过程,其机制可能与激活自噬和抗氧化应激的协同作用有关。这不仅为PLF 作为NAFLD的治疗药物进行开发提供了理论基础,也为NAFLD 的临床治疗提供了新的实验思路和研究途径。

