注射用核糖核酸Ⅱ联合培美曲塞+铂类化疗在非小细胞肺癌中的应用效果
李子立 弓婷婷 马丽霞 张婷婷 张洋 崔洪霞
非小细胞肺癌(NSCLC)是肺癌中最为常见的一种类型,约占肺癌的75%,其发病初期缺乏特异性表现,40%~50%的患者确诊时已为晚期,无法接受手术切除,需接受化疗[1-2]。培美曲塞+铂类化疗是一线治疗NSCLC 的标准方式,但化疗过程中药物副作用严重,加之化疗对患者的免疫功能有严重影响,严重降低患者的生活质量,甚至可导致化疗失败[3]。注射用核糖核酸Ⅱ是一种核酸类化学制剂,可对T 细胞的分化、增殖等进行非特异性的刺激,从而调节人体的免疫功能,可作为化疗NSCLC的辅助药物[4]。本研究探讨注射用核糖核酸Ⅱ联合培美曲塞+铂类化疗在NSCLC 中的应用效果,以期为NSCLC 的临床有效治疗提供有效参考,具体如下。
1 资料与方法
1.1 一般资料
选取2019 年6 月—2021 年6 月于吉林省肿瘤医院诊治的80 例NSCLC 患者,纳入标准:(1)符合NSCLC 的诊断标准[5],且经肺部活检确诊为腺癌;(2)至少存在1 个可测量的病灶;(3)预计生存期>6 个月。排除标准:(1)合并心肝肾功能障碍;(2)对化疗过敏或不耐受;(3)骨髓抑制严重;(4)伴有其他恶性肿瘤;(5)合并严重精神疾病;(6)妊娠期或哺乳期妇女。使用随机数字表法将其分为观察组40 例及对照组40 例。本院医学伦理委员会批准此研究,患者签署知情同意书。
1.2 方法
对照组接受培美曲塞+铂类化疗。注射用培美曲塞二钠(生产厂家:江苏奥赛康药业股份有限公司,批准文号:国药准字H20123213,规格:100 mg)500 mg/m2混入100 mL 浓度为0.9%的氯化钠注射液,第1 天静脉滴注10 min。注射用顺铂(生产厂家:齐鲁制药有限公司,批准文号:国药准字H37021358,规格:10 mg)70 mg/m2混 入浓度为0.9%的氯化钠注射液500 mL 中,第1 天静脉滴注,每3 周为1 个周期。用药前1 周给予维生素B12注射液(生产厂家:安徽凤阳科苑药业有限公司,批准文号:国药准字H34020288,规格:1 mL∶0.1 mg)1 mg 肌肉注射。于用药第1 天、用药当天和用药第2 天口服地塞米松片(生产厂家:广东南国药业有限公司,批准文号:国药准字H44024618,规格:0.75 mg),4.5 mg/次,2 次/d。化疗前1 周至化疗结束,给予叶酸片(生产厂家:天津力生制药股份有限公司,批准文号:国药准字H12020215,规格:5 mg)口服,5 mg/次,1 次/d。
观察组在对照组基础上加用注射用核糖核酸Ⅱ。注射用核糖核酸Ⅱ(生产厂家:吉林敖东药业集团延吉股份有限公司,批准文号:国药准字H22020007,规格:50 mg)100 mg 混入浓度为5%的葡萄糖注射液500 mL 后静脉滴注,1 次/d。21 d为1 个周期,两组患者均连续治疗2 个周期。
1.3 观察指标及评价标准
(1)临床疗效:参照实体肿瘤的疗效评价标准,将临床疗效分为完全缓解(CR)、部分缓解(PR)、稳定(SD)及进展(PD)[6]。客观反应率(ORR)=(CR+PR)/总例数×100%。疾病控制率(DCR)=(CR+PR+SD)/总例数×100%。(2)免疫功能指标:于治疗前及治疗6 周后,采集两组患者肘静脉血3 mL,离心处理后取上清液,使用流式细胞仪检测CD3+、CD4+、CD8+、CD4+/CD8+、CD4+/CD25+水平。(3)生活质量评分:于治疗前及治疗6 周后,使用癌症患者生活质量核心问卷对两组患者的生活质量进行调查,分为情绪功能、躯体功能、角色功能、社会功能及认知功能5 个维度,每个维度评分范围0~10 分,分数越高表示生活质量越高[7]。(4)肿瘤标志物指标:于治疗前及治疗6 周后,采集两组患者清晨空腹肘静脉血5 mL,离心处理后取上清液,使用放射免疫法测定血清癌胚抗原(CEA)、血清糖类抗原125(CA125)水平,使用电化学法检测血清细胞角蛋白19(CK-19)水平。
1.4 统计学处理
2 结果
2.1 两组一般资料比较
观察组中男22 例,女18 例;年龄38~69 岁,平均(53.28±2.15)岁;临床分期:Ⅲa 期13 例,Ⅲb 期14 例,Ⅳ期13 例。对照组中男23 例,女17 例;年龄37~68 岁,平均(53.18±2.13)岁;临床分期:Ⅲa 期12 例,Ⅲb 期15 例,Ⅳ期13 例。两组一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
2.2 两组的临床疗效比较
观察组的客观反应率、疾病控制率均高于对照组,差异均有统计学意义(χ2=4.528、9.600,P=0.033、0.002),见表1。

表1 两组的临床疗效比较
2.3 两组免疫功能指标比较
治 疗 前, 两 组CD3+、CD4+、CD8+、CD4+/CD8+、CD4+/CD25+水平相较差异均无统计学意义(P>0.05);治疗6 周后,两组CD3+、CD4+、CD4+/CD8+、CD4+/CD25+均降低,但观察组均高于对照组,对照组CD8+升高,但观察组低于对照组,差异均有统计学意义(P<0.05)。见表2。
表2 两组免疫功能指标比较(±s)
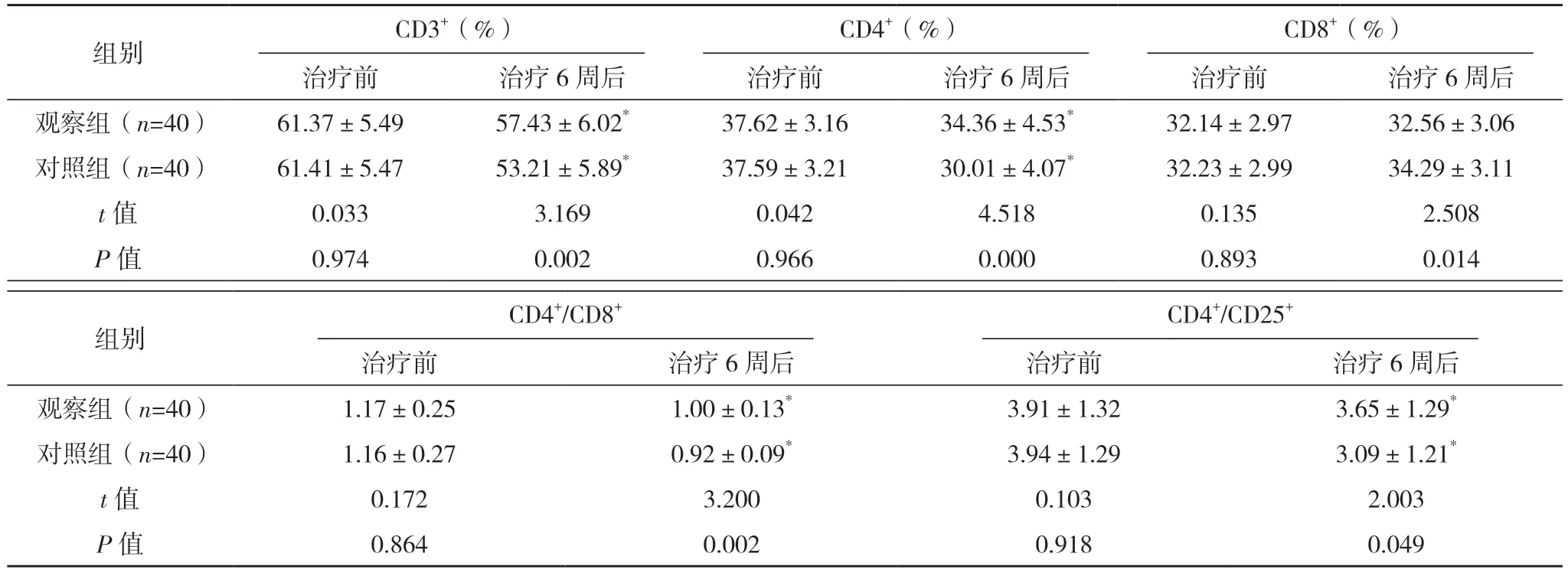
表2 两组免疫功能指标比较(±s)
*与本组治疗前比较,P<0.05。
组别 CD3+(%)CD4+(%)CD8+(%)治疗前 治疗6 周后 治疗前 治疗6 周后 治疗前 治疗6 周后观察组(n=40) 61.37±5.49 57.43±6.02* 37.62±3.16 34.36±4.53* 32.14±2.97 32.56±3.06对照组(n=40) 61.41±5.47 53.21±5.89* 37.59±3.21 30.01±4.07* 32.23±2.99 34.29±3.11 t 值 0.033 3.169 0.042 4.518 0.135 2.508 P 值 0.974 0.002 0.966 0.000 0.893 0.014组别 CD4+/CD8+CD4+/CD25+治疗前 治疗6 周后 治疗前 治疗6 周后观察组(n=40) 1.17±0.25 1.00±0.13* 3.91±1.32 3.65±1.29*对照组(n=40) 1.16±0.27 0.92±0.09* 3.94±1.29 3.09±1.21*t 值 0.172 3.200 0.103 2.003 P 值 0.864 0.002 0.918 0.049
2.4 两组生活质量评分比较
治疗前,两组各项癌症患者生活质量核心问卷评分相较差异均无统计学意义(P>0.05);治疗6 周后,两组各项评分均升高,观察组均高于对照组,差异均有统计学意义(P<0.05)。见表3。
表3 两组生活质量评分比较[分,(±s)]
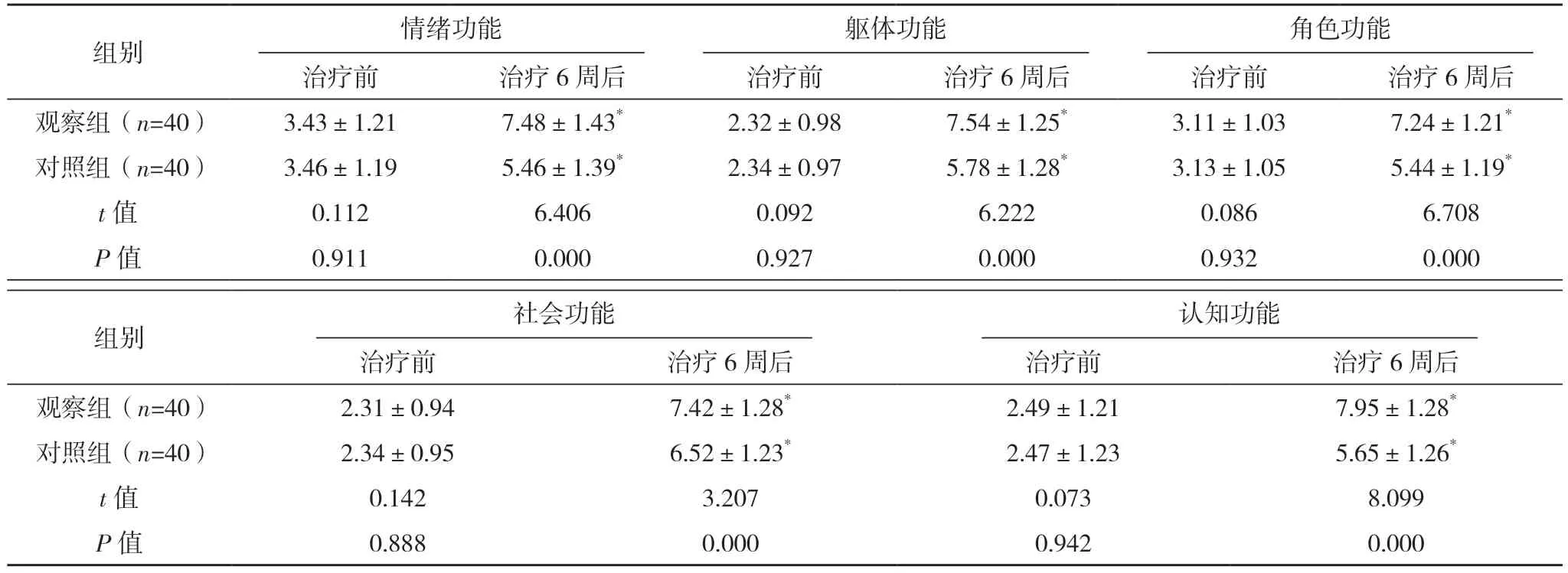
表3 两组生活质量评分比较[分,(±s)]
*与本组治疗前比较,P<0.05。
组别 情绪功能躯体功能角色功能治疗前 治疗6 周后 治疗前 治疗6 周后 治疗前 治疗6 周后观察组(n=40) 3.43±1.21 7.48±1.43* 2.32±0.98 7.54±1.25* 3.11±1.03 7.24±1.21*对照组(n=40) 3.46±1.19 5.46±1.39* 2.34±0.97 5.78±1.28* 3.13±1.05 5.44±1.19*t 值 0.112 6.406 0.092 6.222 0.086 6.708 P 值 0.911 0.000 0.927 0.000 0.932 0.000组别 社会功能认知功能治疗前 治疗6 周后 治疗前 治疗6 周后观察组(n=40) 2.31±0.94 7.42±1.28* 2.49±1.21 7.95±1.28*对照组(n=40) 2.34±0.95 6.52±1.23* 2.47±1.23 5.65±1.26*t 值 0.142 3.207 0.073 8.099 P 值 0.888 0.000 0.942 0.000
2.5 两组肿瘤标志物指标比较
治疗前,两组血清CEA、CA125、CK-19 水平相较差异均无统计学意义(P>0.05);治疗后,两组三项指标均降低,观察组均低于对照组,差异均有统计学意义(P<0.05)。见表4。
表4 两组肿瘤标志物指标比较(±s)

表4 两组肿瘤标志物指标比较(±s)
*与本组治疗前比较,P<0.05。
组别 CEA(ng/mL)CA125(U/mL)CK-19(ng/mL)治疗前 治疗6 周后 治疗前 治疗6 周后 治疗前 治疗6 周后观察组(n=40) 22.57±3.29 12.48±2.19* 66.24±5.86 36.53±5.40* 5.24±1.03 2.01±0.31*对照组(n=40) 22.61±3.24 16.85±2.21* 66.38±5.92 51.28±5.90* 5.25±1.05 3.36±0.47*t 值 0.055 8.883 0.106 11.664 0.043 15.165 P 值 0.956 0.000 0.916 0.000 0.966 0.000
3 讨论
培美曲塞是一种多靶点的叶酸拮抗剂,可对胸苷酸合成酶、二氢叶酸还原酶产生抑制,对嘌呤和嘧啶的合成具有显著的阻断作用,进而阻碍细胞有丝分裂的S 期,最终达到抑制肿瘤细胞增殖的目的[8]。铂类是重金属化疗药物,具有较为强烈的细胞毒性,对癌细胞的DNA 复制过程产生抑制,且可损伤癌细胞膜上结构,广谱抗癌作用显著[9]。培美曲塞与铂类方案联合治疗是目前临床一线治疗NSCLC 的标准方案,也是NSCLC 二线治疗的推荐方案,治疗NSCLC 效果显著,但对患者免疫功能损害严重,致使化疗副反应加重,降低生活质量,甚至导致化疗中止[10-11]。注射用核糖核酸Ⅱ是提取自健康牛胰脏的核酸类化学制剂,是一种来自免疫器官且可传递免疫功能的DNA,可将抗原的免疫反应进行传递,从而促使从未接触过该抗原的受体产生特异性的体液免疫及细胞免疫。注射用核糖核酸Ⅱ辅助培美曲塞及铂类化疗非小细胞癌效果显著,可减少化疗对免疫功能的负面影响,减少副反应,提高整体治疗效果[12-13]。
机体抗肿瘤的免疫情况可由淋巴T 细胞情况进行反应。CD3+T 细胞可反映淋巴T 细胞的总数量,可反映机体的总体免疫情况;CD4+T 细胞则是一种辅助性的细胞,可辅助增强机体抗肿瘤的免疫功能;CD8+则是具有细胞毒性的T 细胞,可对CD4+T 细胞及淋巴细胞的功能产生抑制[14]。Treg 细胞是一种具有独特免疫调节功能的T 淋巴细胞,当NSCLC 患者自身免疫功能下降时,Treg 细胞的抑制功能可显著增强,同时化疗药物可减弱其抑制功能,通过CD4+、CD25+细胞群代替[15]。注射用核糖核酸Ⅱ可非特异性地刺激T 细胞的分化、增殖及成熟,强化机体的细胞免疫,减轻机体免疫功能损伤。本研究结果显示,治疗后两组的CD3+、CD4+、CD4+/CD8+、CD4+/CD25+均降低,对照组CD8+升高,但观察组均优于对照组,可见注射用核糖核酸Ⅱ辅助培美曲塞+铂类化疗可减轻化疗药物对NSCLC 患者的机体免疫功能损伤。
肿瘤标志物是评价NSCLC 病情发展情况的重要指标。CEA 是一种对肺癌细胞的增殖及生长产生显著抑制的因子,CA125 是主要表达于癌细胞表面的糖类抗原,与癌细胞数量及病情严重程度成正比;CK-19 是一种酸性角蛋白,存在于上皮源性肿瘤细胞胞浆中[16-17]。注射用核糖核酸Ⅱ可显著减轻化疗对NSCLC 患者的机体免疫损伤,减少肿瘤标志物的生成,强化化疗效果。本研究结果显示,治疗后观察组的CEA、CA125、CK-19 水平低于对照组,且前者的客观反应率、疾病控制率均高于对照组,提示注射用核糖核酸Ⅱ辅助培美曲塞+铂类化疗可提高NSCLC 的整体化疗效果。
NSCLC 患者的自身免疫功能降低,化疗药物的毒副作用进一步降低机体自身免疫能力,致使骨髓抑制等多种毒副作用多发,加重机体对于化疗的副反应,导致机体的躯体功能受限,进一步影响情绪、角色、社会及认知等各项功能,从而影响整体的生活质量[18-20]。注射用核糖核酸Ⅱ可显著减轻化疗对于NSCLC 患者免疫功能的负面影响,提高整体治疗水平,从而从生理及心理两方面提高生活质量。本研究结果显示,治疗后观察组的各项生活质量评分均高于对照组,可见注射用核糖核酸Ⅱ辅助培美曲塞+铂类化疗可提高NSCLC 患者的整体生活质量。
综上所述,注射用核糖核酸Ⅱ联合培美曲塞+ 铂类化疗治疗非小细胞癌效果显著,减少化疗对免疫功能的损害,调节肿瘤标志物水平,提高生活质量。

