生物钟基因Bmal1在肿瘤中的研究进展
郭恩慧 成冰 冯思琦 马亭
作者单位:450001 郑州 郑州大学药学院
昼夜节律也称为生物钟,是与日夜交替同步以24 h 为周期的一种生理节律系统[1],具有自我调节功能,可以维持生物体的内稳定,而且几乎存在于所有的组织和细胞中[2]。脑和肌肉组织芳香烃受体核转运蛋白的类似蛋白1(brain and muscle Arnt-like protein 1,Bmal1)是生物钟的核心元件之一,位于转录翻译反馈回路(transcriptional-translational feedback loop,TTFL)的核心部位[3]。目前研究[4-6]显示,Bmal1异常表达与癌细胞的增殖、侵袭和迁移等过程密切相关,可能是潜在的肿瘤治疗靶点。但是Bmal1 在肿瘤发生发展过程中的作用较为复杂,在头颈癌、肝癌、舌鳞状癌和卵巢癌等恶性肿瘤中发挥抗肿瘤的作用[7-10],而在恶性间皮瘤中可促进肿瘤的进展[11]。因此,探索Bmal1基因在肿瘤中的作用及其调控机制成为研究热点之一,本文就此作一综述,以期为癌症的精准时辰疗法提供借鉴。
1 Bmal1基因概述及在肿瘤中的作用
昼夜节律网络包括位于下丘脑视交叉上核(SCN)的中枢时钟以及外周组织时钟,中枢时钟通过控制神经和内分泌系统而连接到外周时钟,从而使中央和外周组织生物节律相互同步、相互协调,维持生物节律平衡[12]。从分子角度来说,昼夜节律主要通过昼夜节律运动输出周期故障(circadian locomotor output cycles kaput,Clock)、昼夜节律靶基因周期蛋白(period,Per)和隐花色素基因家族(cryptochrome,Cry)等生物钟基因对TTFL进行调控来维持[13-14]。昼夜节律发生紊乱会显著增加人们罹患恶性肿瘤、心血管疾病等疾病的风险[2,15]。
Bmal1基因,又被称为芳香烃受体核转运蛋白的类似蛋白l(aryl hydrocarbon receptor nuclear translocatorlike,Arntl)基因,可编码Bmal1蛋白,定位于11号染色体短臂,属于基螺旋-环螺旋-PER-ARNT-SIM(basic Helix-loop-helix-Per-Arnt-Sim,bHLH-PAS)结构域转录因子家族,可通过调控昼夜节律变化,维持机体正常的生命活动[3]。作为哺乳动物生物钟的关键驱动因子,Bmal1也被认为是唯一的不能被替代的生物钟基因,在调控节律行为和一系列生理过程中发挥重要作用。研究表明,Bmal1 缺失可损害24 h 昼夜模式[16],导致昼夜节律紊乱和衰老相关疾病,如神经退行性疾病[17];同时Bmal1沉默还可能会增加心血管疾病和癌症的风险[18]。从分子机制上看,Bmal1 和Clock 转录因子可以形成二聚体作为正反馈环,该二聚体与Per和Cry 的E-box 元件相结合,使Per 和Cry 激活并相互作用,在细胞质中形成二聚体后转移到细胞核,进而形成负反馈环,抑制Bmal1/Clock 二聚体调控的转录[19]。除了Per 和Cry,孤儿核受体α(nuclear receptor subfamily 1,Rev-erbα)和视黄酸受体相关的孤儿受体(retinoic acid receptor-related orphan receptor,ROR)也可以形成额外的反馈环,分别发挥抑制和促进Bmal1 表达的作用[20]。在不同癌症中,异常表达的Bmal1 也发挥着不同的作用。在恶性胶质瘤中,Bmal1 呈低表达,敲低Bmal1 能显著增加U87MG 细胞的增殖、侵袭和迁移[5]。在鼻咽癌中,Bmal1 呈低表达,沉默Bmal1 可以促进鼻咽癌细胞的生长和代谢,且Bmal1 低表达与鼻咽癌患者的不良预后密切相关[6]。YANG 等[21]也发现使用Rev-erbα 拮抗剂SR8278 以及ROR 激活剂SR1078 处理肝癌细胞后,Bmal1 的表达水平显著升高,且肝癌的进展明显受抑制。在舌鳞状癌细胞中Bmal1 高表达同样可抑制肿瘤细胞的增殖和侵袭,且能够有效抑制小鼠体内的肿瘤体积增大[9]。但也有研究报道了Bmal1基因的促癌作用。在结直肠癌中,Bmal1 高表达的肿瘤患者对贝伐珠单抗(Bevacizumab,Beva)联合化疗反应性低,且无进展生存期缩短[22]。在恶性间皮瘤组织中,Bmal1 表达水平高于正常组织,敲低Bmal1 表达可以抑制肿瘤细胞生长,并诱导其凋亡[15]。
2 Bmal1在肿瘤中的作用机制
Bmal1 在肿瘤中的调控机制复杂多样,其可通过调控p53 下游靶点阻止致癌基因转化,进而调控细胞凋亡以及细胞周期进展,最终对肿瘤产生抑制作用;还可通过不同机制调控致癌基因Myc,从而达到抑制肿瘤的作用。Sirt1是一种NAD+依赖的组蛋白去乙酰化酶,其可通过负反馈调控Bmal1 促进肿瘤发生。另外,RAS 被激活能够参与MAPK 信号通路,进而使Bmal1 磷酸化,降低了Bmal1/Clock 的转录激活能力,最终促进肿瘤的发展。此外,昼夜节律也依赖于各种表观遗传机制,如Bmal1 的CpG 岛启动子高甲基化可导致其表观遗传失活,从而干扰生物钟功能,促进肿瘤的进展。Bmal1 与不同基因或信号通路之间的关系见图1。
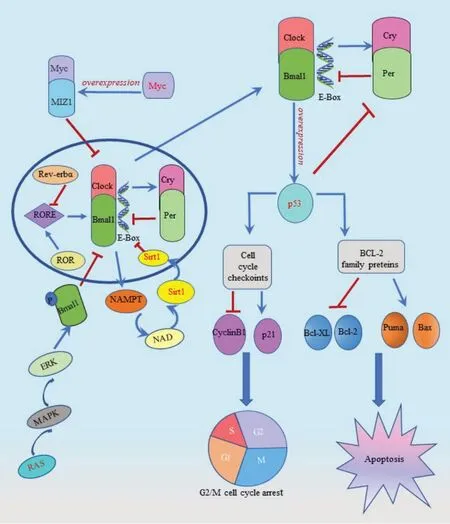
图1 Bmal1与不同基因或信号通路之间的关系Fig.1 The relationship between Bmal1 and different genes or signaling pathways
2.1 Bmal1促进p53基因磷酸化抑制肿瘤生长
抑癌蛋白p53 是耦合昼夜节律和细胞周期振荡的中心调控因子,可直接结合Per2启动子并抑制Per2表达,从而破坏Clock/Bmal1调控并改变昼夜节律[23]。p53 的磷酸化是p53 重要的翻译后修饰方式[24],而Bmal1 可激活p53 的磷酸化[25]。此外,Bmal1 可通过对p53 下游靶点的调控阻止致癌基因活化,如B 细胞淋巴瘤2(B-cell lymphoma-2,Bcl-2)家族蛋白,p53 也可增加Bcl-2 家族中的促凋亡蛋白转录表达,包括Bcl-2 相关X 蛋白(Bcl-2-associated X,Bax)和p53上调凋亡调控因子(p53 upregulated modulator of apoptosis,Puma)[26]。除抗凋亡蛋白Bcl-2外,Bmal1还可通过调控p53 下游的细胞周期检查点的转录,诱导细胞周期阻滞[27]。例如,在胰腺癌中,敲低Bmal1 表达会导致细胞周期检查点p21 表达降低,而细胞周期蛋白Cyclin B1 表达升高。这两个检查点的改变可导致细胞发生G2/M 期阻滞(图1)。综上,Bmal1 可以正向调控p53,通过改变细胞周期的进展发挥肿瘤抑制作用,但是Bmal1 与Clock 及p53 蛋白等相互作用的分子机制仍需进一步探索。
2.2 Myc基因与Bmal1相互调控促进或抑制肿瘤转移
Myc 蛋白由致癌基因Myc编码,在多种癌症中异常高表达,在肿瘤细胞中也容易扩增[24,28]。研究表明,Myc 家族转录因子高表达是导致多种癌症发生的重要因素[29]。在神经母细胞瘤中,与Clock/Bmal1 转录因子异二聚体相似,Myc和Myc相关因子X(Max)也能够形成二聚体并与E-box 元件相结合。Myc 通过E-box 位点激活Rev-erbα/β 的转录和表达从而抑制Bmal1 的转录,减弱生物钟的作用,以促进肿瘤转移[30]。而在骨肉瘤U2OS 细胞中,Myc 与E-box 调节的昼夜节律基因Rev-erbα/β、Per、Cry等的表达无明显相关性[31],因为Myc高表达后不依赖Rev-erbα 和Rev-erbβ通路,而是招募Myc/MIZ1 复合物到Bmal1 和Clock 启动子的非E-box 位点,导致生物钟失调,从而引起Bmal1 和Clock 表达下调,进而对肿瘤产生促进作用,提示Myc与生物钟基因Bmal1呈负相关性(图1)。c-Myc也是上皮间质转化(epithelial-mesenchymal transition,EMT)重要的调节因子,有助于癌症的代谢过程,其上调被认为是重要的癌症标志[32-33]。在结直肠癌中,Bmal1 过表达时,c-Myc 表达也增强;而升高的Bmal1水平可促使癌细胞发生EMT,进而诱导结直肠癌细胞的侵袭和迁移[34]。该研究进一步通过体外和临床试验分析Bmal1 和c-Myc 的关系,发现Bmal1 可通过激活MAPK信号通路进一步促进c-Myc表达和结直肠细胞迁移[34]。由此可见,在不同的肿瘤中Myc 与Bmal1之间的调控机制不尽相同。
2.3 Sirt1基因负反馈调控Bmal1促进肿瘤发生
沉默信息调节因子(sirtuins,Sirt)是一种高度保守的去乙酰化酶类,共有7种不同的亚型(Sirt1~Sirt7),其功能和定位各不相同。其中,Sirt1参与调控表观遗传修饰、代谢、DNA 修复和细胞应激反应[35-37],在癌症发生过程中也起关键作用。有研究发现,Sirt1在前列腺癌组织和细胞中过表达,用Sirt1抑制剂处理前列腺癌细胞后明显观察到其生长和活力受抑制,且Sirt1可通过抑制生物钟基因的转录调控昼夜节律的表达[38]。Sirt1 是一种烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)依赖的组蛋白去乙酰化酶。NAD 通过烟酰胺磷酸核糖转移酶(nicotinamide phosphoribosyl transferase,NAMPT)生成,且NAD 具有调节Sirt1 的作用。Clock/Bmal1 通过结合E-box,促进NAMPT表达,从而上调Sirt1,而Sirt1进入细胞核后可抑制Clock/Bmal1 表达,最终促进肿瘤发生[39](图1)。BELLET 等[38]测试了一系列已知具有Sirt1 激活物作用的化合物,发现Sirt1的激活改变了Bmal1转录驱动的生物时钟,诱导了昼夜节律基因表达的抑制,从而发挥促癌作用。由此认为,Sirt1可通过抑制生物钟基因的转录来调控昼夜节律的表达,对肿瘤发生发挥促进的作用。
2.4 RAS/MAPK 信号通路抑制Clock/Bmal1的转录活性促进肿瘤发展
RAS基因是癌症中常见的突变基因家族,主要包括HRAS、NRAS和KRAS基因,其中以KRAS基因的突变最为普遍[40]。RAS/MAPK 信号通路是癌症发生过程中最易突变的信号通路之一,RAS突变易发生在高死亡率的癌症中,如胰腺导管腺癌、结直肠癌、非小细胞肺癌等[41]。RAS 是其信号通路的中心蛋白,可以被多种蛋白激活并参与下游MAPK 通路,而MAPK 通路中的胞外信号调控激酶(Extracellular signal-regulated kinase,EPK)能使Bmal1 多个位点发生磷酸化,进而降低Clock/Bmal1 的转录激活能力,促进结直肠癌增殖和迁移[42-43](图1)。RELÓGIO 等[42]通过数学模型分析发现RAS 会干扰昼夜节律,促进肿瘤发展,RAS高表达可延长昼夜节律,而抑制RAS/MAPK 信号通路则显现出较短的昼夜周期。这些研究表明RAS/MAPK可能通过抑制Clock/Bmal1的转录活性,以调节昼夜节律,进一步促进肿瘤发展。
2.5 表观遗传调控阻断生物钟促进肿瘤进展
表观遗传是指DNA 序列不发生改变,而细胞的表型及基因表达发生了可遗传的改变。昼夜节律通过转录翻译网络系统进行调节运作,并依赖于各种表观遗传机制,包括增强子/抑制子的激活,组蛋白和其他蛋白质的乙酰化/去乙酰化以及DNA 甲基化等[44]。DNA 的甲基化与肿瘤发生发展密切相关。在人类多种肿瘤中,肿瘤抑制基因的启动子区域都高甲基化[45]。而在癌症细胞基因组的其他区域发生低甲基化会导致染色体不稳定和原癌基因的高度表达[46]。DNA 的甲基化是生物体在DNA 甲基转移酶(DNA methyltransferase,DNMT)催化下,以S-腺嘌呤甲硫氨酸(S-adenine methionine,SAM)作为甲基供体,选择性地将甲基转移到CG 两个核苷酸的胞嘧啶上,最终形成5-甲基胞嘧啶(5mC)的过程(图2),是一种被广泛研究的表观遗传修饰方式,在调控基因表达和染色质构象等方面发挥重要作用。CpG 岛主要位于基因的启动子附近,数量稀少,却可以控制人类70%的基因表达。CpG 岛中DNA 胞嘧啶部分的甲基化是一个至关重要的生物学机制。CpG 岛在基因组的启动子中过度表达[47],并且GpG 岛的甲基化可以沉默相应的基因[48]。在人类癌症中,昼夜节律核心基因经常被解除调控或沉默。TANIGUCHI 等[49]发现Bmal1 的CpG 岛启动子高甲基化,导致其表观遗传失活,进而损害了c-Myc、P300等基因的昼夜节律表达。与Bmal1 相关的DNA 高甲基化缺失,则阻止其伙伴Clock 向它们的共同靶点募集,进一步干扰生物钟功能(图2)。在弥漫性B 细胞淋巴瘤、急性淋巴细胞白血病和髓系白血病等血液系统恶性肿瘤中,阻断细胞昼夜节律时钟可使靶基因的昼夜节律性丧失,从而促进肿瘤发展。在生物钟基因启动子区域,特别是近端启动子区域,通过局部的CpG 高甲基化或低甲基化调节,可使夜班工作患者的Bmal1、Clock 和Cry1 甲基化增强,进一步增加了其患癌症的风险[50]。Bmal1 的表观遗传调控从染色质层面解释了肿瘤中生物钟基因的非节律性表达,未来进一步探索表观遗传所介导的生物钟基因表达的改变将有助于发现新的靶点,并为指导及设计有效的肿瘤时间疗法提供新思路。
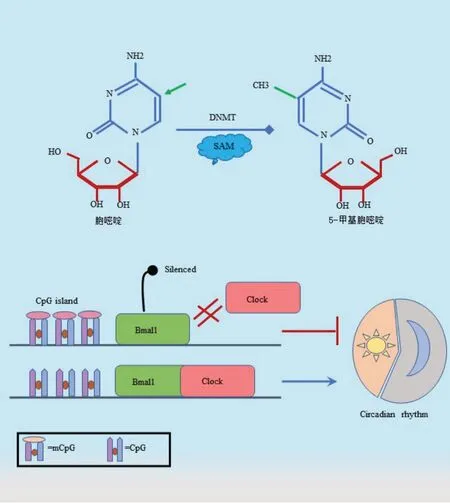
图2 DNA甲基化原理及其与Bmal1的调控关系Fig.2 Principle of DNA methylation and its regulatory relationship with Bmal1
3 时辰疗法在肿瘤中的应用
目前,探索昼夜节律用于癌症治疗也已引起学者们的广泛关注。时辰疗法作为一种新兴的癌症治疗方法,也逐渐成为肿瘤治疗及临床研究的新热点。时辰疗法主要依赖于昼夜节律时间系统(circadian timing system,CTS),该系统控制代谢和生物活动的昼夜节律以及药物的吸收、分布、代谢和排泄,从而影响受节律性生理和昼夜时钟信号控制的抗癌药物的生物钟药代动力学[51]。针对恶性肿瘤细胞具有节律性这一特点,可以选择在正常细胞耐受性最好而肿瘤细胞敏感性最强的时候给予抗肿瘤药物,从而最大程度地保护正常细胞而杀死癌细胞,使药物产生最快的效果、最大的效率及最小的副作用。Bmal1 是生物钟的一个重要转录因子,表现出一个较稳定的昼夜节律,可作为个性化时间治疗的直接分子目标以确定最佳药物管理时间,有助于提高抗癌药物的疗效,降低抗癌药物的副作用。研究表明,Bmal1 的表达会影响化疗药物的敏感性,包括奥沙利铂[52]、紫杉醇[9]等。在头颈癌中,紫杉醇的疗效与Bmal1 的表达高度一致。Bmal1 的表达量越高,紫杉醇的疗效越好,在紫杉醇给药处理后,Bmal1 过表达会使细胞阻滞在S 期和G2/M 期,并诱导细胞凋亡。该研究同时分析了紫杉醇与Bmal1 昼夜节律的相关性,以早上八点为授时因子时间(zeitgeber 0,ZT0),Bmal1 水平在ZT10 达到最高,此时的肿瘤体积最小;而在ZT22 时其水平达到最低,此时的肿瘤体积最大,说明在Bmal1 表达较高时给予紫杉醇处理可以增加其抗肿瘤效果[9]。同样,在结肠癌中,Bmal1 过表达也可以增强肿瘤细胞对奥沙利铂的敏感性,增加奥沙利铂诱导肿瘤细胞凋亡的水平,且Bmal1高表达患者较Bmal1低表达患者有更好的中位生存期和无进展生存期[52]。在胃癌中,干扰Bmal1表达可调控胃癌细胞增殖,且与时间呈正相关,Bmal1特异性沉默后抑制了胃癌细胞中野生型p53 的表达,形成了一个正反馈环路,干扰这一环路或者利用肿瘤组织与正常组织的表达差异性,可增加胃癌治疗的敏感性,同时增强正常组织的耐受性,从而为肿瘤的时辰治疗奠定理论基础[53]。此外,还有研究发现上调Bmal1 表达可减轻小鼠的化疗毒副反应,增加其化疗耐受性[54]。以上研究提示,根据细胞的昼夜节律并运用时辰疗法在肿瘤治疗中展现了巨大潜力。然而,目前针对时辰疗法的研究仍较少,其在癌症治疗中的成效也缺乏有力的证据支持,未来仍需要更深入地了解生物钟对抗癌药物的确切作用以及一些变量例如年龄、性别等对时间疗法的影响,才能使患者真正获益。
4 小结
昼夜节律与肿瘤的发生发展密切相关,可通过神经内分泌、细胞周期调控、癌基因与抑癌基因、肿瘤微环境等影响细胞的生长、发育、衰老以及凋亡。目前研究显示,生物钟基因Bmal1可通过调控p53、Myc、Sirt1、RAS/MAPK 信号通路以及表观遗传机制等发挥着抑癌或促癌作用。在抗肿瘤治疗中,时辰疗法以个体昼夜节律为基础,充分考虑患者的个体差异,可以改善肿瘤患者耐受性,提高抗肿瘤治疗效果。Bmal1基因在时辰疗法也展现了较大的应用前景,可能是新的治疗靶点。然而,昼夜节律与癌症之间的关系极其复杂,在临床上合理的预测癌症患者的给药时间具有很大挑战性。通过阐明Bmal1和不同蛋白或信号通路的相互作用,以及它们在不同肿瘤中发挥的具体作用,有望进一步了解肿瘤的发生和转移机制,更好地把握给药的昼夜效应。

