基于雄激素受体相关基因评分系统在膀胱癌预后预测中的作用及临床意义
莫晗 刘桧 冯超 谢远亮,3 王秋雁 李天宇
作者单位:530021 南宁1广西医科大学第一附属医院泌尿外科;2广西医科大学基因组与个体化医学研究中心;3广西医科大学附属肿瘤医院泌尿外科
膀胱癌是泌尿系统中最常见的一种恶性肿瘤,其发病率居恶性肿瘤的第10 位,死亡率居恶性肿瘤的第12 位[1]。近年来,尽管膀胱癌的诊疗手段有了很大的改进,但是膀胱癌患者的生存情况并未得到较大的改善。因此,迫切需要开发新的个性化治疗方案来延长患者的生存期。据统计,男性的膀胱癌发病率远高于女性,而雄激素可能是诱导这一结果的重要因素[2]。因此,雄激素及其受体受到了广泛的关注。雄激素受体(androgen receptors,AR)属于核受体超家族[3-4],其在人体中广泛分布[5-6]。AR 信号通路可能作为表皮生长因子(epidermal growth factor,EGF)促进膀胱癌进展的一个重要中介路径,而雄激素也可以通过AR信号通路调节Slug的转录以促进膀胱癌细胞的上皮间质转化,从而促进膀胱癌的发展[7]。然而,AR作为膀胱癌患者分层或辅助诊疗的指示作用尚未清楚。本研究利用TCGA-BLCA 队列构建膀胱癌AR 相关基因评分系统,同时通过全转录组测序技术和高通量的单细胞质谱流式技术探讨不同AR评分患者的分子特征、肿瘤微环境的异质性特征,以及特征细胞亚群的潜在作用机制,为膀胱癌个性化治疗方法的开发提供了潜在靶点和理论依据。
1 材料与方法
1.1 主要材料
1.1.1 临床样本收集 收集2018年1月至2019年12月在广西医科大学第一附属医院泌尿外科收治的29 例膀胱癌患者的膀胱癌组织样本。纳入标准:⑴年龄≥18 岁;⑵符合手术指征,首诊膀胱癌且术前未经过放化疗或经尿道膀胱肿瘤电切等治疗;⑶随访资料完整;⑷术后经病理组织学确诊为膀胱癌。排除膀胱肿瘤组织坏死严重或因膀胱肿瘤组织过少而未能取得癌组织者,以及无相关知情同意书者。总生存期(overall survival,OS)定义为患者从手术日期到诊断死亡或者最后1次有效随访日期。随访时间以月为单位,所有患者自出院后6 个月开始采取电话联系的方式进行随访,之后每6个月随访一次,最近一次随访时间为2023年4月。所有未发生阳性结局(死亡)的患者均成功随访,无失访例数。每个样本均进行质谱流式、RNA测序和免疫组织化学染色检测。所有患者均已提供书面知情同意书。本研究通过广西医科大学第一附属医院医学伦理审查委员会批准(伦理编号:2023-E359-01)。
1.1.2 生物信息学数据 从TCGA 数据库(https://gdc.cancer.gov/)获取403例肌层浸润性膀胱癌(muscleinvasive bladder cancer,MIBC)患者的AR 表达数据及临床资料。根据AR表达量的最优截断值将患者分为高AR 表达组(277 例)和低AR 表达组(126 例),采用Log-rank 法比较两组OS 差异并选择Wilcoxon 秩和检验对两组的病理分级进行比较。从GEO 数据库(https://www.ncbi.nlm.nih.gov/geo/)获取GSE-13507队列患者(165 例)的AR 表达数据及临床资料,同时按照上述TCGA-BLCA 队列的处理方法比较两组患者的OS。
1.2 质谱流式样本染色与数据分析
膀胱癌组织经修剪、解离、切割、过滤、红细胞裂解后,制备成单细胞悬液。取150 万个细胞,用顺铂进行死细胞染色、Fc 受体阻断封闭、胞膜表面标志物染色、胞质/核标志物染色、甲醛固定及细胞嵌入剂Ir染色,最后经清洗后,加入10%的EQ™校准珠溶液重悬细胞,于4 ℃条件下保存,待上机检测。本实验所用质谱流式细胞仪为美国Fluidigm 公司所生产(型号:Helios 2),检测指标分别为免疫系统指标及肿瘤微环境指标。其中免疫系统指标包括CD3、CD4、CD7、CD8a、CD11b、CD11c、CD14、CD19、CD20、CD27、CD28、CD33、CD45、CD45RA、CD45RO、CD56、CEACAM-6、CD68、CD95、CD127、CD137、CD152(CTLA-4)、CD163、CD274(PD-L1)、CD278(ICOS)、CD279(PD-1)、TIM-3、EOMES、Foxp3、Granzyme B、HLA-DR、T-bet、TCR、TNF-α。肿瘤微环境指标包括CD13、CD24、CD34、CD44、CD47、CD54、CD90、CD104、CD133、CD166、CD274(PD-L1)、CD326(EpCAM)、CD333(FGFR3)、ALDH、c-Myc、CK6、CK5、ERα、ERβ、Ki67、KLF4、LGR5、MET、MUC1、Nanog、Notch2、OV6、p21、p53、Sox2、Vimentin、CD45。
将质谱流式检测数据上传到Cytobank 网站(http://www.cytobank.org/),进行数据挖掘和分析。对上传的数据进行质控分析和预处理,设置所用抗体及金属标签名称。在获取FCS 文件后,用R 软件对其进行降维、归一化,并导入R 软件程序包(FlowSOM、cytofexplorer等)对上述检测指标进行个性化分析。
1.3 RNA测序
首先,使用TRIzol 试剂盒从组织中提取总RNA,并使用Ribo-Zero rRNA 试剂盒将核糖体RNA(rRNA)从总RNA 中去除。然后,通过对纯化的信使RNA(mRNA)逆转录,构建互补DNA(cDNA)文库并通过PCR 扩增文库。在Illumina HiSeq 4000 测序仪上测序150 个周期后使用FastQC 软件对原始测序数据的质量进行评估。最后,使用Fastp 对原始数据进行预处理[8],使用HISAT2 和StringTie 将处理后的数据映射到人类基因组(hg19)[9-10]。本课题的测序工作由北京诺禾致源科技股份有限公司完成,每个样本的测序深度为8 G。
1.4 基因集富集分析及AR评分的计算
基因集富集分析(gene set enrichment analysis,GSEA)所用软件版本为GSEA-4.1.0,数据集为c5.all.v7.5.1.symbols(https://www.gsea-msigdb.org/gsea/msigdb/index.jsp)。根据文献[11]报道中的一个含有8 个AR 相关基因(AR、NKX3-1、KLK3、CHRNA2、SLC45A3、TARP、NAP1L2 和S100A14)的基因集,利用R 语言软件(版本号3.6.1)中的基因集变异分析(Gene Set Variation Analysis,GSVA)包计算AR评分(GSVA 包版本号1.42.0),然后将每个患者所得AR 评分数据及临床生存数据上传至网络在线分析平台Sangerbox(http://sangerbox.com/),利用“surv_cutpoint”函数进行最优截断值的计算,并根据最优截断值将患者分为高AR 评分组及低AR 评分组进行后续分析[12]。
1.5 免疫浸润分析
通过R 软件包“IOBR”(版本号:0.99.9)中的CIBERSORT 和EPIC 算法结合TCGA-BLCA 队列中的每个样本的转录组数据对其进行免疫细胞浸润分析,比较高AR评分组和低AR评分组各类免疫细胞的比例。
1.6 统计学方法
运用R 软件(3.6.1 版本)及GraphPad Prism 软件(8.0.1版本)进行分析。生存分析采用Kaplan-Meier 法构建MIBC 患者的生存曲线,并应用log-rank 检验进行比较。鉴于本研究中的数据为非正态性连续变量,根据数据分布特点,选择Wilcoxon 秩和检验对两组数据进行比较,以P<0.05 为差异有统计学意义。
2 结果
2.1 不同AR评分与膀胱癌患者预后的关系
TCGA-BLCA 队列的数据分析结果显示,高AR 表达患者的OS较AR 低表达患者差,但差异无显著统计学意义(P=0.104;图1A)。此外,AR 表达与膀胱癌的病理分级也无明显相关性(P>0.05;图1B)。本研究利用GSVA 算法对TCGA-BLCA 队列进行AR 评分,根据最优截断值(AR 评分≥-0.066 分)将这403 例患者分为高AR 评分组(n=207)和低AR 评分组(n=196),结果发现高AR评分组患者的OS明显低于低AR评分组(P=0.009;图1C)。
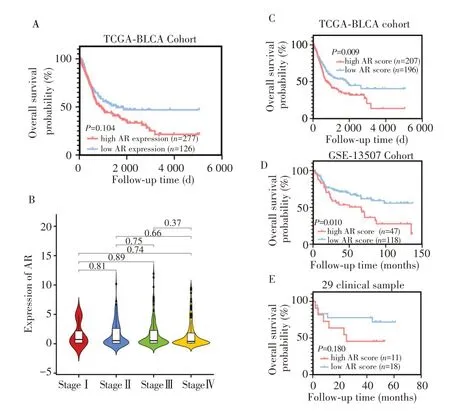
图1 高AR评分组与低AR评分组组患者的预后Fig.1 Prognosis of patients in the high AR score group versus the low AR score group
进一步利用GEO数据库GSE-13507队列的165 例膀胱癌患者作为验证组并对其进行AR评分。根据最优截断值(AR 评分≥0.200分),将患者分为高AR 评分组(n=47)及低AR 评分组(n=118),高AR 评分组患者的OS 明显比低AR 评分组患者差(P=0.010;图1D)。将本课题组收集的29 例膀胱癌样本进行AR 评分,并根据最优截断值(AR 评分≥0.203 分)进行分组。结果显示,高AR 评分组(n=11)患者的OS 较低AR 评分组(n=18)差,但差异无显著统计学意义(P=0.180;图1E)。进一步分析不同AR 评分与临床病理特征的关系,结果发现高AR 评分组患者中分期为T3 期及以上的比例更高,而低AR 评分组的患者其临床分期主要为T2 期,且高AR 评分组患者的膀胱癌分级均为高级别尿路上皮癌。从年龄上看,相比于低AR评分组,高AR 评分组患者的年龄都在55 岁以上,更倾向于年老患者(表1)。
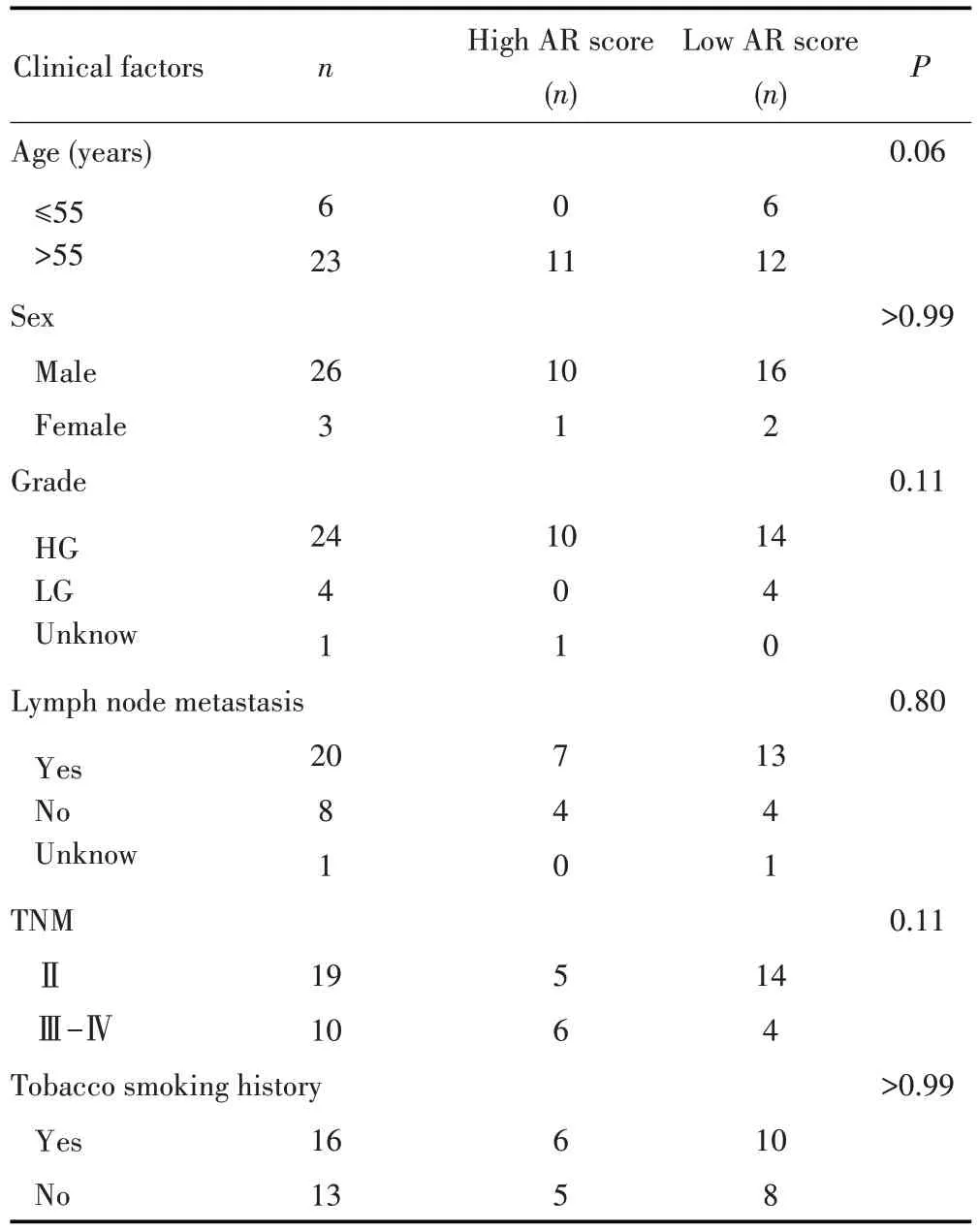
表1 29例膀胱癌患者的临床信息表Tab.1 Clinical information sheet of 29 bladder cancer patients
2.2 不同AR评分膀胱癌患者的GSEA富集分析
对TCGA-BLCA 队列进行GSEA 分析,结果显示,ERBB、VEGF 信、MAPK、WNT 及NF-κB 等信号通路主要在高AR 评分组富集(图2A)。DNA 分解代谢、mRNA 剪切、卡哈尔体、烟酰胺腺嘌呤二核苷酸脱氢酶等通路主要在低AR评分组富集(图2B)。
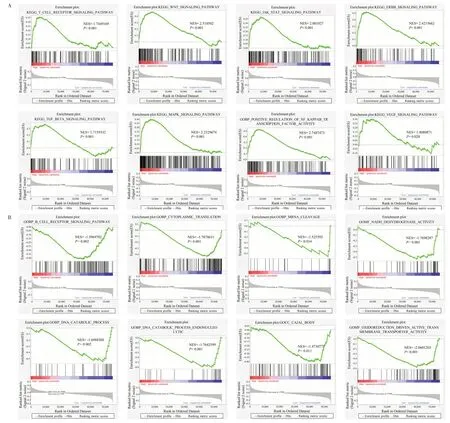
图2 TCGA队列中高AR评分组组及低AR评分组组GSEA富集分析结果Fig.2 GSEA enrichment analysis for the high AR score group and low AR score group in the TCGA cohort
2.3 不同AR 评分对膀胱癌患者肿瘤免疫微环境多样性的影响
为分析高AR 评分组与低AR 评分组患者的肿瘤免疫微环境异质性,利用CIBERSORT 和EPIC 算法对TCGA-BLCA 队列中的每个样本进行免疫细胞浸润分析,结果显示,CD4+T 细胞(P=0.001)、树突状细胞(P<0.001)和记忆性CD4+T 细胞(P=0.028)在高AR 评分组中的比例显著高于低AR评分组(图3A~C),表明不同AR评分膀胱癌患者的肿瘤微环境可能存在较大的异质性。
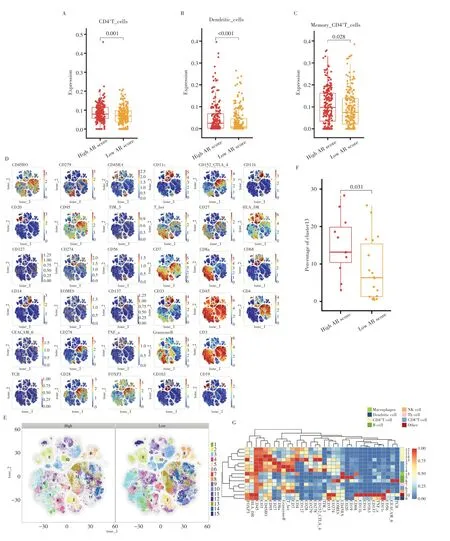
图3 高低AR评分组患者的免疫细胞亚群多样性及异质性表型Fig.3 Immune cell subpopulation diversity and heterogeneous phenotypes in patients in high and low AR score groups
应用质谱流式技术在单细胞水平精准分析29 例不同AR评分膀胱癌患者的免疫细胞,经过对高维数据的降维和聚类后(图3D~E),结果显示,29 例膀胱癌患者的免疫细胞可分成15 个免疫细胞亚群,包括4 个CD4+T 细胞亚群、4 个CD8+T 细胞亚群、2 个B 细胞亚群、1 个NK 细胞亚群、1 个巨噬细胞亚群、1 个Th 细胞亚群、1 个树突状细胞亚群及1 个无法准确定义的免疫细胞亚群(图3G)。在这些具有多样性表型的免疫细胞亚群中,4 个CD4+T 细胞亚群不同程度地表达免疫检查点,表现出免疫抑制的状态。其中CD4+T 细胞亚群13 高表达FOXP3 和免疫检查点CTLA-4、CD279(PD-1)、CD274(PD-L1),其在高AR评分组的比例显著高于低AR 评分组(P=0.031)(图3F),是两组比较间唯一具有统计学意义的细胞亚群,提示CD4+T 细胞亚群13 可能是一群具有强免疫抑制表型的细胞亚群。
2.4 不同AR 评分膀胱癌患者肿瘤干样细胞亚群的分布
为了精准分析高AR 评分组和低AR 评分组肿瘤细胞的多样性,本研究通过质谱流式技术分析29 例膀胱癌患者癌组织细胞中32 个肿瘤微环境标记物的表达情况,并通过数据降维和聚类后,发现癌组织中的249 389 个细胞可分成20 个不同的细胞亚群,且这些细胞亚群在高AR 评分组和低AR 评分组中的分布比例提示两组的肿瘤微环境具有较大的异质性(图4A-B)。通过对各细胞亚群的标志物进行分析,结果(图4C)发现20个细胞亚群包括8个肿瘤上皮细胞亚群(CD326+CD45-/low)、2个免疫细胞亚群(CD326-/lowCD45+)以及10 个同时具有肿瘤上皮细胞和免疫细胞特征的细胞亚群(CD326+CD45+)。其中肿瘤干样细胞亚群13 高表达免疫检查点PD-L1、肿瘤干细胞标志物OV6。进一步分析发现,肿瘤干样细胞亚群13在高AR评分组中的比例显著高于低AR 评分组(P=0.008)(图4D),同时是两组间最具统计学差异的细胞亚群,表明肿瘤干样细胞亚群13 可能参与了肿瘤干性的维持及免疫抑制微环境的形成。
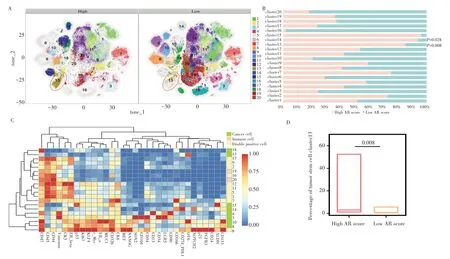
图4 高AR评分组及低AR评分组患者的肿瘤微环境图谱Fig.4 Tumour microenvironment mapping in patients in the high AR score group and low AR score group
3 讨论
众多证据表明,雄激素及其受体在膀胱癌的发生发展中发挥了重要作用[13-14]。但AR对膀胱癌患者的分层能力或辅助诊疗作用目前尚未明确。为了评估AR 对膀胱癌患者预后判断的潜能,本研究分析了TCGA-BLCA 队列中403 例MIBC 患者AR 的表达情况,结果与文献[15]报道相一致,高AR 表达与低AR 表达患者的预后差异无统计学意义,且AR 的表达水平与膀胱癌的病理分级无明显相关性。为了进一步探究AR 与膀胱癌预后的相关性,本研究根据文献[11]报道的一个与AR 相关的基因集,基于TCGA-BLCA队列构建了膀胱癌AR 相关基因评分系统,并在GSE-13507 队列和29 例自有膀胱癌临床样本中进行验证,结果显示,所有的队列均呈现出高AR评分组患者较低AR 评分组患者预后更差的趋势。虽然29 例膀胱癌临床样本中高AR 评分组和低AR 评分组患者的OS差异无统计学意义,但高AR 评分组患者的临床分期更晚,病理分级更高,提示高AR评分可能与膀胱癌患者不良预后密切相关。
为了探究高AR 评分组和低AR 评分组潜在的作用机制,本研究对TCGA-BLCA 队列进行GSEA 分析,结果高AR评分组主要被富集在WNT、TGF-β、MAPK及ERBB等信号通路,低AR评分组主要被富集在mRNA剪切、卡哈尔体、烟酰胺腺嘌呤二核苷酸脱氢酶等信号通路。这表明高AR 评分组和低AR 评分组患者的肿瘤进展分子机制不同。
肿瘤细胞和肿瘤微环境之间不断的相互作用在肿瘤的起始、进展、转移和治疗的反应中起着关键性的作用[16-17]。单细胞质谱流式技术是近年来备受关注的肿瘤异质性及肿瘤微环境研究的“明星技术”,它可以实现同时对单细胞几十种蛋白参数的检测[18],目前已经被广泛应用于肿瘤微环境的研究[19]。为了揭示两组患者的肿瘤微环境的异质性,本研究应用质谱流式技术在单细胞水平精准分析这29 例膀胱癌患者的免疫细胞和肿瘤微环境的多样性表型及异质性,结果发现了一群高表达FOXP3,免疫检查点CTLA4、CD279(PD-1)、CD274(PD-L1)的CD4+T细胞亚群在高AR 评分组中富集;同时还发现一群高表达肿瘤干性相关标志物OV6、免疫检查点PD-L1 的肿瘤干样细胞亚群在高AR 评分组中富集,且该细胞亚群与不良预后密切相关。据文献报道,PD-1以及PD-L1是非常重要的免疫检查点,肿瘤细胞可以利用其进行免疫逃逸[20]。而免疫检查点抑制剂可以通过阻断免疫检查点信号通路来促进肿瘤免疫细胞活化以消除肿瘤细胞[21]。在国内的膀胱癌诊断治疗指南中,免疫检查点抑制剂也被推荐作为对于不适合顺铂且PD-L1 高表达患者的一线治疗方案[22]。免疫抑制性CD4+T 细胞亚群13 以及具有免疫抑制表型的肿瘤干样细胞亚群13 在高AR 评分组中的显著富集表明高AR 评分组患者的肿瘤微环境免疫抑制状态更严重,其免疫治疗响应可能更高,更适合进行免疫治疗,也提示AR 及其相关信号通路可能是未来膀胱癌个体化诊疗的一个重要靶点,值得我们继续深入研究。
综上所述,本研究基于一个8 个基因组成的AR基因集构建了AR 评分系统,该评分系统可对不同预后的膀胱癌患者进行分层,高AR 评分组患者的预后较低AR 评分组患者差。同时,本研究揭示了不同AR 评分患者的分子特征和肿瘤微环境异质性,为膀胱癌个性化治疗方案的开发提供了潜在的靶点和理论依据。但是本研究存在一定的局限性:⑴本研究的样本量较小,需要后续多中心、大样本进行深入研究;⑵高AR 评分组的分子机制需要进行细胞和动物实验的验证。

