二甲双胍调控Gas6/Axl信号通路抑制食管鳞癌细胞增殖及迁移
陈虹羽 宁守斌 陈晓 李曼华 徐梦楠 李白容 李慧 李静 于妍 范崇熙
作者单位:100142 北京 空军军医大学特色医学中心消化内科
食管癌(esophageal cancer,EC)是由鳞状上皮或腺上皮的异常性增生引起的消化系统恶性疾病,最常见的病理类型为鳞状细胞癌[1]。我国是食管鳞状细胞癌的高发地区,大多数患者就诊时已处于中晚期,失去有效的治疗机会[2]。因此,提高食管鳞状细胞癌患者预后的关键在于寻找新型有效的诊断靶点和治疗手段。近年来,二甲双胍在抗肿瘤方面引起广泛关注,它能降低糖尿病患者患食管癌的风险,也能明显改善合并有食管癌患者的预后[3],但其机制尚未阐明。
生长停滞特异蛋白6(growth-arrest-specific protein 6,Gas6)是血浆中维生素K 依赖的蛋白家族中的成员之一,Axl 则是其跨膜酪氨酸激酶受体[4]。既往研究发现,Gas6参与多种病理生理过程,包括免疫反应、炎症、凝血、细胞生长和凋亡等[5]。研究已证明,二甲双胍通过激活Gas6 可以减轻肥胖或胰岛素抵抗条件下的脂肪组织炎症反应[6],然而Gas6 及其配体Axl 是否参与二甲双胍抗食管鳞状细胞癌作用未见报道。本研究探讨二甲双胍抑制EC109增殖及转移过程,观察凋亡、线粒体功能以及Gas6/Axl 信号通路的变化,旨在阐明二甲双胍抗食管鳞状细胞癌的新机制,为开发针对Gas6/Axl 信号通路抗消化系统恶性肿瘤的治疗策略提供新的理论基础。
1 材料与方法
1.1 主要材料
人源性食管鳞癌细胞系EC109 和TE-1 购自中国科学院上海生命科学研究院细胞资源中心,人源性食管正常粘膜上皮细胞系HET-1A(CRL-2692)购自美国ATCC 公司。18 只BALB/C 雄性裸鼠(6~8 周,18~22 g)采购和饲养于空军军医大学实验动物中心SPF级动物房内。
二甲双胍(metformin,M2009)购自上海梯希爱化成工业发展有限公司;Bemcentinib(R428,HY-15150)购自美国MedChemExpress 公司;CCK-8 试剂购自上海七海复泰生物科技有限公司;高糖DMEM 培养基购自美国Gibco 公司;RPMI 1640 培养基购自武汉普诺赛生命科技有限公司;胎牛血清(FND500)购自上海吉泰依科赛生物科技有限公司;结晶紫购自上海碧云天生物技术有限公司;TUNEL 试剂盒购自瑞士Roche公司;Mito-SOX 荧光染料购自美国Invitrogen 公司;JC-1荧光染料购自上海翊圣生物科技有限公司;Gas6和细胞色素C(cytochrome C,CytoC)抗体购自美国Abcam 公司;Axl(#8661)、Bax(#2772)、Bcl2(#3498)和Caspase3(Cas3,#9662)抗体购自美国Cell Signaling Technology 公司;p-Axl 抗体购自美国Bio-Techne 公司;β-actin 抗体购自美国Affinity Biosciences 公司;Cy3 标记的山羊抗兔荧光抗体(SA00013-4)购自美国proteintech 公司;辣根酶标记的山羊抗鼠(ZB-5305)或山羊抗兔IgG 抗体(ZB-2301)购自北京中杉金桥生物技术有限公司。
1.2 方法
1.2.1 细胞培养 EC109 和Het-1A 细胞均接种于含10%胎牛血清的DMEM 培养基中,TE-1 细胞接种于含10%胎牛血清的RPMI-1640 培养基中,并在37 ℃、5% CO2的清洁饱和湿润环境下培养。待细胞生长密度≥80%时,进行消化传代,取对数生长期的细胞用于后续实验。
1.2.2 CCK-8 法检测细胞活性 以5×103个/孔的密度将EC109、TE-1 和Het-1A 分别接种于96 孔板内,每组6 个复孔。培养12 h 后,分别给予不同浓度的二甲双胍(0、5、10、20 mmol/L)或R428(0、0.1、0.2、0.3、0.4、0.5 µmol/L)处理48 h,观察对EC109 细胞的抑制作用,随后选取适合的浓度用于后续实验。测定细胞活性时,在各组处理结束后,弃上清液,加入100 µL的CCK-8 溶液(浓度为10%),37 ℃避光孵育2 h,用酶标仪测定于450 nm 波长处吸光值。细胞活力(%)=[(As-Ab)/(Ac-Ab)]×100%,As为实验组吸光度、Ac为对照组吸光度、Ab为空白组吸光度。
1.2.3 平板克隆形成实验测定细胞增殖能力 不同浓度的二甲双胍(0、10、20 mmol/L)处理48 h后收集贴壁EC109 细胞,并将500 个活细胞接种于6 孔板内,培养14 d。应用无水乙醇(99.7%)室温固定10 min,适量结晶紫染色15 min,室温干燥2 d。Image J 软件计算克隆形成数。
1.2.4 细胞划痕和Transwell 实验测定细胞迁移能力 EC109 细胞接种于6 孔板中,待细胞融合率达到100%时,用P200 枪头在细胞层上进行划痕,PBS 洗2 次。随后用含2%胎牛血清的不同浓度二甲双胍溶液(0、2.5、5 mmol/L)或二甲双胍溶液(2.5 mmol/L)联合R428(0.3 µmol/L)处理细胞72 h,随机选取3 个视野计算划痕间的距离计算平均值。
Transwell 实验检测EC109 细胞迁移能力。将处于对数生长期的细胞用含二甲双胍的培养基(0、2.5、5 mmol/L)重悬浮后,调整细胞浓度为2×105/L。各取100µL 细胞悬液加入Transwell 上室;同时,下室加入600 µL 完全培养基。将细胞培养24 h 后,擦除Transwell上室滤膜上表层的细胞,用结晶紫对滤膜下表层的细胞进行染色,使用显微镜观察并拍照、计数。
1.2.5 Tunel 染色检测细胞凋亡情况 以8×103个/孔的密度将EC109 接种于玻底培养皿并给予二甲双胍(0、10、20 mmol/L)处理后,向各组细胞中加入500µL TUNEL染色液,37 ℃避光孵育1 h。随后利用PBS 充分清洗,加入1 µg/mL 的DAPI 溶液,室温孵育15 min。PBS 彻底清洗并用50%甘油溶液封片后,应用激光共聚焦显微镜选取5 个随机视野计数,计算凋亡率,凋亡率(%)=绿色细胞数/蓝色细胞数×100%。
1.2.6 Mito-SOX 探针标记细胞线粒体氧化应激情况 将8×103个细胞接种于玻底培养皿并给予二甲双胍处理后,加入终浓度为5µmol/L 的Mito-SOX 探针,37 ℃避光孵育30 min,PBS洗涤3次,加入1 mL完全培养基后应用激光共聚焦显微镜拍照,激发光为510 nm,发射光为580 nm。Image J 软件计算红色荧光细胞数量的百分比。
1.2.7 JC-1 检测细胞线粒体膜电位(mitochondrial membrane potential,MMP)水平 生理条件下,聚合状态下的JC-1存在于线粒体内,在荧光显微镜下呈现红色;当细胞受到外界刺激发生凋亡时,线粒体膜电位发生去极化反应,JC-1 分解则为单体形式,在荧光显微镜下变为绿色,此时MMP 降低、线粒体膜稳定性失衡、线粒体功能受损;通常用红绿荧光的相对强度比值评价细胞MMP 的水平[7-8]。以8×103个/孔的密度将EC109 细胞接种于玻底培养皿,并给予二甲双胍(0、10、20 mmol/L)处理后,加入1 mL 的JC-1 工作液,避光37 ℃孵育20 min;弃上清并用专用缓冲液洗涤5 次,加入2 mL 无血清培养基,应用激光共聚焦显微镜拍照。检测JC-1 单体时激发光为514 nm,发射光为529 nm;检测JC-1 聚合物时,激发光为585 nm,发射光为590 nm。Image J 软件计算红色和绿色荧光平均强度的比值以反应MMP的变化情况。
1.2.8 免疫荧光染色检测Gas6 细胞内的表达情况 处理后的EC109 细胞经过多聚甲醛(4%)固定和Triton X-100(0.3%)通透后,加入稀释后的Gas6 抗体(1∶200),4 ℃孵育过夜。次日,利用PBS 充分洗去未结合的Gas6 抗体,加入Cy3 标记的山羊抗兔荧光抗体,室温孵育2 h。随后应用1µg/mL 的DAPI 溶液标记细胞核,应用激光共聚焦显微镜观察拍照。Image J软件计算荧光的平均强度。
1.2.9 免疫印记实验检测目标蛋白的含量变化 物理刮除、收集处理后的EC109 和TE-1 细胞,裂解并应用BCA试剂盒测定各组蛋白浓度。经高温变性,利用SDS-PAGE 凝胶进行蛋白分离电泳,湿转法将蛋白质转移至PVDF 膜上,利用5%BSA 的TBST 溶液在室温环境下封闭2 h。随后加入一定浓度的一抗(p-Axl 为1∶200,Gas6、CytoC、Axl、Bax、Bcl2、Cas3 为1∶1 000,β-actin 为1∶2 000),4 ℃孵育过夜。次日,利用TBST溶液充分清洗后,加入相应的辣根酶标记的山羊抗鼠或山羊抗兔IgG 抗体(1∶5 000),室温孵育2 h,电化学发光后利用成像分析系统采集信号和图片。
1.2.10 裸鼠皮下荷瘤实验检测EC109 细胞在体生长情况 将对数生长期的EC109 细胞制成悬液,计数后将1.5×106个细胞接种于裸鼠左后肢皮下。隔日测量瘤体大小和体重,按公式V=0.5×L×D2(L 为最大直径,D 为与L 垂直的横径)计算瘤体体积。成瘤体积达100 mm3后,随机分配至对照组(给予等体积生理盐水处理,每天1 次)、二甲双胍(250 mg/kg,每天1次)灌胃组、二甲双胍联合R428(25 mg/kg,每天2 次)灌胃组。SPF 环境下饲养21 d 后,行颈椎脱臼法处死动物、称体重并剥离瘤体组织,所有操作均获得空军军医大学实验动物中心伦理委员会批准。
1.3.11 统计学方法 所有实验均重复3 次。采用以SPSS 13.0 和GraphPad Prism 9.0 软件进行数据分析。计量数据以均数±标准差(±s)描述。两组比较采用独立样本t检验;多组间比较采用单因素方差分析,Dunnett's 检验进行多重比较;多组间率的比较采用Fisher 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 二甲双胍对食管上皮细胞增殖的影响
光镜下(图1A)观察发现,相较于对照组,5 mmol/L的二甲双胍引起EC109 和TE-1 细胞变圆、折光性增加、细胞间距增大,甚至脱落,浓度超过10 mmol/L时上述变化更加显著,活性检测结果差异有统计学意义(均P<0.05),且表现为明显的剂量效应关系;然而,最高浓度的二甲双胍(20 mmol/L)处理后,相较对照组HET-1A 细胞的形态变化并不明显,CCK-8 结果未见统计学差异(P=0.380)。此外,在平板克隆实验中(图1B),随着二甲双胍浓度的升高,EC109 细胞所形成的克隆数明显减低和克隆直径明显缩小(均P<0.05),也呈现剂量效应关系。
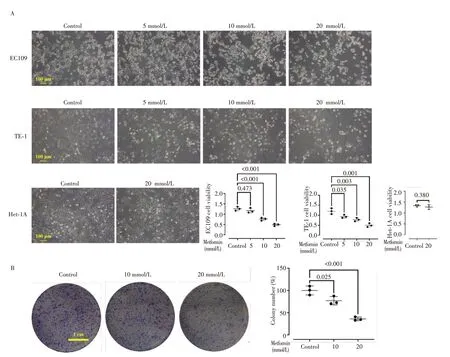
图1 二甲双胍对食管上皮细胞形态、活力及增殖能力的影响Fig.1 Effects of metformin on the morphology,vitality,and proliferation of esophageal epithelial cells
2.2 二甲双胍对EC109细胞迁移的影响
划痕结果(图2A)显示,低浓度的二甲双胍(2.5和5 mmol/L)处理后,EC109细胞水平移动的能力明显减弱(均P<0.05)。Transwell 实验结果显示(图2B),低浓度的二甲双胍(2.5和5 mmol/L)处理后,EC109垂直移动的能力明显减弱(均P<0.05)。
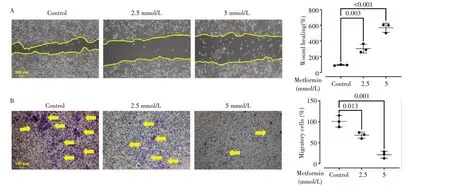
图2 二甲双胍对EC109细胞水平及纵向迁移能力的影响Fig.2 Effects of metformin on horizontal and vertical migration ability of EC109 cells
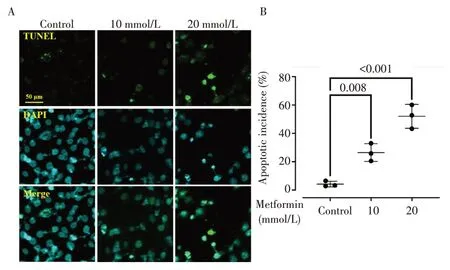
图3 二甲双胍对EC109细胞凋亡的影响Fig.3 Effect of metformin on Sapoptosis of EC109 cells
2.3 二甲双胍对EC109细胞凋亡的影响
TUNEL 试剂能有效标注凋亡过程中断裂DNA 的3'-OH 末端,并在荧光显微镜下呈现绿色;DAPI 则通过结合双链DNA 的双螺旋小沟富含AT 碱基的特殊序列,对细胞染色质进行亮蓝显色。免疫荧光结果显示,相较于对照组,二甲双胍处理可提高绿色荧光标记细胞核的数量,同时减少同一视野下蓝色荧光标记细胞核的数量,并呈剂量效应关系且差异有统计学意义(P<0.05),提示二甲双胍可提高食管癌细胞凋亡率。
2.4 二甲双胍对EC109 细胞线粒氧化应激状态的影响
Mito-SOX 染色显示,二甲双胍处理后EC109细胞线粒体内活性氧水平明显升高(均P<0.05),表现为红色荧光增强,同时细胞形态变圆、折光性增加,见图4。

图4 二甲双胍对EC109细胞线粒体氧化应激状态的影响Fig.4 Effect of metformin on mitochondrial oxidative stress status of EC109 cells
2.5 二甲双胍对EC109细胞线粒膜稳定性的影响
荧光显微镜(图5)观察显示,随着剂量的增加,二甲双胍处理降低EC109细胞内红色荧光的强度,同时增加绿色荧光的强度,相同视野范围内细胞数量明显降低、细胞排列也更加疏松。相较对照组,二甲双胍处理可降低红色和绿色荧光强度的比值,差异有统计学意义(均P<0.001)。
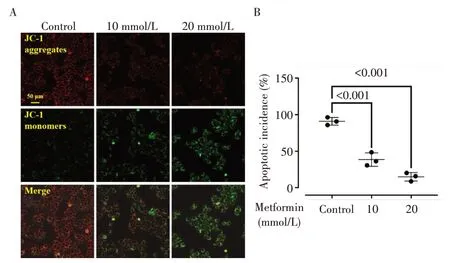
图5 二甲双胍对EC109细胞线粒体膜稳定性的影响Fig.5 Effect of metformin on mitochondrial membrane stability of EC109 cells
2.6 二甲双胍对Gas6/Axl 以及细胞凋亡通路关键蛋白的影响
免疫荧光(图6A)分析显示,二甲双胍能抑制EC109细胞中Gas6的含量,表现为红色荧光水平急剧降低(P<0.05)。利用免疫印记法进一步检测二甲双胍(10 和20 mmol/L)处理后EC109 和TE-1 细胞中的关键蛋白,结果(图6B)显示,与对照组相比,二甲双胍处理组Gas6 表达明显降低;EC109 细胞中Axl 及其磷酸化水平显著下调;二甲双胍导致EC109细胞中的细胞色素C增加、Caspase3活性增强,且Bax与Bcl2的比值升高(均P<0.05)。
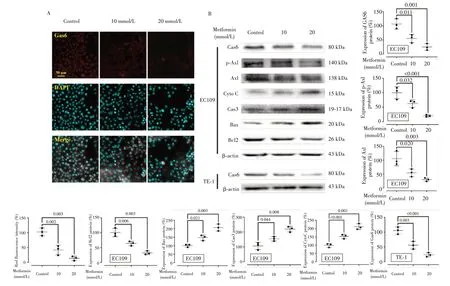
图6 二甲双胍对EC109和TE-1细胞Gas6/Axl和凋亡通路关键蛋白的影响Fig.6 Effects of metformin on Gas6/Axl and key proteins of apoptosis pathway in EC109 and TE-1 cells
2.7 联合应用二甲双胍和R428 对EC109 细胞增殖、迁移及裸鼠皮下成瘤能力的影响
CCK-8 实验(图7A)显示,与对照组相比R428 浓度在低于0.3 µmol/L 时,EC109 细胞活性未见明显降低(均P>0.05);免疫印记法分析结果(图7B)显示,R428 能有效抑制Axl 的磷酸化水平。相较单纯二甲双胍治疗组,联合二甲双胍(10 mmol/L)和R428(0.3 µmol/L)处理后,EC109 细胞活性进一步降低(P<0.001,图7C)。迁移实验结果(图7D)显示,R428(0.3 µmol/L)联合二甲双胍(2.5 mmol/L)后EC109 细胞的划痕间距离的能力显著增加(P<0.001)。
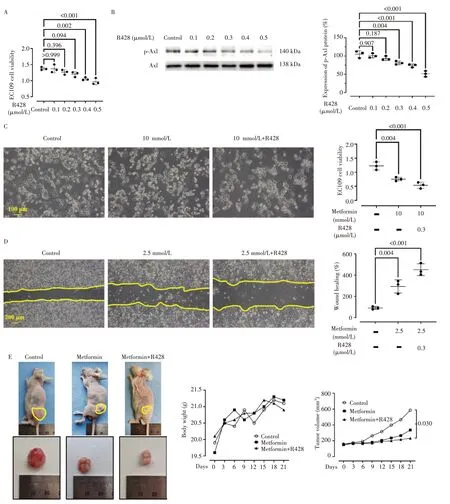
图7 联合应用二甲双胍和R428对EC109细胞增殖、迁移及裸鼠皮下成瘤能力的影响Fig.7 Effects of metformin and R428 on the proliferation,migration,and subcutaneous tumor formation of EC109 cells in nude mice
裸鼠荷瘤实验显示(图7E),实验期间所有动物一般情况良好,各组小鼠体重无明显差异(P>0.05);皮下注射EC109细胞后无自然死亡发生,且均成功建立荷瘤模型;与对照组相比,二甲双胍(250 mg/kg)可以明显减慢EC109 细胞瘤体增长速度,而联合应用R428(25 mg/kg)后二甲双胍抑制肿瘤生长的能力进一步显著增强(P=0.030)。
3 讨论
二甲双胍是一种从甘菊中提取的双胍类降糖药物,作为治疗2 型糖尿病的一线临床药物,主要通过抑制肝脏糖异生和改善胰岛素敏感性发挥降糖作用[9]。流行病学证据表明,二甲双胍除了降低血糖外,在预防和治疗消化系统恶性肿瘤(如口腔鳞状细胞[10]、胃癌[11]、直肠癌[12])方面也取得了良好的效果。最近的一项临床研究显示,与不使用二甲双胍的患者相比,使用患者发生食管鳞状细胞癌的风险明显降低(HR=0.68,95%CI:0.54~0.85)[13]。本研究也证实,随着二甲双胍浓度的增加,EC109 和TE-1 细胞活性降低,同时EC109 细胞的凋亡率上升,进而对其生长、迁移能力产生较强的抑制效果,说明二甲双胍的抗癌作用可能与激活凋亡密切相关。
线粒体是细胞氧化磷酸化的主要供能细胞器,其所产生的活性氧簇在不同类型的细胞中发挥多种作用。在生理状态下,活性氧簇通过线粒体内外膜扩散或特定载体进入胞质,调控细胞代谢;而其过量堆积则损害细胞功能,增加能量消耗,导致线粒体功能障碍,最终促进细胞死亡[14]。同时,线粒体也是肿瘤发生的关键效应器,常常扮演刺激感应的组成部分,从而使肿瘤能够适应体内免疫环境[15]。因此,增加细胞活性氧簇负荷或扰乱线粒体功能可起到选择性杀死癌细胞的作用[16]。本研究中的Mito-SOX 染色实验显示,二甲双胍可增加线粒体内活性氧簇的集聚,JC-1检测发现二甲双胍可以有效降低EC109 细胞的MMP水平。以上结果提示,二甲双胍可能通过影响线粒体功能,促进细胞氧化应激反应,从而介导EC109细胞凋亡。
Gas6是近年来发现的重要的细胞调控蛋白,可通过磷酸化其膜受体Axl 后发挥多种生理功能,包括细胞增殖、凋亡、分化、衰老和代谢等[17]。既往研究显示,Gas6不论在实体还是血液系统肿瘤的发生及转移中都扮演着重要角色[18]。HONG 等[19]发现Axl 在食管腺癌中过表达并介导顺铂耐药,其机制可能与阻断内源性p73β(TP73)活化有关。PACCEZ 等[20]证实Axl在晚期食管鳞状细胞癌或人肿瘤样本中始终过表达,用siRNA 阻断Axl表达能抑制食管肿瘤的生长、转移和侵入,提示以Axl 为靶点的治疗可能是治疗食管鳞状细胞癌的新途径。此外,在非小细胞肺癌中,通光散通过抑制Axl 活性介导线粒体功能失衡,进而激活内质网应激相关的免疫原性细胞死亡,从而发挥抗癌作用,提示Gas6 与线粒体稳态存在广泛联系[21]。而小剂量的二甲双胍可以增加Gas6 表达,促进脂肪组织分泌脂联素并抑制胰岛素抵抗,最终减轻脂肪细胞分化和老化趋势[6]。以上结果说明,Gas6/Axl 在肿瘤性疾病中具有一定促生存作用,而二甲双胍能够激活Gas6 以减轻应激状态下正常组织细胞的炎症反应。但是,二甲双胍对食管鳞癌在内的恶性疾病的作用以及Gas6/Axl在其中的调控功能仍不明确。
本研究显示,二甲双胍在抑制EC109 和TE-1 细胞活性过程中显著降低Gas6 表达,同时下调EC109细胞中Axl 的含量及磷酸化水平,并增加促凋亡蛋白Bax 与抗凋亡蛋白Bcl2 比值。R428 又称比美替尼(Bemcentinib),属于酪氨酸激酶抑制剂,目前研究显示R428对Axl的作用最强[22]。R428可剂量依赖性地抑制人MDA-MB-231 和小鼠4T1 乳腺癌细胞系的侵袭[23]。R428 对原发性慢性淋巴细胞白血病B 细胞IC50剂量为2 µm,而在相同的实验条件下,正常的B细胞、T细胞和NK 细胞均未出现显著的细胞死亡[24]。此外,在营养性肥胖小鼠模型中,使用R428调控Gas6信号通路后能损害脂肪细胞分化并减少脂肪组织发育[25]。R428作为Axl的有效抑制剂用于Axl信号通路的调控,且其机制可能是R428能够靶向结合Axl的胞内催化激酶结构域并阻止其活性,进而阻断下游信号转导。本研究中,联合应用R428抑制EC109细胞Axl磷酸化后,二甲双胍从离体和在体水平阻断EC109细胞增殖、迁移以及裸鼠皮下瘤体增殖的作用进一步增强。以上结果提示,Gas6/Axl信号通路在一定程度上参与二甲双胍对食管鳞癌细胞的抑制作用。
综上所述,二甲双胍能够有效抑制食管鳞癌细胞的增殖和迁移能力,其药理学活性可能与影响线粒体稳态并下调Gas6/Axl信号通路有关,最终促进细胞发生氧化应激性凋亡。然而,二甲双胍调控细胞器功能抗食管鳞癌的具体机尚未完全揭示,仍需深入地研究。

