LGR4对鼻咽癌细胞增殖、凋亡、侵袭、迁移及上皮间质转化的影响
周玉飞 李开国 杨晓慧 陈旭霞 陈伟玲 曲颂,2,3
作者单位:530021 南宁1广西医科大学附属肿瘤医院放疗科;2区域性高发肿瘤早期防治研究教育部重点实验室(广西医科大学);3广西鼻咽癌临床医学研究中心
鼻咽癌(nasopharyngeal carcinoma,NPC)是一种起源于鼻咽上皮的恶性肿瘤,最常见为鳞状细胞癌,其发病与EB(Epstein-Barr)病毒感染密切相关[1]。放射治疗是鼻咽癌的首选治疗手段[2],尤其是近年来已成为鼻咽癌放射治疗主流技术的调强放射治疗(intensity-modulated radiotherapy,IMRT)[3],有效提高了初诊和非转移性鼻咽癌患者的局部控制率和总生存率[4],其联合诱导化疗还能明显提高转移性鼻咽癌患者的总生存率[5]。虽然随着现代治疗方法和技术的不断提高,局部进展鼻咽癌患者生存受益,但是仍有部分患者死于局部复发或者远处转移[6]。因此,探索引起鼻咽癌发生发展的敏感标志物及其发生机制对鼻咽癌患者的早期诊断和预后评估具有重要意义。富含亮氨酸重复G蛋白偶联受体-4(leucine-rich repeats containing G protein-coupled receptor 4,LGR4)是G 蛋白偶联受体家族中的一员,研究表明,LGR4与肿瘤的侵袭转移[7]、干性[8]、能量代谢[9]以及放射敏感性[10]相关,可促进皮肤癌[11]、卵巢癌[12]和乳腺癌[13]等多种肿瘤进展。上皮间质转化(epithelial-mesenchymal transition,EMT)是以上皮表型的缺失,伴随间质性表型的获得为主要特征,它与肿瘤的形成、侵袭、转移和治疗抵抗有关[14]。有研究显示过表达miR-449b通过调控LGR4 的表达从而减少肺癌细胞的增殖、侵袭能力[15]。microRNA-34a 负调控LGR4,通过EMT 和MMP2,抑制眼葡萄膜恶性黑色素瘤的侵袭和迁徙[16]。但LGR4 在鼻咽癌中的作用及其分子机制目前尚不明确。EBV 感染与恶性肿瘤的发生发展密切相关[17]。有研究表明C666-1 细胞具有较高的侵袭、迁移能力[18],本课题组前期研究通过GEO 数据库测序数据GSE15903、GSE89804 和GSE103611 绘制韦恩图得出差异基因LGR4,提示LGR4可能参与了鼻咽癌发生发展。鼻咽癌发病与EBV 感染密切相关[1,17]。因此,本研究选取了携带EB 病毒的人鼻咽癌低分化鳞状细胞癌细胞株C666-1,探讨LGR4 在鼻咽癌中的表达及对鼻咽癌细胞系C666-1 生物学特性的影响。
1 材料与方法
1.1 主要材料
1.1.1 细胞、主要试剂及仪器 携带EB 病毒的人鼻咽癌低分化鳞状细胞癌细胞株C666-1 购自无锡欣润生物科技有限公司,人正常鼻咽上皮细胞株NP69 购自中山大学附属肿瘤医院实验中心。LGR4敲低慢病毒KD1 组和KD2 组及其阴性对照慢病毒均购自上海吉凯基因科技有限公司;RPMI-1640 培养基购自美国Gibco 公司;胎牛血清购自以色列Biological Industries公司;青链霉素混合液(双抗)、0.25%胰蛋白酶、4%多聚甲醛固定液购自北京索莱宝科技有限公司;RIPA裂解液和蛋白酶抑制剂PMSF、BCA 蛋白浓度测定试剂盒均购自上海碧云天生物技术有限公司;Trizol 试剂购自日本Takara 公司;RT-qPCR 引物、逆转录试剂盒和2×SGFast qPCR Master Mix 试剂盒均购自生工生物工程(上海)股份有限公司;聚偏二氟乙烯膜(polyvinylidenefluoride,PVDF)、结晶紫染料均购自北京兰杰柯科技有限公司;碘化丙啶(PI)/核糖核酸酶(RNase)染色缓冲液购自美国BD 公司(Becton,Dickinsonand Company);AnnexinV-APC/7-AAD 双染凋亡试剂盒购自武汉伊莱瑞特生物科技股份有限公司;兔LGR4多克隆抗体、山羊抗兔免疫荧光二抗及角质形成细胞SFM(1X)购自赛默飞世尔科技(中国)有限公司;CCK-8 试剂盒购自美国MedChemExpress 公司。兔alpha-tubulin单克隆抗体购自武汉三鹰生物技术有限公司;E-cadherin 购自美国CST 公司;Matrigel胶购自美国Corning 公司;划痕插件和Transwell 小室购自德国Ibidi 公司,奥德赛近红外双色荧光成像系统购自基因(中国香港)有限公司,荧光定量PCR仪购自德国Analytik Jena公司。
1.1.2 生物信息学数据 采用GEO 数据库(https://www.ncbi.nlm.nih.gov/geo/)中的GSE89804、GSE15903和GSE10361 数据集,用GEO2R 进行分析,通过韦恩图(http://bioinformatics.psb.ugent.be/webtools/Venn/)对差异基因取交集以寻找促癌基因mRNA,筛选条件为|log2(Fold change)| >1,P<0.05。 对GEO 数据GSE12452 和GSE103611 进行在线分析(https://www.aclbi.com/static/index.html#/),分析差异基因LGR4在鼻咽癌组织及正常鼻咽上皮组织、治疗后鼻咽癌转移或未转移组织中的表达情况。
1.2 细胞培养与慢病毒感染
C666-1 细胞培养于(含10%胎牛血清、1%青霉素/链霉素)的RPMI-1640培养基中,NP69细胞培养于成分确定的角质形成细胞SFM(1X),置于37 ℃、5% CO2的细胞培养箱中培养。收集对数生长期的C666-1细胞,使用(含10%胎牛血清、1%青霉素/链霉素)的RPMI-1640培养基重悬后,调整细胞密度为2.5×104/mL,并接种于24孔板隔夜培养。
选取对数生长期的C666-1 细胞,分为敲低组(KD1 组、KD2 组)和转染阴性对照组(NC 组),按照分组分别加入LGR4敲低慢病毒液和阴性对照慢病毒液(MOI值为60)。继续培养10 h后,弃去上清液,更换新鲜培养液,继续培养72 h后,在荧光显微镜下观察其荧光强度并用RT-qPCR 及Western blot 检测慢病毒感染效率;用嘌呤霉素筛出C666-1稳定转染LGR4的细胞。
1.3 RT-qPCR检测LGR4 mRNA的表达水平
用Trizol 提取细胞内的总RNA,用MightyScript 第一链cDNA合成Master Mix试剂盒将其反转录成cDNA,再用2×SG Fast qPCR Master Mix 试剂盒进行RT-qPCR反应。qPCR反应条件:95 ℃30 s,95 ℃5 s,60 ℃30 s,共40 个循环。以GADPH 为内参,采用2-ΔΔCt法计算LGR4 mRNA 的相对表达水平。实验重复3次。qPCR引物序列:LGR4 KD1-F 序列为5'-GCCATTTCCTACAGGTGAAAC-3',LGR4 KD1-R 序列为5'-GTTTCACCTGTAGGAAATGGC-3';LGR4 KD2-F序列为5'-GCGTTTAGATGCCAACCATAT-3',LGR4KD2-R序列为5'-ATATGGTTGGCATCTAAACGC-3';GADPH-F序列为5'-CAGGAGGCATTGCTGATGAT-3',GADPH-R序列为5'-GAAGGCTGGGGCTCATTT-3'。
1.4 CCK-8实验检测细胞增殖能力
取对数生长期的各组细胞,以2 000/孔的密度接种于96 孔板,在细胞贴壁后加入110µL 由CCK-8 液和RPMI-1640培养基按1∶10比例配制的混合液,置于培养箱中孵育1 h 后,每隔24 h 用酶标仪测量一次各孔的光密度(OD)值,测量6 d。根据各孔的OD 值绘制细胞生长曲线图。实验重复3次。
1.5 平板克隆实验检测C666-1细胞的克隆形成能力
各组细胞以1 000/孔的密度分别接种至6 孔板,每组设置3 个复孔,置于37 ℃、5% CO2恒温培养箱中,培养至显微镜下观察克隆细胞数大于50 个为止,每4 d更换完全培养基。终止培养后,用PBS清洗3次后加适量4%多聚甲醛固定液固定30 min,再用结晶紫染色液染色10 min,清洗,晾干,拍照,利用Image J 软件进行计数后,计算克隆形成率。克隆形成率=(克隆形成数/接种细胞数)×100%。实验重复3次。
1.6 Annexin V-APC/7-AAD 双染法流式细胞术实验检测细胞凋亡情况
将慢病毒感染后的C666-1 细胞用0.25%胰蛋白酶于37 ℃、5% CO2培养箱内消化3 min,以1 000 r/min离心5 min后弃上清液,用PBS洗涤2次,分别加入500µL 1×Binding buffer、5 µL Annexin V-APC和5 µL 7-AAD染液处理细胞,避光冰上孵育15 min,上流式细胞仪检测各组细胞的凋亡率。实验重复3次。
1.7 Western blot 检测LGR4 和上皮表型E-cadherin蛋白的表达水平
将各组细胞使用RIPA 裂解缓冲液裂解细胞,提取细胞中的总蛋白。使用BCA 蛋白浓度测定试剂盒测定蛋白质浓度,加入4×蛋白上样缓冲液后在100 ℃下煮沸10 min 使其变性。取60 µg 蛋白样品在8%SDS 聚丙烯酰胺凝胶上电泳,0.22 µm PVDF 膜进行转膜,5%脱脂牛奶封闭1 h后,TBST 洗膜3次,于4 ℃摇床中孵育一抗(1∶1 000)过夜。第2天用TBST洗膜3 次,加入二抗(1∶10 000)在室温中避光孵育1 h 后,TBST洗膜3次,用奥德赛近红外双色荧光成像系统扫膜,并用Image J分析蛋白条带灰度值。实验重复3次。
1.8 划痕实验检测细胞迁移能力
将划痕插件置于6 孔板底部,将浓度为3×105/mL的细胞悬液按70 µL/孔接种于划痕插件3 孔内,24 h后于显微镜下观察细胞汇合度,待细胞汇合度达90%后取出插件,用RPMI-1640 培养基继续培养36 h。用显微镜观察0 h、36 h 时细胞划痕的愈合情况。利用Image J软件计算划痕面积,并计算各组细胞的迁移速率。迁移速率=[(0 h划痕面积-36 h划痕面积)/0 h划痕面积]×100%。实验重复3次。
1.9 Transwell小室实验检测细胞侵袭和迁移能力
Transwell 小室侵袭实验:提前一夜预冷基质胶和枪头,第2 天准备24 孔板,在Transwell 小室上室中铺胶(Matrigel 胶∶RPMI-1640 培养基=1∶10),置于培养箱中凝固1 h 后,在显微镜下观察成膜情况。在铺胶后的嵌套孔径为8 µm 的Transwell 小室上室中加入200 µL 细胞密度为6×104/mL 的细胞悬液,下室加入600 µL 含(含20%胎牛血清、1%青霉素/链霉素)的RPMI-1640 培养基,于恒温培养箱培养24 h。取出上室,PBS 清洗2 次后,用棉签擦除上室细胞,4%多聚甲醛固定液固定30 min,0.1%的结晶紫染色液染色10 min,清洗,晾干后在20 倍镜下随机选取5 个视野拍照计数并进行统计分析。Transwell 小室迁移实验除小室的上室不铺胶外,其余实验步骤同Transwell小室侵袭实验。实验重复3次。
1.10 统计学方法
采用SPSS 23.0软件对数据进行统计学分析,采用GraphPad Prism 8 软件进行统计分析并绘制统计图。计量资料以均数±标准差()表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,若组间差异具有统计学意义,则进一步使用LSD-t检验进行两两比较。以双侧P<0.05代表差异具有统计学意义。
2 结果
2.1 LGR4在鼻咽癌细胞C666-1中表达上调
将GEO数据库中GSE15903、GSE89804和GSE103611数据集取交集,韦恩图结果(图1A)显示,差异基因为LGR4。通过临床生信分析,结果(图1B~C)显示,在GSE12452 数据中,相较于正常鼻咽上皮组织,LGR4在鼻咽癌组织中表达上调(P<0.05);在GSE103611 数据中,LGR4 在鼻咽癌治疗后远处转移组织相较于鼻咽癌治疗后无远处转移组织中表达升高,差异有统计学意义(P<0.05)。

图1 LGR4在组织中的表达情况Fig.1 Expression of LGR4 in tissue
通过RT-qPCR 和Western blot 验证LGR4 在鼻咽癌细胞中表达差异性,结果显示,与正常鼻咽上皮细胞NP69相比,LGR4在鼻咽癌细胞C666-1中的mRNA(图2A)与蛋白(图2B)表达水平显著上调,差异有统计学意义(均P<0.001)。
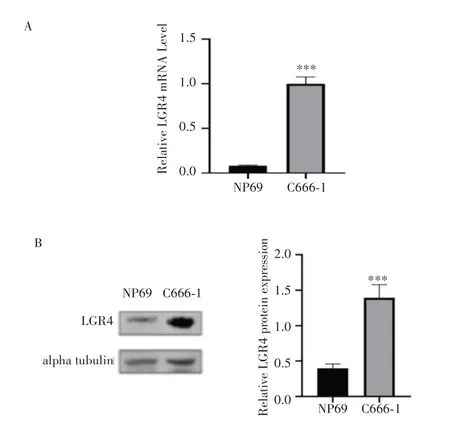
图2 LGR4 mRNA及蛋白的表达情况Fig.2 Expression of LGR4 in mRNA and protein
2.2 敲低LGR4抑制C666-1细胞增殖、克隆形成能力
Western blot 检测结果(图3)显示,与NC 组相比,KD1组和KD2组中LGR4的表达明显下降(均P<0.01),说明成功构建敲低LGR4 的C666-1 稳转株。CCK-8检测结果(图4A)显示,相较于NC组,KD1组和KD2组细胞增殖能力在第1~5天明显下降(均P<0.05);克隆形成实验结果(图4B)显示,与NC组相比,KD1组和KD2组细胞的克隆形成率明显降低(均P<0.001)。以上研究结果表明,敲低LGR4可抑制C666-1 细胞的增殖能力和克隆形成能力。
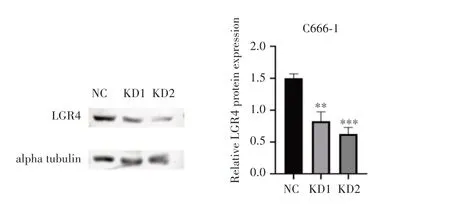
图3 慢病毒感染后C666-1细胞中LGR4蛋白的表达情况Fig.3 Expression of LGR4 protein in C666-1 cells after lentivirus infection
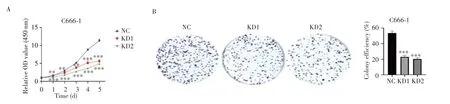
图4 敲低LGR4抑制C666-1细胞增殖和克隆形成能力Fig.4 Down-regulation of LGR4 inhibited the proliferation and colony formation ability of C666-1 cells
2.3 敲低LGR4促进鼻咽癌细胞C666-1细胞凋亡
流式细胞术实验结果(图5A)显示,与NC组相比,KD1 组和KD2 组细胞凋亡率显著增加(均P<0.001),表明敲低LGR4可促进细胞凋亡。

图5 流式细胞术检测C666-1细胞的凋亡情况Fig.5 The apoptosis of C666-1 cells detected by flow cytometry
2.4 敲低LGR4抑制C666-1细胞侵袭与迁移
划痕实验结果(图6A)显示,KD1 组和KD2 组的细胞迁移速率明显低于NC 组,差异有统计学意义(均P<0.001)。
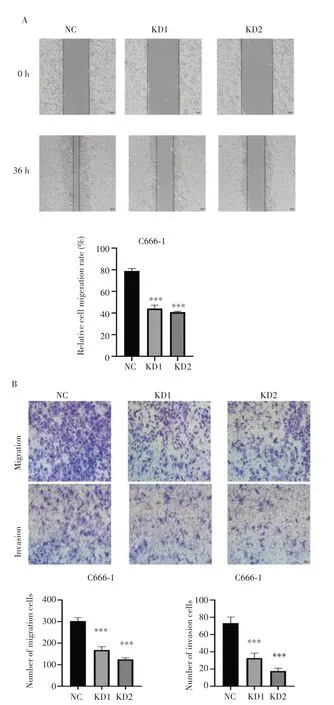
图6 敲低LGR4抑制鼻咽癌细胞的侵袭与迁移能力Fig.6 Down-regulation of LGR4 inhibited the invasion and migration of C666-1 cells
Transwell 小室实验结果(图6B)显示,KD1 组和KD2组的迁移细胞数均明显小于NC组(均P<0.001),穿膜细胞数也均明显小于NC 组(均P<0.001)。
2.5 敲低LGR4促进EMT相关蛋白E-cadherin的表达
为进一步验证LGR4 与C666-1 细胞转移的相关性,采用Western blot 检测转移相关标志物上皮表型E-cadherin 的表达,结果(图7)显示,与NC 组相比,KD1 组和KD2 组E-cadherin 蛋白表达水平显著增加(均P<0.001)。
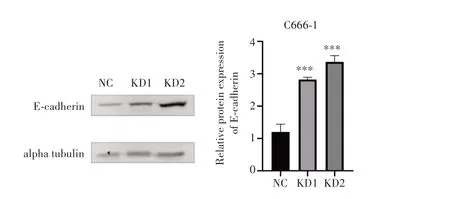
图7 LGR4与EMT相关蛋白的表达相关性Fig.7 The correlation between the expression of LGR4 and EMT-associated proteins
3 讨论
鼻咽癌主要好发于中国南部、南亚和北非[19],近年鼻咽癌患者预后得到提高[20],然而远处转移和肿瘤相关性死亡仍然是鼻咽癌患者治疗失败的原因[21]。因此,迫切需要找到发生转移的新的分子靶标为提高鼻咽癌患者的诊断和治疗提供新的思路。LGR4是GPCRs大家族中的LGR亚组中的一员,由17 个亮氨酸富集重复序列构成,含有7 个跨膜蛋白,被细胞外R-spondins(RSPOs)、Norrin、circLGR4、RANKL四个配体识别并参与各种细胞进程,LGR4 在人体各组织中广泛表达,其异常表达可促进疾病的发生发展[22]。TAN 等[23]发现RSPOs/LGR4-抑制单一的LGR4 细胞外区域(LGR4-ECD)或者RSPOs 中和抗体减弱M2-TAMs极化并促进CD8+T细胞的抗肿瘤活动。越来越多研究发现LGR4与肿瘤侵袭、迁移密切相关。WU 等[24]发现过表达LGR4 与结肠癌高侵袭、肺转移有关。LYU 等[25]发现hsa_circ_0003945 通过激活miR-34c-5p/LGR4/β-catenin 轴促进肝癌进展。然而LGR4 在鼻咽癌的发生发展中甚少研究。本研究发现,与正常鼻咽上皮组织比较,LGR4在鼻咽癌组织中表达明显升高。LGR4相较于治疗后未转移鼻咽癌组织,其在治疗后转移鼻咽癌组织中增高。与正常鼻咽上皮NP69 细胞比较,LGR4 在鼻咽癌细胞C666-1 中的表达显著升高;而敲低LGR4 后,鼻咽癌C666-1 细胞的增殖、侵袭及迁移能力也显著下降,凋亡增加,表明LGR4 可能与鼻咽癌的发生发展密切相关,可能是鼻咽癌转移的潜在靶点。
细胞中EMT的异常诱导与多种获得性能力有关,如抗失巢凋亡、癌基因诱导的衰老、细胞死亡、化疗和免疫疗法改变DNA 修复、增强干细胞特性、迁移、侵袭和转移[26]。E-cadherin 是上皮细胞表达的最具特征性的蛋白,作为一种侵袭和肿瘤抑制因子,E-cadherin减少与肿瘤患者预后差密切相关[27],尤其是头颈部肿瘤[28]。有研究发现,microRNA-137 通过EGFR/ERK 信号通路负调控LGR4 抑制前列腺癌细胞迁移和EMT[29];R-spondin 2-LGR4 能通过Wnt/β-catenin 信号通路促进舌鳞状细胞癌侵袭迁移、EMT 和干性[30]。本研究中的C666-1细胞在敲低LGR4后E-cadherin 表达水平显著升高,提示敲低LGR4 可以抑制C666-1 细胞的EMT 进程,敲低LGR4 可能通过调控EMT 抑制C666-1细胞的侵袭迁移。
综上所述,LGR4在鼻咽癌细胞C666-1中高表达,敲低LGR4可以抑制鼻咽癌细胞C666-1的增殖,促进凋亡,敲低LGR4 可能通过调控EMT 抑制鼻咽癌细胞C666-1的体外侵袭、迁移能力。本研究表明LGR4可能是鼻咽癌转移患者临床治疗的一个潜在靶点,为鼻咽癌治疗提供了新的方向。但本研究未收集病理组织和进行体内动物实验,LGR4上游调控分子及影响EMT进程的具体分子机制也未阐明,需进一步研究。

