阿帕替尼治疗腹腔低度恶性肌纤维母细胞肉瘤1 例及文献回顾
付浩然,赵雪峰,李勇,赵群,范立侨,张志栋,王冬,郝英杰,夏宇翔
河北医科大学第四医院外三科,石家庄 0500110
低度恶性肌纤维母细胞肉瘤(low-grade myofibroblastic sarcoma,LGMS)是一种罕见的、来源于间叶组织的低度恶性肿瘤[1],多发生于成年男性,单发,好发于头颈部,腹腔少见[2]。LGMS 通常表现为无痛的、逐渐增大的肿块,局部切除后极易复发。LGMS 依据病理检查确诊,手术疗效欠佳,药物治疗逐渐被关注,阿帕替尼作为抗血管生成药物,是一种新型酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI),可抑制血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)信号通路。本文回顾性分析1 例经阿帕替尼治疗有效的腹腔转移性LGMS,表明阿帕替尼可能是一种创新和有效的治疗手段,为临床LGMS 的治疗奠定了基础,现报道如下。
1 病历资料
患者女,60 岁,因“间断左侧腹部隐痛不适10天”于2016 年10 月29 日就诊于河北医科大学第四医院,查体:左上腹可触及一大小约12 cm×10 cm的肿块,质硬,轻压痛,边界不清,活动度差。既往行输卵管结扎术、卵巢囊肿切除术,无家族肿瘤病史。血生化检验结果:肿瘤标志物铁蛋白201.4 ng/ml 偏高(正常参考值13~150 ng/ml),其余未见异常。CT检查显示:左上腹肿块(长径11.81 cm),与胰尾及胃体关系密切。于2016 年11 月1 日行胰尾和脾脏切除术,术后免疫组化结果显示:脾组织(-)、波形蛋白(vimentin)(+)、Ki-67(阳性细胞数5%)、CD34(-)、CD117(-)、跨膜蛋白16A(transmembrane protein 16A,TMEM16A,也称DOG1)基因(-)、结蛋白(desmin)(-)、S100(-)、钙调节蛋白(calponin)(+)、细胞角蛋白(cytokeratin,CK)(-),确诊为LGMS。术后26 个月CT 检查显示:脾区多发结节及肿块,考虑LGMS 脾区转移,于2019 年1 月3 日行腹膜后肿块切除术,术后复查提示左上腹肿块增大,依据基因检测结果,于2019 年6 月口服培唑帕尼,疗效评估为疾病稳定。但因严重手足综合征、消化道出血等不良反应,培唑帕尼治疗5 个月后于2019 年11 月改为口服舒尼替尼治疗,再次疗效评估为疾病进展,遂停用舒尼替尼。复查CT 显示:左侧腹膜后肿块,考虑侵及左肾,腹腔、腹膜后及左侧腹壁多发结节,考虑转移。遂于第2 次术后15 个月,即2020 年4 月13 日行左上腹腹膜后巨大肿物+左肾+部分输尿管切除术、部分横结肠及降结肠切除术、结肠-结肠端侧吻合术、部分膈肌切除术、左侧腹壁结节切除术,上述3 次手术术后病理检查均符合LGMS。术后8 个月复查显示:考虑多发肝、双肺、胸膜、腹盆腔转移,给予阿帕替尼口服,时间2021 年1 月至2022 年1 月,期间未见明显疾病进展(用药前后对比见图1、图2),后行2 个周期的多柔比星脂质体+阿帕替尼治疗,多柔比星脂质体20 mg 静脉滴注,阿帕替尼0.25 g 口服,于2022 年5 月2 日因消化道出血死亡。
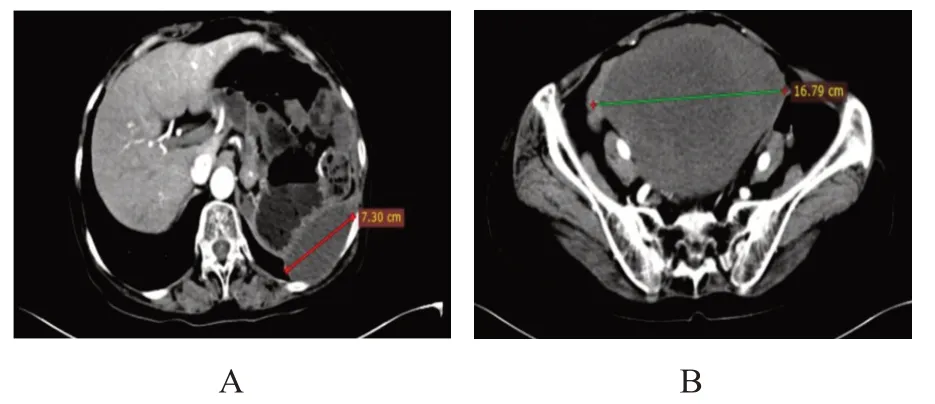
图1 2021年1月阿帕替尼治疗前CT图像
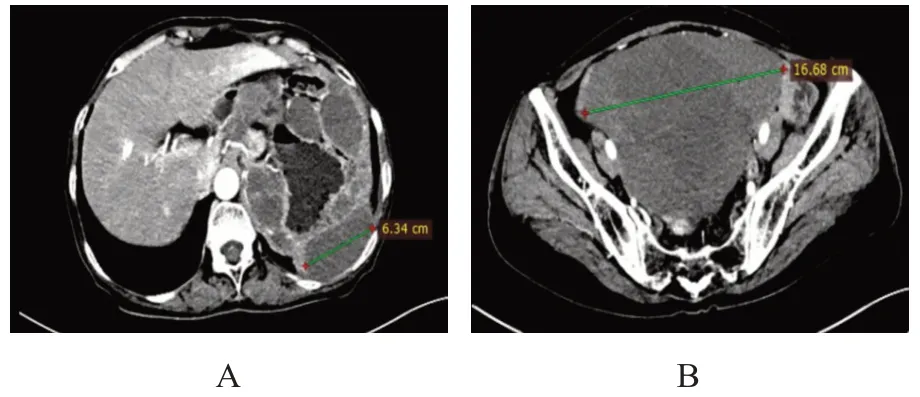
图2 2022年1月阿帕替尼治疗后CT图像
2 讨论
LGMS 是一种罕见的来源于间叶组织的低度恶性肿瘤,是2002 年世界卫生组织(WHO)软组织肿瘤分类中明确列出的一种独立的肿瘤类型[1]。LGMS 好发于成年男性,好发部位为头颈部,其次为躯干、四肢,腹腔最为少见,通常表现为无痛的、逐渐增大的肿块,还可能出现发热、寒战和白细胞增多表现[2]。腹盆腔LGMS 具有更高的局部复发倾向,手术切除后极易复发[3],因此,药物治疗逐渐引起关注。本文报道1 例经阿帕替尼治疗有效的腹腔转移性LGMS,旨在为LGMS 的治疗探索新的有效方法。
LGMS 的诊断根据光学显微镜和病理组织免疫组化法的超微结构确定[4]。LGMS 由梭形肿瘤细胞组成,细胞核呈波浪形、纺锤形等,淡嗜酸性,核仁位于细胞核中心。纤维瘤病、平滑肌肉瘤、纤维肉瘤和炎性肌成纤维细胞肿瘤是常见的鉴别诊断类型。Coffin 等[5]报道LGMS 免疫组化常见表现为vimentin(+++),平滑肌肌动蛋白(smooth muscle actin,SMA)(+),肌特异性肌动蛋白(muscle specific albumin,MSA)(+),desmin 呈灶性阳性,CK、CD68、CD30 呈偶见灶性阳性。LGMS 对S-100、CK、CD34 和上皮膜抗原(epithelial membrane antigen,EMA)没有免疫反应。本文患者3 次术后病理及免疫组化结果均诊断为LGMS。
手术切除被认为是治疗LGMS 的首选方法,预后一般较好,伴有局部浸润、远处转移或复发的患者,术后需给予辅助治疗。Peng 等[6]研究结果显示,胰腺LGMS 患者术后给予辅助化疗5 年未复发。有研究认为,LGMS 术后容易复发和转移,手术完整切除肿瘤,切缘无肿瘤组织残留对患者的预后改善十分关键[7]。Chan 等[8]研究显示,LGMS患者的5 年生存率为71.6%,疾病特异性生存率为76.3%。本文患者3 次手术切缘皆为阴性,仍出现了复发及转移,提示手术对LGMS 的疗效可能欠佳,对其复发风险尚无定论。本文患者第2 次手术后还口服培唑帕尼辅助治疗,但因严重手足综合征、消化道出血等不良反应,改为口服舒尼替尼后疾病进展,手术间隔15 个月,较上次手术间隔缩短了11 个月;第3 次手术后口服阿帕替尼0.25 g 辅助治疗,每天1 次,治疗后手足综合征轻微,但存在严重的消化道出血,患者的无进展生存期(progression-free survival,PFS)为12 个月,总生存期(overall survival,OS)为15 个月,最终死于消化道出血。
本文总结近年来阿帕替尼治疗LGMS 的研究,阿帕替尼作为TKI,可高选择性地抑制VEGFR2 的表达,阻断其下游信号转导通路,可强效抑制肿瘤新生血管生成[9],在多种实体瘤的治疗中显示出了巨大的潜力[10]。阿帕替尼在Ⅲ期临床试验中首次被证实可延长晚期胃癌患者的OS 和PFS,可作为晚期胃癌患者的治疗药物[11]。研究表明,阿帕替尼治疗肿瘤有效的原因可能与其抗肿瘤机制及磷脂酰肌醇-3-羟激酶(phosphoinositide 3-hydroxy kinase,PI3K)/蛋白激酶B(protein kinase B,PKB,又称AKT)通路有关,其可能是治疗LGMS 的有效药物[12]。Zhu 等[13]报道31 例软组织肉瘤患者接受阿帕替尼治疗的疗效,结果显示,临床获益率为75.0%,中位PFS 为4.25 个月,中位OS 为9.43 个月。王彩玲等[14]报道14 例骨肉瘤肺转移患者接受阿帕替尼治疗的疗效,结果显示,总有效率为50.0%,疾病控制率为64.3%,中位OS 为4.3 个月。Liao 等[15]报道64 例晚期骨肉瘤与软组织肉瘤患者应用阿帕替尼治疗的疗效,该研究对其中59 例患者进行了疗效评估,其中位PFS 为7.93 个月,总有效率为12.25%,疾病控制率为57.63%。
本文患者接受阿帕替尼治疗12 个月,用药期间监测血常规、肝功能基本正常,大便潜血(-),D-二聚体水平最高为0.533 mg/L(正常参考值﹤0.243 mg/L),否认既往出血性疾病史,不除外阿帕替尼引起消化道出血的可能。张旭等[16]报道了1例阿帕替尼(0.25 g 口服,每天1 次)治疗1 年余发生下消化道出血的病例。一项纳入27 项前瞻性随机对照试验的Meta 分析结果表明,VEGFR 抑制剂可明显增加患者出血事件的发生风险(RR=1.67,95%CI:1.19~2.33,P=0.003)[17],这可能是因为阿帕替尼可导致血小板功能障碍及血管内皮细胞组织因子合成减少,从而损伤血管完整性,引起出血[18]。何苗苗等[19]对151 例阿帕替尼所致不良反应患者的病历资料进行分析,结果显示,累及器官-系统最多的是全身性损害(46.35%),主要表现为高血压;其次为皮肤黏膜系统(19.20%),主要表现为手足综合征;然后是消化系统(17.23%),主要表现为消化道出血,其中消化道出血与阿帕替尼的口服剂量、服用时间等有关,并可通过减少阿帕替尼剂量来控制。本研究结果显示,手术联合阿帕替尼可能会延长LGMS 患者的PFS,改善预后,越早使用阿帕替尼并给予有效剂量,患者越可能早期获益,能在一定程度上延缓患者的疾病进展,但需关注阿帕替尼引起的消化道出血等严重不良反应,并及时调节剂量或停药进行积极治疗。
目前,腹腔LGMS 的治疗尚无标准方案,除手术完整切除外,阿帕替尼作为新型靶向药物治疗LGMS 疗效的预测因子及抗肿瘤机制均尚未明确,未来可以开展更多的前瞻性研究来探讨LGMS 的综合疗法,通过研究不同肉瘤的标志物及病理来源,实现阿帕替尼的精准治疗,但其临床疗效和安全性有待进一步的临床试验验证。
综上所述,阿帕替尼治疗转移性LGMS 疗效显著,有望成为治疗LGMS 有潜力的药物,也为肉瘤的个体化治疗提供了新的思路,但同时,阿帕替尼的不良反应也不可忽视,仍需要临床医师综合评 估来保障患者的用药安全。
——评《卵巢恶性肿瘤诊疗手册》

