心肌肌球蛋白抑制剂治疗肥厚型心肌病的研究进展Δ
袁叶,杨珍珍,于博,孙倩,张志清 (河北医科大学第二医院药学部,石家庄 050000)
肥厚型心肌病(hypertrophic cardiomyopathy,HCM)是一种以心肌肥厚为特征的常染色体显性遗传病[1],根据左心室流出道(left ventricular outflow tract,LVOT)是否梗阻,分为梗阻性和非梗阻性。HCM的发病率为1/500,粗略估计我国成人HCM患者超过150万,其中约2/3的HCM患者为肥厚型梗阻性心肌病(hypertrophic obstructive cardiomyopathy,HOCM)[2]。HOCM会因心肌过度收缩、心室壁肥厚而引起LVOT梗阻,可进一步加重病情,除引起患者胸痛、晕厥等临床症状外,严重者可猝死[2]。因此,治疗HCM,尤其是治疗HOCM的相关研究一直备受关注。
自20世纪50年代首次发现HCM以来,人们对HCM病理生理学的研究不断深入,这也推动了其治疗手段的不断进步,治疗药物由之前针对症状控制的药物(包括β受体拮抗剂、非二氢吡啶钙通道阻滞剂和丙吡胺),发展为现在可改善心脏功能和预后的分子靶向药物——心肌肌球蛋白抑制剂[3]。目前最新研制的心肌肌球蛋白抑制剂Mavacamten和Aficamten于2022年2月被国家药品监督管理局药品审评中心批准纳入拟突破性治疗药物名单。本文综述了HCM的发病机制,以及Mavacamten和Aficamten的基本信息、药动学及临床研究等的研究进展,旨在为临床治疗HCM提供参考。
1 HCM的发病机制
研究表明,HCM主要是由编码肌节蛋白的基因突变引起的[4]。编码肌节蛋白的基因突变可导致肌球蛋白交叉桥形成增加,从而导致心肌高度收缩[5—6]。在HCM的致病突变基因中,MyBPC-3和MYH7的基因突变最为常见,约占所有突变类型的一半[7]。心肌肌球蛋白结合蛋白C(myosin-binding protein C,MyBPC-3)位于横纹肌横桥区,是粗肌丝的重要组成部分,具有参与肌原纤维收缩刹车的作用,其基因相关位点的突变影响了腺苷三磷酸(adenosine triphosphate,ATP)酶的活性和钙离子的敏感性等,可能导致肌动蛋白和肌球蛋白之间收缩力增强[8];而β-心肌肌球蛋白重链7(β-myosin heavy chain 7,MYH7)主要在心室中表达,具有沿着粗肌丝和细肌丝运动的功能,是肌球蛋白最重要的亚单位之一。MYH7也是第一个被发现的HCM致病基因[9—10],该基因突变可影响肌球蛋白ATP酶活性,还可增加肌球蛋白的总数[11]。可见,上述2种基因的突变都可增加肌球蛋白和肌动蛋白间的相互作用,降低肌球蛋白处于超松弛状态的概率,从而导致心肌高度收缩。
2 Mavacamten的研究进展
2.1 基本信息
Mavacamten,也被称为MYK-461,由美国MyoKardia公司研发,中文化学名称为3-异丙基-6-[((1S)-1-苯乙基)氨基]-2,4(1H,3H)-嘧啶二酮;分子式为C15H19N3O2;分子量为273.33;物质数字识别号码(CAS登记号)为1642288-47-8。Mavacamten是由异丙胺为起始原料,经加成、环合、卤代和亲核取代反应而得到的化合物[12],结构式见图1。2022年4月28日,Mavacamten获美国FDA批准,成为首个获批的心肌肌球蛋白抑制剂。其可抑制MYH7突变,降低心肌肌球蛋白重链的ATP酶活性,可逆性抑制肌球蛋白和肌动蛋白的偶联反应,减少横桥过量形成,并降低心肌肌球蛋白的钙离子敏感性,从而使心肌收缩力恢复正常[13—15]。同时,Mavacamten还能促使整个肌球蛋白群处于更节能的超松弛状态,改善舒张功能和能量代谢[16]。Mavacamten可用于治疗成人纽约心脏协会(New York Heart Association,NYHA)心功能分级为Ⅱ~Ⅲ级的HOCM患者,可改善其心功能和临床症状(证据推荐级别ⅠB)[17]。Mavacamten的商品名为Camzyos,剂型为胶囊,规格有2.5、5、10、15 mg 4种,推荐起始剂量为5 mg,每日口服1次[18]。
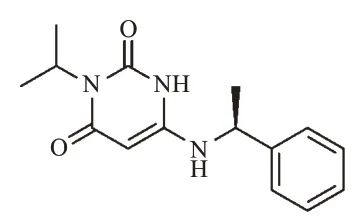
图1 Mavacamten的结构式
2.2 药动学
Mavacamten相关体内外的药动学研究表明,其半衰期较长,且具有酶诱导作用。Grillo等[19]研究结果显示,Mavacamten不抑制细胞色素P450(cytochrome P450,CYP)酶活性,但在高于预期治疗浓度的条件下,可体外提高CYP2B6和CYP3A4酶活性;Mavacamten体外代谢产物的主要代谢途径包括芳香族羟基化(M1)、脂肪族羟基化(M2)、N-去烷基化(M6)和M1代谢产物的葡萄糖醛酸化(M4);Mavacamten具有清除率低、分布量大、终末消除半衰期长和跨物种口服生物利用度高等特点,根据实验结果外推,预测人血浆清除率约为0.51 mL/(min·kg)、分布容积约为9.5 L/kg、半衰期约为9 d。
2.3 临床研究
小鼠模型的临床前研究表明,Mavacamten能够恢复或预防左心室肥厚、心肌细胞紊乱和心肌纤维化[20]。基于上述系列动物实验,有关Mavacamten的临床研究结果相继被报道。2019年4月,一项Ⅱ期临床试验PIONEER-HCM的研究结果首先发表[21]。该研究在HOCM患者中进行,目的是表征Mavacamten对运动后HOCM患者LVOT压力梯度的影响。该研究共纳入21例患者并将其分为2组,A组11例给予Mavacamten 10~20 mg/d,B组10例给予2~5 mg/d。治疗12周后,A组患者运动后LVOT压力梯度从103 mmHg(1 mmHg=0.133 kPa)降低到19 mmHg(平均降低89.5 mmHg),峰值耗氧量(peak oxygen consumption,pVO2)增加3.5 mL/(kg·min);B组患者运动后LVOT压力梯度从86 mmHg降至64 mmHg(平均降低25.0 mmHg),pVO2增加1.7 mL/(kg·min)。结果表明,Mavacamten对运动后LVOT压力梯度的改善能力与药物剂量呈正相关,在血药浓度大于350 ng/mL的患者中改善更明显;但较高的血药浓度(如695~1 500 ng/mL)会导致34%~49%的患者发生左室射血分数(left ventricular ejection fraction,LVEF)降低和房颤等不良事件,不过,大多不良事件症状较轻微,且停药后可恢复正常。
同期开展的MAVERICK-HCM也是一项Ⅱ期临床试验[22],不同的是,该项试验在有症状的非梗阻性肥厚型心肌病(non-obstructive hypertrophic cardiomyopathy,nHCM)患者中进行,旨在确定Mavacamten在该类患者中的有效性。该研究最终纳入了59例患者并将其分为3组,其中,组1(n=19)、组2(n=21)通过血药浓度来调整给药剂量,目标血药浓度分别为200、500 ng/mL,安慰剂组为19例。在治疗4周时,组1患者的N末端B型利钠肽原(N-terminal pro-B-type natriuretic peptide,NTproBNP)水平降低了53%,组2患者降低了58%(较基线平均减少435 pg/mL);治疗16周时,经Mavacamten治疗患者的心肌肌钙蛋白I(cardiac troponin I,cTnI)水平降低了34%(较基线平均减少0.008 ng/mL);上述2项指标均于停药后在第24周恢复到基线水平。该项研究为nHCM患者群体的剂量研究奠定了基础,结果表明Mavacamten可降低nHCM患者的心脏标志物水平,从而有利于改善心室壁张力,但其对患者的NYHA心功能分级和最大摄氧量等指标无明显改善。
EXPLORER-HCM为一项大规模的Ⅲ期临床随机对照研究[23],该研究在13个国家68个心血管中心开展,共纳入251例HOCM患者,目的是研究治疗30周时患者pVO2和NYHA心功能分级的改善情况。该研究将所纳入的患者随机分为2组,Mavacamten组123例给予Mavacamten 5 mg,每日1次,安慰剂组128例。治疗持续30周,最终Mavacamten组达到主要终点的人数是安慰剂组的2倍多(37% vs.17%),次要终点与安慰剂组相比也均有显著改善。该研究证实了Mavacamten治疗有症状的HOCM患者具有良好的疗效与安全性。
MAVA-LTE研究是EXPLORER-HCM研究的延伸,是其5年的延长试验,目前正在进行中,旨在评估Mavacamten长期治疗的疗效和安全性[24]。该研究共纳入231例患者,其中95%的患者参与过EXPLORERHCM项目。Mavacamten组患者初始剂量为5 mg,每日给药1次,在第4、8、12周时根据超声心动图测量的LVEF和LVOT压力梯度调整给药剂量。该研究的中期分析截止时间为2021年8月31日,中位研究时间为62.3周。中期分析结果表明:Mavacamten组在第48周静息时的LVOT压力梯度较基线降低了35.6 mmHg,67.5%的患者NYHA心功能分级改善≥1级;NT-proBNP也在第4周时出现下降并持续至第48周。上述研究结果与母研究EXPLORER-HCM的结果一致。
此外,2022年4月,VALOR-HCM研究的阶段性结果也被公布[25]。该研究共招募了112例接受了最大耐受剂量的基础药物治疗后仍符合室间隔减融术(septal reduction therapy,SRT)指征的患者,用以研究Mavacamten在严重HOCM成人患者中的作用,主要终点为第16周时患者决定进行SRT治疗或仍符合SRT指征的患者比例的复合终点。Mavacamten的初始剂量为5 mg,之后根据超声心动图测量的LVEF和LVOT压力梯度进行剂量调整,最终剂量范围为2.5~15 mg。结果表明,治疗后,Mavacamten组患者的手术治疗需求明显减少,仅17.9%的患者符合SRT指征,且63%的患者NYHA心功能分级改善了1级、27%的患者改善了2级;而安慰剂组则有76.8%的患者还符合SRT指征。该研究进一步扩大了Mavacamten的治疗范围,但研究仅观察了16周,其长期疗效尚未明确。
3 Aficamten的研究进展
Mavacamten由于半衰期较长,需要大约6周的时间才能达到稳态浓度,若采用个体化剂量滴定方案,每例患者都需大量时间才能滴定到目标剂量。因此,为最大限度地提高患者的安全性、有效性和依从性,找到一个可以每天服用1次,有合适半衰期,可在2周内达稳态,同时不涉及与酶相关的药物相互作用的化合物,成为下一代心肌肌球蛋白抑制剂研发的主要目标[26]。研发者利用牛的心脏模型研发出几种化合物,并对其不断优化,最终得到了第2种心肌肌球蛋白抑制剂——Aficamten,目前也在进行Ⅲ期临床试验。
3.1 基本信息
Aficamten,又名CK-274/CK-3773274,是Cytokinetics公司正在研发的第2种心肌肌球蛋白抑制剂,其结构式见图2。其作用机制与Mavacamten一样,可通过与不同位点结合来抑制肌球蛋白横桥产生,从而缓解HOCM的过度收缩并改善舒张功能[27]。与Mavacamten不同的是,Aficamten的半衰期较短,2周内就能达到稳态[27]。2021年9月,Martin博士在美国心力衰竭学会科学年会上公布了Aficamten的Ⅱ期临床试验REDWOOD-HCM的研究结果。基于该研究结果,Aficamten于2021年12月9日获得美国FDA突破性疗法认定,用于治疗HOCM。
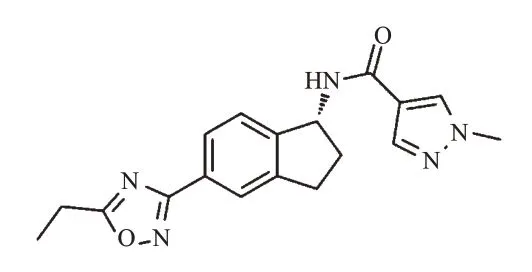
图2 Aficamten的结构式
3.2 药动学
Aficamten药动学研究结果显示,其平均半衰期为75~85 h,10~12 d可达稳态,支持每日给药1次的用药方案;食物和CYP2D6表型对其药动学无影响[27]。同时,Aficamten对CYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6、CYP3A4酶均无抑制作用。因此,相比于Mavacamten,Aficamten的半衰期更短,更利于目标剂量滴定,药物相互作用更少,服用更安全。
3.3 临床研究
2018年11月至2020年1月进行的AficamtenⅠ期临床试验共纳入103例健康受试者,目的是确定Aficamten的活性剂量范围,以降低LVEF到基线的5%~15%时的剂量视为不耐受量。结果表明,Aficamten一次性给予50 mg的给药方案或每次10 mg,每日1次,连续给药14或17 d的给药方案均有药理活性,并以浓度依赖的方式降低LVEF。安全性方面,Aficamten最常见的不良反应为头痛,没有严重的不良反应事件发生[28]。该试验确定了Aficamten治疗HCM患者的药理活性起始剂量并为其Ⅱ期临床试验的设计提供了依据。
Ⅱ期临床试验REDWOOD-HCM的主要目的是研究不同剂量Aficamten在有症状的HOCM患者中的安全性和耐受性。该研究于2020年1月至2021年5月在北美和欧洲30个学术中心进行,共纳入41例患者,并将其按2∶1分为2个剂量组和安慰剂组,使用超声心动图测量的LVEF值指导剂量滴定。组1患者的Aficamten初始剂量为5 mg,并在第2周和第4周分别滴定至10 mg和15 mg;组2患者Aficamten的初始剂量为10 mg,并在第2周和第4周时分别滴定至20 mg和30 mg;2组平均最终剂量分别为10 mg和14 mg。调整剂量后再继续治疗6周,给药周期共为10周。结果显示,治疗10周后,组1患者的静息LVOT压力梯度从(54±25) mmHg下降至(13±4) mmHg(与安慰剂组比较,P=0.000 3),组2患者从(58±36) mmHg下降至(15±22) mmHg(与安慰剂组比较,P=0.000 4);这些梯度在经过2周的洗脱期后可恢复到基线水平。同时,LVEF的下降呈剂量依赖性,组1患者的LVEF从(73±6)%下降至(67±9)%(P<0.05),组2患者则从(75±6)%下降至(64±8)%(P<0.05)。组1和组2中,NYHA心功能分级改善≥1级的患者比例分别为43%和64%,而安慰剂组为31%[29]。该研究表明,Aficamten在治疗后2周内可显著降低LVOT压力梯度,但在NYHA心功能分级的改善上并不显著,这可能与样本量小、随访时间较短有关。
REDWOOD-HCM-OLE是在REDWOOD-HCM研究基础上开展的扩展研究,进行REDWOOD-HCM研究的患者均纳入该试验,通过超声心动图将Aficamten的剂量调整为5~20 mg,随访5年。2022年欧洲心脏病学会心力衰竭协会公布了其中期研究结果:Aficamten治疗开始的2周内,患者的LVOT压力梯度显著下降,并可持续到24周;第4周时平均LVOT压力梯度从基线时的46.7 mmHg降至30 mmHg以下,在第24周时进一步降至20 mmHg以下;在第24周时有61%的患者NYHA心功能分级改善了1级,17%的患者NYHA心功能分级改善了2级,NT-proBNP在基线平均水平(642.6 pg/mL)上下降了70%,cTnI在基线水平(15.2 ng/L)上持续下降约30%[30]。其后续的实验结果仍待继续关注。
目前,正在进行的Ⅲ期临床试验SEQUOIA-HCM是一项针对有症状的HOCM患者的国际多中心、随机、双盲、安慰剂对照试验[31],是迄今为止规模最大的HOCM试验,拟纳入270例患者,治疗24周,随访28周。该研究同样采用超声心动图指导剂量滴定,以剂量递增的方式给予患者5、19、15、20 mg的Aficamten或安慰剂,目的是分析药物对有症状的HOCM患者的心肺运动能力和健康状况的改善情况,期待其结果早日公布。
4 总结和展望
近年来,随着研究者对HCM病理生理学的不断探索,心肌肌球蛋白抑制剂作为治疗HCM的首类新药被逐步认可,越来越多的临床试验也证明了其安全性、耐受性和有效性。Mavacamten及Aficamten均可显著降低LVOT压力梯度以及心脏标志物NT-proBNP和cTnI水平,并在一定程度上改善NYHA心功能分级,且安全性良好、不良反应轻、患者均可耐受。心肌肌球蛋白抑制剂的出现,弥补了传统药物只控制症状而不能改善心功能的缺陷,为HCM患者预后带来了新的希望。

