血培养阳性标本直接快速药敏试验临床应用价值评估
张渝琴,罗福康,周 丽,阮 真,朱星辉,汪曼菲
重庆市第九人民医院检验科,重庆 400700
血流感染主要是病原菌(包括多种细菌、真菌和病毒)大量侵入人体血液后所引起的一种全身炎症反应综合征[1],严重者可进展为感染性休克、心力衰竭甚至死亡[2]。目前,采集患者血液进行培养仍然是菌血症诊断的金标准[3-4]。在血培养瓶阳性报警后采用传统检测方法至少需要48 h才能获得细菌鉴定与药敏试验结果。传统检测方法因检测时间长[5],易延误医生对患者病情的诊治,造成患者血流感染进一步恶化[6]。利用基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS) 技术可直接对血培养阳性标本进行快速鉴定且具有较高的准确性[7]。欧洲药敏试验委员会(EUCAST)在2018年发布了纸片法血培养阳性瓶直接快速药敏试验(RAST)的方法及折点[8],给快速药敏试验标准化操作和结果解读提供了重要依据。本试验中革兰阴性杆菌参考 EUCAST发布的纸片法血培养阳性瓶进行RAST,革兰阳性球菌参考2021年美国临床和实验室标准化协会(CLSI)发布的M100文件中推荐对血培养阳性标本进行RAST[9]。本研究拟将血培养阳性瓶RAST与常规药敏结果进行比对,评估血培养RAST的临床应用价值,进一步探寻能够为临床血流感染提供快速、准确药敏结果的方法,以指导临床目标性抗感染治疗。
1 资料与方法
1.1一般资料 收集2021年4月至2022年4月本院血培养报阳后涂片染色镜检为单一革兰阴性杆菌或革兰阳性球菌的标本,排除3 d内重复送检为同一种细菌及混合感染的标本。
1.2仪器与试剂 BACTEC FX全自动微生物培养系统及配套血培养瓶(美国BD公司);Vitek 2 Compact 60全自动微生物鉴定和药敏系统及配套试剂(法国生物梅里埃公司);血平板、巧克力平板、M-H琼脂平板购自重庆庞通公司;药敏纸片(英国Oxoid公司)。
1.3方法
1.3.1血培养阳性标本RAST
1.3.1.1革兰阴性杆菌血培养阳性标本RAST 参照2018年EUCAST公布的纸片法血培养阳性瓶RAST方法,从涂片为单一革兰阴性杆菌的血培养阳性培养瓶中直接抽取100~150 μL培养液至直径90 mm的M-H琼脂平板上,均匀涂布后贴上相应抗菌药物纸片,药敏纸片包括哌拉西林/他唑巴坦(36 μg/6 μg)、头孢他啶(10 μg)、美罗培南(10 μg)、亚胺培南(10 μg)、环丙沙星(5 μg)、阿米卡星(30 μg)、庆大霉素(10 μg) 、妥布霉素(10 μg)。35 ℃培养4、6、8 h后,分别量取抑菌圈直径,根据 EUCAST发布的不同细菌在不同时间的快速药敏试验的折点判读药敏试验结果。本实验室建立血培养快速药敏方法时按照EUCAST规定进行快速药敏试验质控操作,且每周常规进行标准药敏试验方法质量控制,以保证药敏试验的试剂及标准化纸片扩散法的过程质量。质控菌株为大肠埃希菌ATCC25922、铜绿假单胞菌ATCC27853。根据EUCAST发布的RAST判读标准,结果可分为敏感、耐药和技术不定区域(ATU) 。ATU代表药敏试验判定结果(敏感、中介、耐药)不确定的区域,通常为1~3 mm的抑制区直径范围。在此区域中,敏感、中介、耐药的判定错误率较高。因此,对ATU结果不建议进行敏感性判定。
1.3.1.2革兰阳性球菌血培养阳性标本RAST 从涂片为单一革兰阳性球菌的血培养阳性标本中抽取100~150 μL培养液,葡萄球菌移至M-H琼脂平板,链球菌移至血M-H琼脂平板上,均匀涂布后贴上相应抗菌药物纸片,药敏纸片包括左氧氟沙星(5 μg)、环丙沙星(5 μg)、红霉素(15 μg)、克林霉素(2 μg)、四环素(30 μg)、利奈唑胺(10 μg)、万古霉素(5 μg)、青霉素(10 U)。35 ℃培养16~24 h后量取抑菌环直径。参考CLSI 2021 M100葡萄球菌(16~18 h,空气)和肺炎链球菌(20~24 h,CO2)纸片扩散法抑菌圈折点进行药敏结果判读(敏感、中介、耐药)。质控方法参照CLSI 2021 M100每周常规进行标准药敏方法质量控制。质控菌株为金黄色葡萄球菌ATCC25923、肺炎链球菌ATCC49619。
1.3.2血培养阳性标本常规鉴定及药敏试验 当血培养仪提示阳性报警后,取出阳性瓶进行革兰染色并转种至血平板、巧克力平板,35 ℃培养18~24 h,挑选单个菌落,制备成0.5个麦氏浊度单位菌悬液。革兰阴性杆菌、革兰阳性球菌均采用Vitek 2 Compact 60全自动细菌鉴定分析仪进行细菌鉴定及药敏试验。参照梅里埃公司给出的Vitek 2 Compact全自动微生物分析系统SOP,质控频率为每周一次。质控菌株为霍氏肠杆菌ATCC700323、嗜麦芽窄食单胞菌ATCC1766、铅黄肠球菌ATCC700327、腐生葡萄球菌ATCCBAA750、大肠埃希菌 ATCC25922、铜绿假单胞菌ATCC27853、金黄色葡萄球菌ATCC29213、粪肠球菌ATCC29212、肺炎链球菌ATCC49619。
1.3.3药敏结果比较 比对RAST结果与常规药敏结果的一致性,判断标准如下。(1)符合(CA):常规药敏结果为敏感(或耐药),RAST结果为敏感(或耐药)。(2)错误(Er) :常规药敏结果与RAST结果不一致。包括①严重错误(VME),假敏感,即常规药敏结果为耐药,RAST结果为敏感;②重大错误(ME),假耐药,即常规药敏结果为敏感,RAST结果为耐药;③微小错误(mE),常规药敏结果为中介,RAST结果为敏感或耐药。ATU结果不判读、不比较。
1.4统计学处理 用SPSS22.0软件进行数据分析。计数资料以例数、百分率表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1血培养阳性标本分离的病原菌 共收集409例血培养阳性标本,其中革兰阴性杆菌275例(67.2%),革兰阳性球菌134例(32.8%);标本来源于男性211例(51.6%)、女性198例(48.4%);70岁及以上患者202例(49.4%)。分离率居前3位的细菌分别为大肠埃希菌(43.5%)、凝固酶阴性葡萄球菌(15.6%)、肺炎克雷伯菌(15.2%)。见表1。
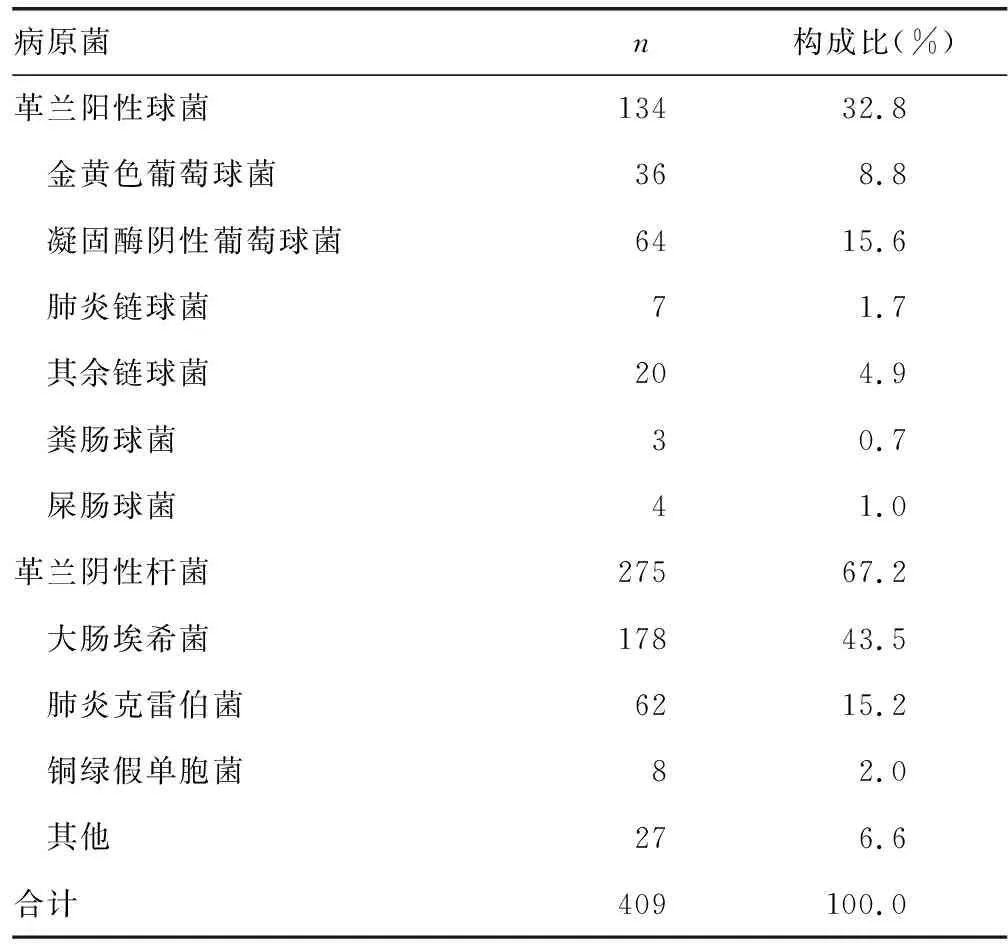
表1 血培养阳性标本分离的病原菌
2.2肠杆菌RAST结果与常规药敏结果对比 本试验共收集到178株大肠埃希菌并对其进行RAST。7种药物中:4 h不可测量率最高的为哌拉西林/他唑巴坦(12.4%),最低的为美罗培南(4.5%);6 h不可测量率除哌拉西林/他唑巴坦为0.6%外,其余6种药物均降为0.0%;8 h时全部药物均可测量。7种药物中4、6、8 h ATU比例最高的分别为哌拉西林/他唑巴坦(24.2%)、妥布霉素(17.4%)、妥布霉素(16.9%),最低分别为庆大霉素(3.9%)、阿米卡星(1.1%)、阿米卡星(1.1%)。6 h时7种药物不可测量率和ATU比例均较4 h明显下降,其中下降最明显的是哌拉西林/他唑巴坦,6 h不可测量率较4 h下降了11.8%,ATU比例下降了14.6%,但8 h时7种药物不可测量率和ATU比例与6 h时变化不大。 RAST结果与常规药敏结果相比:7种药物中4、6、8 h CA比例最高的均为庆大霉素,4、6、8 h CA比例最低的分别为哌拉西林/他唑巴坦、妥布霉素、妥布霉素;6 h所有抗菌药物CA比例均高于4 h,差异均有统计学意义(P<0.05),但与8 h所有抗菌药物CA比例相比,差异无统计学意义(P>0.05);4、6、8 h VME比例最高的均为环丙沙星,分别为2.8%、3.4%、3.4%;美罗培南VME、ME、mE三者比例均为0.0%;庆大霉素、阿米卡星、哌拉西林/他唑巴坦这3种抗菌药物均无VME。见表2。
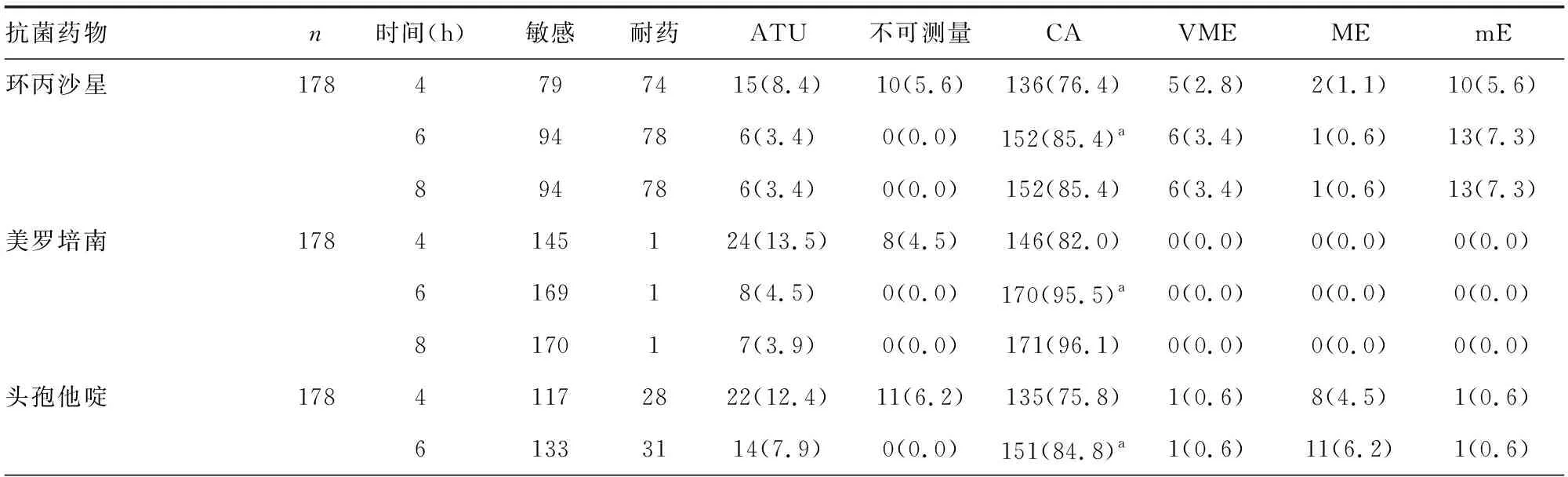
表2 大肠埃希菌RAST药敏结果与常规药敏结果一致性比较[n或n(%)]
本试验总共收集到62株肺炎克雷伯菌并对其进行了RAST。7种药物中:4 h不可测量率最高的为环丙沙星(6.5%)、哌拉西林/他唑巴坦(6.5%),6 h除1株菌因生长不良无法测量外其他菌株所有药物均可测量。7种药物中4、6、8 h ATU比例最高的分别为哌拉西林/他唑巴坦(16.1%)、环丙沙星(8.1%)、环丙沙星(8.1%)。庆大霉素4、6、8 h均无ATU。7种药物不可测量率和ATU比例在6 h时均较4 h时明显下降,但在8 h时与6 h时变化不大。 RAST结果与常规药敏结果相比:7种药物中4、6、8 h CA比例最高的均为庆大霉素,CA比例最低的均为环丙沙星;6 h所有抗菌药物的CA比例均高于4 h ,差异有统计学意义(P<0.05),但与8 h CA比例差异无统计学意义(P>0.05);4、6、8 h VME比例最高的均为环丙沙星;美罗培南、头孢他啶、阿米卡星、妥布霉素这4种药物均无VME、ME、mE。肺炎克雷伯菌4、6、8 h的药敏结果CA比例分别为85.0%、94.2%,96.3%。见表3。
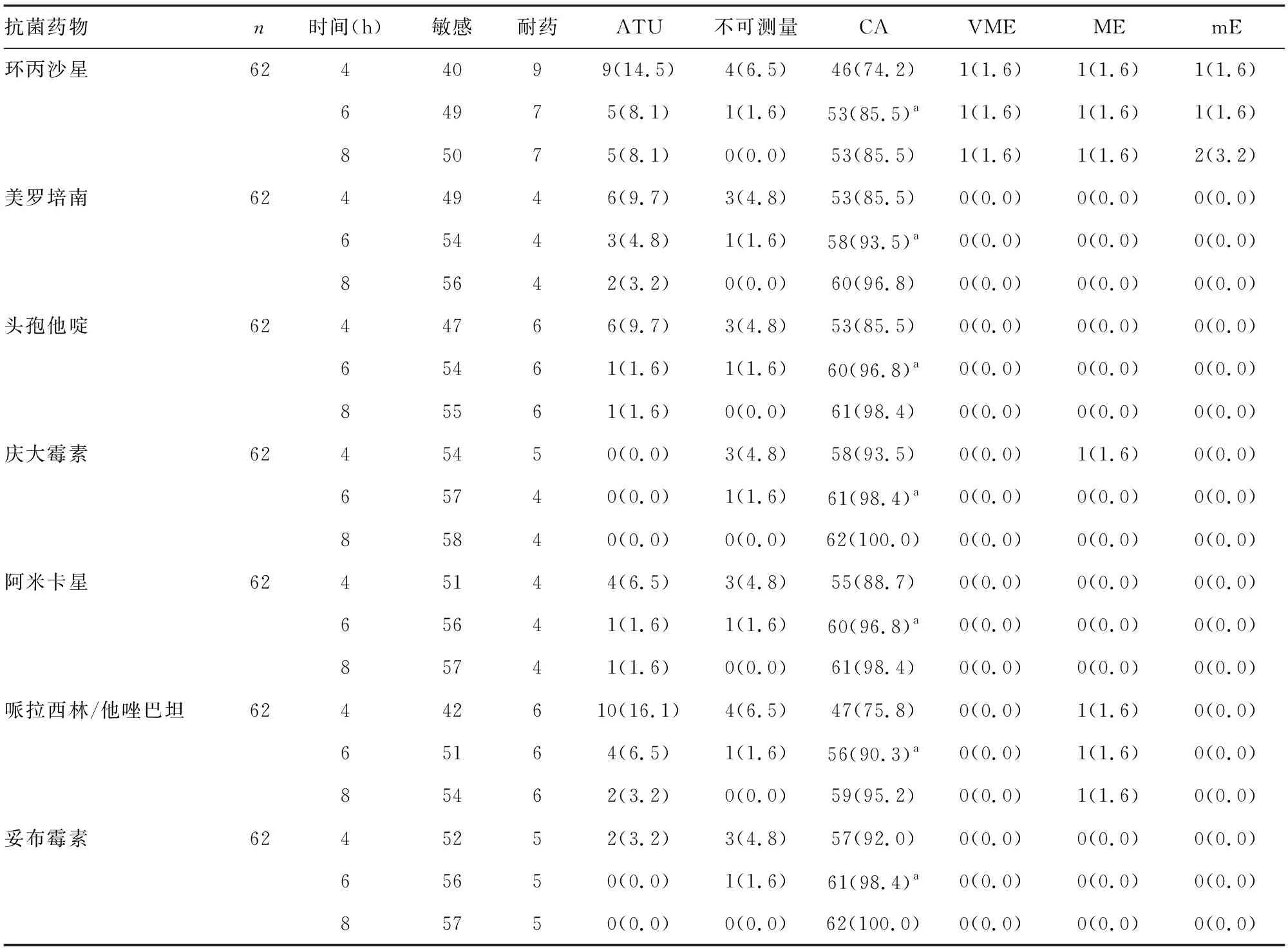
表3 肺炎克雷伯菌RAST药敏结果与常规药敏结果一致性比较[n或n(%)]
240株肠杆菌RAST结果与常规药敏结果显示,7种药物中4、6、8 h CA比例最高的药物为均为庆大霉素,分别为90.8%、98.3%、98.8%,仅在4 h出现了2例ME,其余判读时间均无VME、ME、mE;4、6、8 h CA比例最低的药物分别为哌拉西林/他唑巴坦(65.4%)、妥布霉素(80.0%)、妥布霉素(80.4%);4、6、8 h VME比例最高的均为环丙沙星,分别为2.5%、2.9%、2.9%;4、6、8 h ME比例最高的药物均为头孢他啶,分别为3.3%、4.6%、4.6%;4、6、8 h mE比例最高的药物均为妥布霉素,分别为5.0%、6.3%、6.7%;4、6、8 h错误率最低的药物为美罗培南,VME、ME、mE比例均为0.0%。哌拉西林/他唑巴坦在4 h不可测量率最高(10.8%)、ATU比例最高(22.1%),6 h不可测量率降至0.8%,但在7种药物中仍是最高,8 h不可测量率降至0.0%。见表4。肠杆菌在4、6、8 h CA比例分别为78.8%、90.5%、91.5%,6 h药敏结果CA比例优于4 h(P<0.05),与8 h果CA比例差异无统计学意义(P>0.05)。见表5。
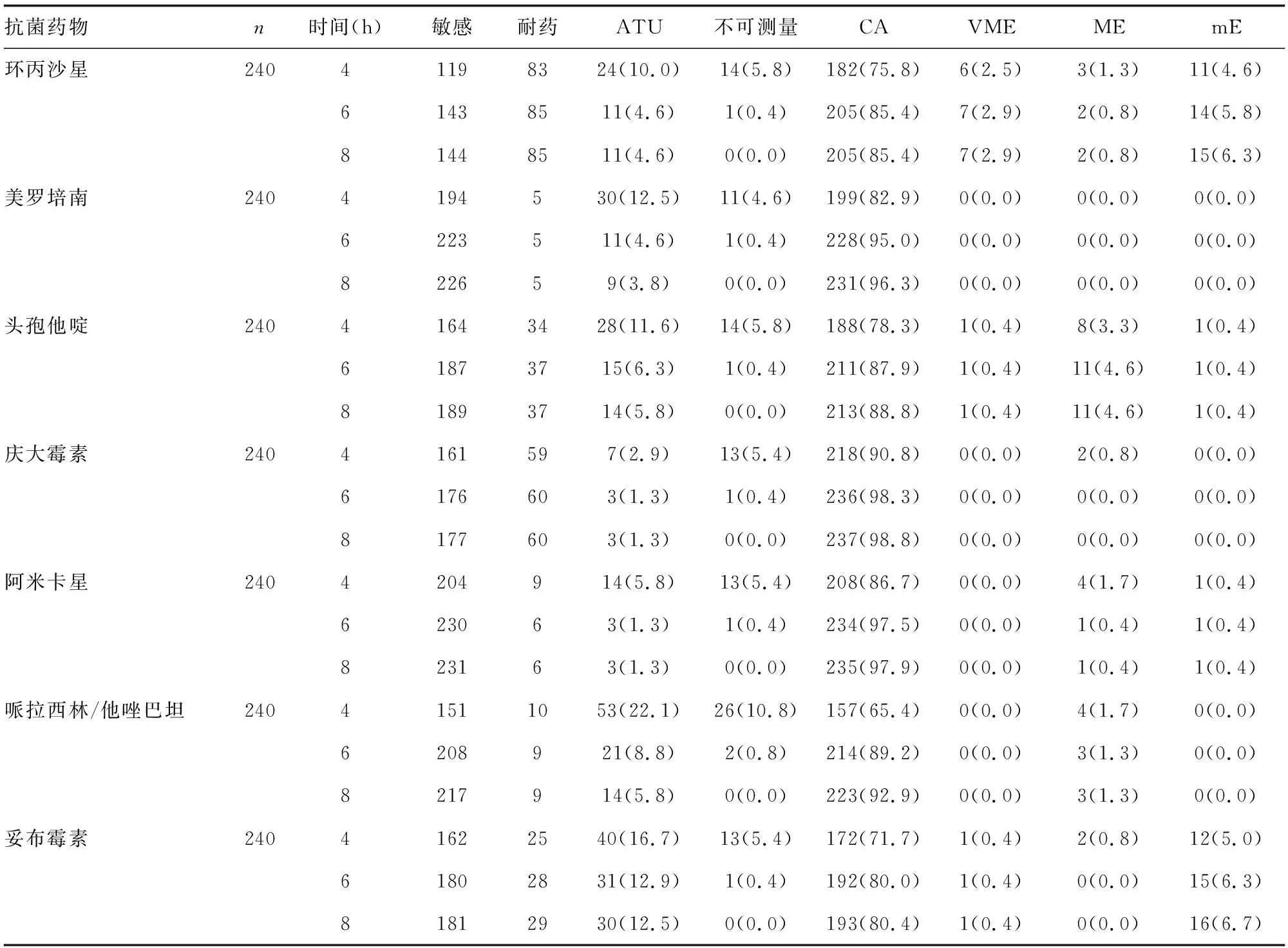
表4 肠杆菌RAST药敏结果与常规药敏结果一致性比较[n或n(%)]
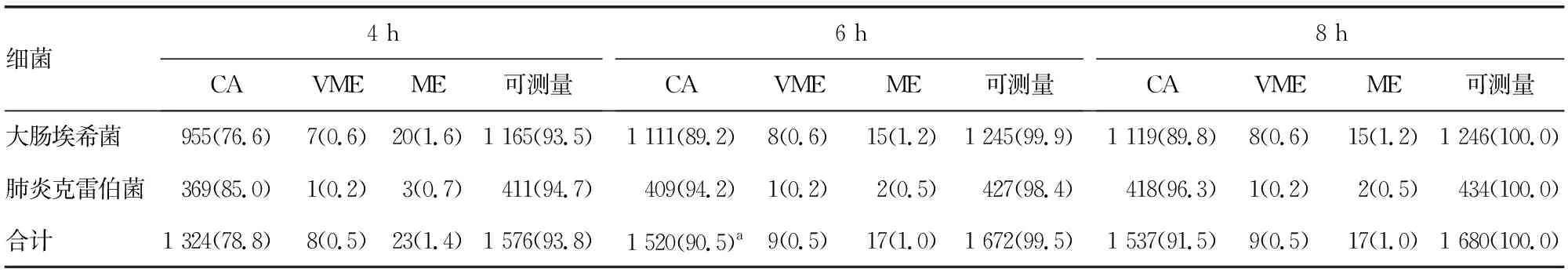
表5 肠杆菌各判读时间药敏结果比较[n(%)]
另外本试验共获取了5株CRE,均在4 h可测量7种药物且无ATU。RAST结果与常规药敏结果相比:7种药物的CA比例均为100.0%,无VME、ME、mE。见表6。
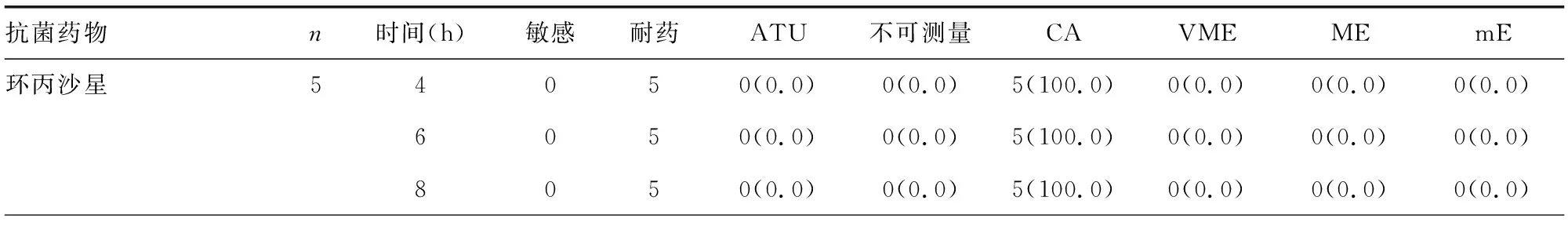
表6 CRE RAST药敏结果与常规药敏结果一致性比较[n或n(%)]
2.3铜绿假单胞菌RAST结果与常规药敏结果对比 本试验总共获得8株铜绿假单胞菌,除1株6 h生长不良,1株头孢他啶、哌拉西林/他唑巴坦6 h抑菌圈边缘模糊不可测量外,其余均可测量,在6、8 h可测量率分别为83.9%、100.0%。RAST结果与常规药敏结果相比:环丙沙星、美罗培南、亚胺培南、庆大霉素、妥布霉素6、8 h CA比例最高,均分别为87.5%、100.0%,哌拉西林/他唑巴坦CA比例最低,仅有50.0%、62.5%;8 h所有抗菌药物的CA比例均高于6 h ,但差异无统计学意义(P>0.05);7种药物6、8 h 均无VME、ME、mE。见表7。铜绿假单胞菌RAST结果与常规药敏结果相比,在6、8 h CA比例分别为80.4%、92.9%。
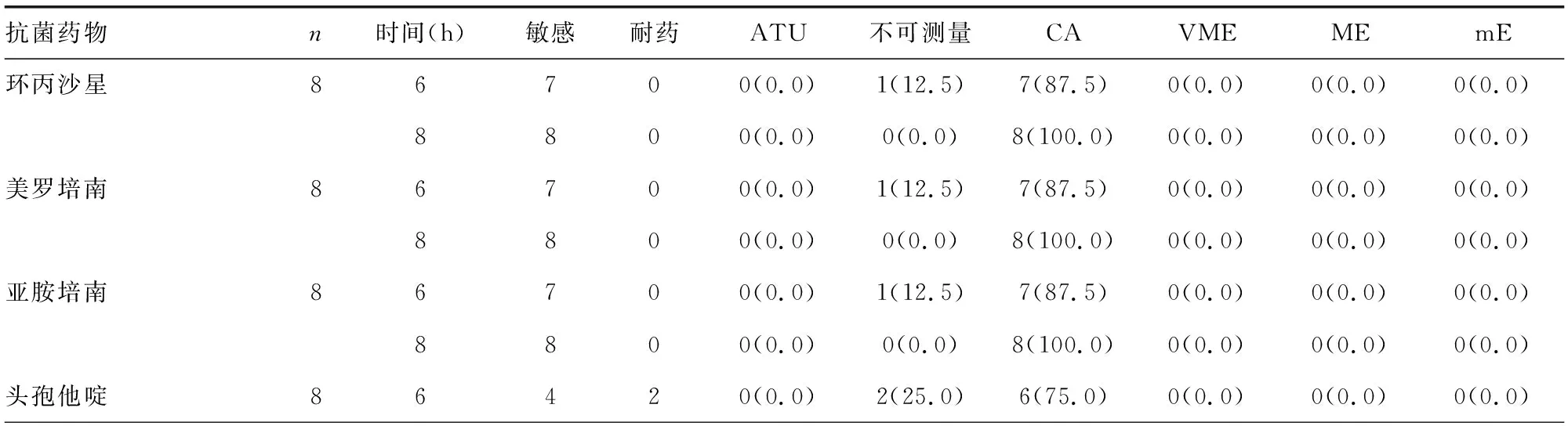
表7 铜绿假单胞菌RAST药敏结果与常规药敏结果一致性比较[n或n(%)]
2.4葡萄球菌RAST结果及与常规药敏结果对比 本试验总共收集到100株葡萄球菌并对其进行RAST,7种药物在16 h均可测量,可测量率为100.0%。RAST结果与常规药敏结果相比:CA比例最高的为利奈唑胺和青霉素,均为100.0%,最低的为克林霉素(77.0%);7种药物均无VME,但克林霉素mE比例较高,为21.0%。葡萄球菌在16 h CA比例为90.7%,ME比例为1.3%,mE比例为8.0%,无VME。见表8。
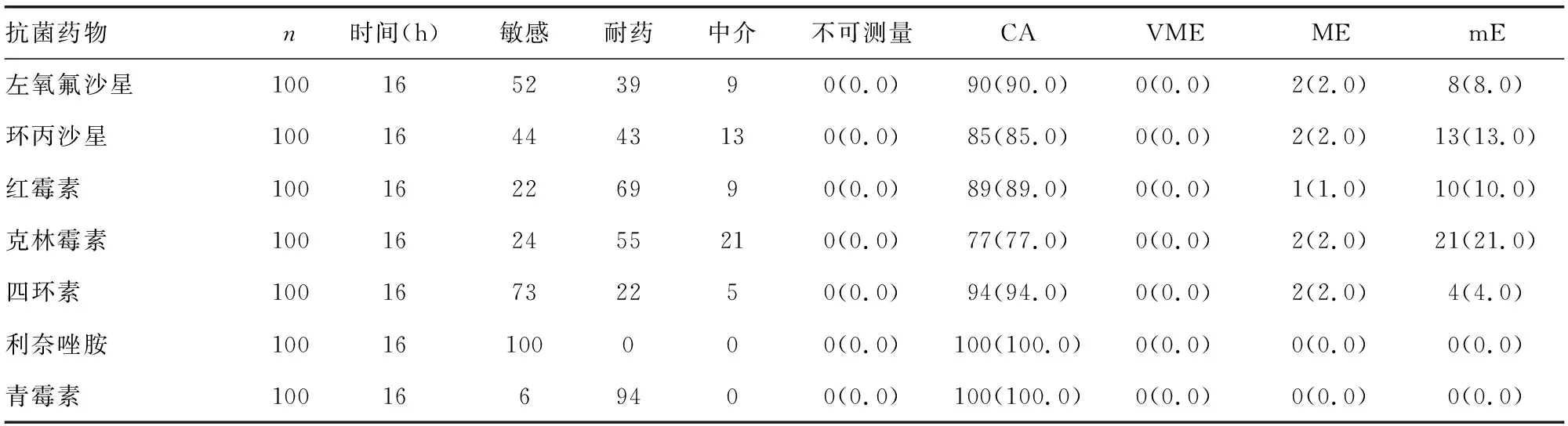
表8 葡萄球菌RAST药敏结果与常规药敏结果一致性比较[n或n(%)]
2.5肺炎链球菌RAST结果与常规药敏结果对比 本试验总共收集到7株肺炎链球菌并对其进行RAST,6种药物在20~24 h均可测量。RAST结果与常规药敏结果相比:6种药物的CA比例均为100.0%,均无VME、ME、mE。见表9。
3 讨 论
血流感染的有效治疗依赖于早期目标性抗感染治疗,而目标性抗感染治疗极大程度地依赖于及时、准确的微生物药敏结果。随着MALDI-TOF技术在临床微生物领域的应用,微生物鉴定比传统生化鉴定能够提前24 h完成。目前,快速获得血培养病原菌药敏结果的方法众多,某些学者将阳性血培养液预处理后制备成菌悬液,使用自动化仪器或纸片扩散法进行药敏试验[10],此法耗时相对较长,操作过程烦琐,反复的离心、洗涤更易产生气溶胶增加生物安全风险且无规范化折点来判断药敏结果;KIM等[11]用直接涂片检查分析不同抗菌药物条件下细菌形态的变化,可在6 h内检测细菌的耐药性,该方法较为复杂、烦琐,不易常规操作;谷钰峰等[12]将MALDI-TOF MS与FCM联合对细菌耐药基因进行快速检测,可在3 h内检测细菌药物敏感性,但此法所需仪器价格昂贵,不适合一般实验室推广;还有学者利用DNA微阵列、数字PCR、二代高通量测序等分子生物学手段快速检测细菌的耐药基因[13],但检测价格昂贵,不易常规检测。2018 年11月EUCAST 发布了纸片法血培养阳性RAST方法及折点,该方法简单、成本低、耗时短,易于实验室常规开展及标准化,具有普遍适用性,在一定程度上可弥补上述各方法存在的缺陷。
本试验参考EUCAST阳性血培养液RAST方法,对收集到的275株革兰阴性杆菌进行分析。试验发现肠杆菌在4 h时大部分抑菌圈直径可测量,大肠埃希菌平均4 h可测量率为93.5%,肺炎克雷伯菌为94.7%略高于前者。除1株肺炎克雷伯菌因生长不良6 h无法测量外,其余239株菌株6 h均可测量,8 h 240株菌株全部可测量。这也与现有研究结果一致[14]。RAST结果与常规药敏结果相比:大肠埃希菌4、6、8 h的药敏结果CA比例分别为76.6%、89.2%、89.8%。肺炎克雷伯菌4、6、8 h的药敏结果CA比例分别为85.0%、94.2%,96.3%,每个判读时间的药敏结果CA比例均高于大肠埃希菌。这可能与大肠埃希菌培养早期生长不良抑菌圈边缘模糊不清被忽略有关。RAST结果与常规药敏结果相比:本试验肠杆菌4、6、8 h的平均药敏结果CA比例分别为78.8%、90.5%、91.5%。肠杆菌6 h时CA比例>90%,明显优于4 h,差异有统计学意义(P<0.05),但与8 h相比,差异无统计学意义(P>0.05),提示6 h判读肠杆菌整体抗菌谱在准确性和时间上具有优势。本试验还收集到了5株CRE,均在4 h可测量全部药物且无ATU,RAST结果与常规药敏结果相比:CA比例均为100.0%,无VME、ME、mE。这意味着实验室4 h可向临床提供初步的目标性抗感染治疗方案,为CRE的治疗和危重症患者的救治赢得了宝贵的时间。本试验中的8株铜绿假单胞菌,在6、8 h可测量率分别为83.9%、100.0%,药敏结果CA比例分别为80.4%、92.9%。虽然8 h CA比例>90%且明显高于6 h,但8 h是否在判断铜绿假单胞整体抗菌谱在准确性和时间上更具有优势仍需更大量的数据支持。
本试验结果显示不同药物在不同时间点判读时不可测量率及药敏结果CA比例有所差别。RAST结果与常规药敏结果相比:肠杆菌CA比例最高的药物为庆大霉素,4、6、8 h的CA比例分别为90.8%、98.3%、98.8%,仅在4 h出现了2例ME,其余判读时间均无VME、ME、mE;VME最高的药物为环丙沙星,4、6、8 h的VME比例分别为2.5%、2.9%、2.9%。ME最高的药物为头孢他啶,4、6、8 h的ME比例分别为3.3%、4.6%、4.6%。mE最高的药物为妥布霉素,4、6、8 h的mE比例分别为5.0%、6.3%、6.7%。哌拉西林/他唑巴坦在4 h不可测量率最高10.8%,ATU最高22.1%,CA最低65.4%;6 h不可测量率降低到0.8%,ATU降至8.8%,CA上升到89.2%。哌拉西林/他唑巴坦同样也是铜绿假单胞菌抗菌谱中不可测量率最高、ATU比例最高、CA比例最低的药物。这可能与哌拉西林/他唑巴坦药物ATU范围跨度太大,导致有一部分结果落在ATU范围内无法判读从而降低了CA比例。本试验中无论是肠杆菌还是非发酵菌,美罗培南错误率均为0.0%,即无VME、ME、mE。
本试验100株葡萄球菌RAST折点的判读参照CLSI 2021 M100,判断时间为16~20 h。试验中100株葡萄球菌整体抗菌谱在16 h均可测量,药敏结果CA比例为90.7%,无VME,ME比例为1.3%,mE比例为8.0%。其中青霉素和利奈唑胺的CA比例均为100.0%,无VME、ME、mE。当常规药敏试验青霉素MIC≤0.12 μg/mL时,需进行青霉素边缘试验,而后再与RAST结果进行比对。本试验中有4株葡萄球菌在进行青霉素边缘实验修正结果为R后与直接快速药敏结果符合。葡萄球菌中CA比例最低,mE比例最高的均为克林霉素,比例分别为77.0%、21.0%。这可能与克林霉素RAST结果为中介的比例(21%)最高有关。中介结果中有47.6%的抑菌圈直径为20 mm,正好在中介与敏感的折点交界处。人为的测量和判读习惯及抑菌圈边缘稍微不清晰都可能导致测量结果1 mm的误差。这可能就是克林霉素中介结果判读过多、mE比例较高的主要原因。在葡萄球菌RAST中共发现24例诱导克林霉素耐药试验阳性,将结果修订为耐药后与常规药敏结果均符合。本试验未将万古霉素纳入葡萄球菌RAST抗菌谱内,这也是本试验的不足之处。根据CLSI 2021 M100要求在测定所有葡萄球菌对万古霉素的敏感性应执行MIC法。纸片法无法区分万古霉素敏感与中介的金黄色葡萄球菌。对于金黄色葡萄球菌外的葡萄球菌,纸片扩散法也无法区分敏感、中介、耐药。另外,本试验还收集到了7株肺炎链球菌,因生长要求比较严格,需在CO2环境下培养20~24 h。RAST结果显示6种抗菌药物在20~24 h均可测量,CA 比例均为100.0%,无VME、ME、mE。
综上所述,血培养RAST能够为临床提供较为快速、准确的药敏结果,这对于临床血流感染治疗有非常重要的指导意义[15]。肠杆菌在RAST6 h就可获得较为准确的结果,葡萄球菌则需要16 h。耐碳青霉烯肠杆菌、铜绿假单胞菌、肺炎链球菌则分别在RAST 4、8、20~24 h获得较为准确的结果,CRE和肺炎链球菌两者的CA比例更是达到了100.0%,但这三个时间段是否能够成为RAST结果报告时间还需更大量的数据支持。总的来说,RAST比常规药敏方法节省了1~2 d时间,为临床危重症患者的救治提供了宝贵的时间,同时临床医生可以将RAST结果作为参考,及时给患者使用和调整抗菌药物,降低患者病死率和避免抗菌药物的滥用造成细菌耐药性的变异。

