ECMO联合IAPB在急性心源性休克患者急救中的应用价值及对血气状况、预后的影响
焦相赟,吴金海△,左远航,杨振坤
河南省南阳市第一人民医院:1.急诊医学科;2.综合重症监护室,河南南阳 473000
心源性休克(CS)是由于心脏泵血功能衰竭、心排血量不足、组织缺血缺氧导致体循环障碍而引起的临床综合征,据调查,其发生率达5%~10%,病死率高达41.2%~52.1%[1]。虽然强心剂可在一定程度上改善临床症状,但也可增加心脏做功及心肌耗氧量,影响受损心肌恢复,当无法有效缓解病情时,临床常推荐采用机械循环治疗,为患者康复创造有利条件。主动脉内球囊反搏(IAPB)、体外膜肺氧合(ECMO)是现阶段最为常用的循环辅助支持技术,前者能改善组织灌注、减轻心脏左室后负荷及提升冠状动脉供血,后者可提供强大心肺支持,相关研究证实,二者联合应用可以达到互补协同效果,使患者受益最大化[2]。有研究发现,分泌型磷脂酶A2(sPLA2)、可溶性生长刺激表达因子2(sST2)水平在心力衰竭的发生、发展中具有重要地位[3-4]。本研究分析了ECMO联合IAPB对CS患者的疗效及对其sPLA2、sST2水平的影响。现报道如下。
1 资料与方法
1.1一般资料 根据治疗方案将2019年11月至2020年11月南阳市第一人民医院收治的96例急性CS患者分为对照组(45例)和联合组(51例)。对照组男女构成比为25/20;年龄19~73岁,平均(47.63±6.74)岁;发病至救治时间1~11 h,平均(7.13±1.24)h;Killip心功能分级:Ⅱ级8例,Ⅲ级28例,Ⅳ级9例;体质量指数18.7~24.6 kg/m2,平均(21.27±1.01)kg/m2。联合组男女构成比为29/22;年龄20~72岁,平均(48.28±6.67)岁;发病至救治时间1~11 h,平均(7.05±1.21)h;Killip心功能分级:Ⅱ级10例,Ⅲ级30例,Ⅳ级11例;体质量指数18.6~24.6 kg/m2,平均(21.27±1.03)kg/m2。两组性别、年龄、发病至救治时间、心功能分级、体质量指数比较,差异均无统计学意义(P>0.05),均衡可比。本研究经本院伦理委员会审核批准(审批号:jld101),所有参与研究的患者均签署知情同意书。(1)纳入标准:符合CS诊断标准[5],即超过30 min收缩压<90 mm Hg,应用血管活性药物后舒张压≥90 mm Hg,临床表现为器官灌注不足和肺淤血;年龄>18岁;具备明确ECMO、IAPB治疗指征;发病至救治时间<12 h,临床资料完整;均由急性心肌梗死引起。(2)排除标准:合并血流感染者;脑出血、不可逆性脑损害者;患有严重精神疾病者;其他疾病所致CS者;因其他原因出现多器官功能损害表现者;近3个月参与类似研究者;穿刺部位皮下感染者。
1.2治疗方法 两组均给予基础治疗,包括吸氧、卧床休息等。对照组给予IAPB,局部麻醉,经股动脉置入反搏球囊导管,接通动脉球囊反搏仪,心电触发模式1∶1,设置充气、放气时间,每小时持续静脉泵入1 000 U肝素,随后结合患者症状调整反搏频率,血流动力学稳定后停用。联合组在此基础上给予ECMO,采用Seldinger法穿刺,置静脉、动脉引流管,采用VA-ECMO支持模式,膜肺吸入氧浓度为60%,静脉引流压≤30 mm Hg,待患者血流动力学稳定后,撤除。
1.3观察指标 (1)病情程度。采用急性生理功能和慢性健康状况评分系统Ⅱ(APACHEⅡ)和多器官功能障碍评分量表(MODS)评估患者病情。APACHEⅡ包括急性、慢性健康评分及年龄3个维度,分值与病情程度呈正相关;MODS总分为0~24分,分值与患者病死风险呈正相关。(2)血气指标。以血气分析仪(美国罗氏公司,型号:Roche cobasb 123)测定血乳酸(Lac)、动脉血氧饱和度(SaO2)、pH值。(3)心功能指标。以彩色多普勒超声诊断仪(美国GE公司,型号:Voluson E8)测定心脏指数(CI)、每搏输出量(SV)、心输出量(CO),并计算射血分数(EF)。(4)其他相关指标。采集所有患者清晨空腹静脉血6 mL,3 000 r/min离心10 min,取上清液,置于低温环境,采用酶联免疫吸附试验测定sST2、sPLA2、B型脑钠肽(BNP)水平,采用免疫比浊法测定心肌肌钙蛋白I(cTnI)水平。(5)住院期间病死率。
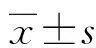
2 结 果
2.1两组治疗前后APACHEⅡ、MODS评分比较 治疗后,两组APACHEⅡ、MODS评分均低于治疗前,且联合组低于对照组,差异均有统计学意义(P<0.05)。见表1。
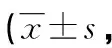
表1 两组治疗前后APACHEⅡ、MODS评分比较分)
2.2两组治疗前后血气指标比较 治疗后,两组Lac水平均低于治疗前,SaO2水平和pH值高于治疗前,差异均有统计学意义(P<0.05);且治疗后联合组Lac水平低于对照组,SaO2水平和pH值高于对照组,差异均有统计学意义(P<0.05)。见表2。
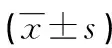
表2 两组治疗前后血气指标比较
2.3两组治疗前后心功能相关指标比较 治疗后,两组EF与CI、SV、CO水平均高于治疗前,且联合组高于对照组,差异均有统计学意义(P<0.05)。见表3。
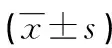
表3 两组治疗前后心功能相关指标比较
2.4两组治疗前后其他相关指标比较 治疗后,两组血清BNP、cTnI、sPLA2、sST2水平均低于治疗前,且联合组低于对照组,差异均有统计学意义(P<0.05)。见表4。
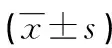
表4 两组治疗前后其他相关指标比较
2.5两组住院期间病死率比较 联合组住院期间病死率为9.80%(5/51),对照组为13.33%(6/45),两组住院期间病死率比较,差异无统计学意义(χ2=0.294,P=0.588)。
3 讨 论
CS是急性心肌ST段抬高型心肌梗死最严重并发症,其心功能严重受损,随时有心搏骤停风险,具有病情重、病死率高的特点。机械辅助可促进机体血流动力学稳定,且一定程度上能替代心脏做功。
IAPB常用于CS循环支持治疗,其主要作用机制是提高主动脉舒张压,增加心脏灌注量;在心室收缩时放气,减轻左心室后负荷,降低心脏做功,减少心肌氧耗,稳定血流速度,促进心功能恢复。IBANEZ等[6]研究指出,对于仅靠IAPB辅助治疗效果不理想的患者,联合ECMO可进一步提高治疗效果。ECMO为密闭体外循环系统,其通过右侧股静脉或颈内静脉插管将静脉血牵引至体外,后泵入至膜肺经由氧和器氧合,排出二氧化碳,并将氧合血重新泵注至动脉系统,替代体外部分及全部心肺功能,从而提供呼吸及循环双重支持。本研究将ECMO、IAPB联合应用于CS患者,结果显示,治疗后联合组APACHEⅡ、MODS评分及Lac水平低于对照组,SaO2、CI、SV、CO水平及EF、pH值高于对照组。分析其原因是ECMO可部分或全部替代心脏泵血功能及肺氧合功能,以此改善呼吸、循环功能,其血流灌注可达心排血量的50%~75%,能提供充分循环及氧供,且应用ECMO时心排血量不依赖于心脏做功,心肺可充分休息;同时其能实现血液分流,可有效调节双心室前负荷。
BNP、cTnI为心肌损伤辅助诊断指标,已有相关研究证实,心力衰竭患者血清cTnI水平明显高于健康人群,其水平随心肌损伤程度加重而持续性升高[7]。BNP是一种具有舒张血管、降低醛固酮释放的神经激素,可加快心脏疾病进展,恶化病情,且心功能越差其表达量越高。本研究结果显示,联合组治疗后血清BNP、cTnI水平低于对照组,究其原因可能与ECMO联合IAPB能进一步降低左室收缩期后负荷、室壁张力及舒张期末容积有关。此外,有研究发现,sST2可导致炎症介质表达及免疫功能调节失衡,致使心室重构失衡,损伤心脏功能,当机体突发心力衰竭时,可增加无氧代谢,从而加快机体脂肪酸消耗[8]。sPLA2由血管内膜中的炎症细胞释放,有证据显示,其与左室射血分数呈负相关,且随着心功能分级升高而升高[9]。陈泽芳等[10]研究指出,随着sPLA2表达量提升,心力衰竭发生风险越高,且可增加死亡风险。本研究数据表明,联合组治疗后血清sPLA2、sST2水平低于对照组,可见ECMO、IAPB联合应用于CS患者可有效减轻炎症反应,改善心功能。这与其能减轻心脏负荷,保护靶器官有关。此外,本研究还发现,ECMO、IAPB联合应用并未增加病死率,说明联合应用安全性较好,可在一定程度上减少介入医生的顾虑。
综上所述,ECMO联合IAPB可提高CS患者心功能,改善血气相关指标,有效缓解病情,降低病死风险,抑制炎症反应。

