CT影像加权组学评分预测非小细胞肺癌的免疫治疗疗效
朱振宸 陈闽江 宋兰 王金华 胡歌 韩伟 谭卫雄 周振 隋昕 宋伟 金征宇

基金項目:中国医学科学院医学与健康科技创新工程临床与转化医学研究专项重点项目(2021-I2M-C&T-A-007)、国家自然科学基金(82171934)、北京市科学技术委员会AI+健康协同创新培育项目(Z201100005620008)、中华国际医学交流基金会SKY影像科研基金(Z-2014-07-2101)和科技创新2030-新一代人工智能重大项目(2020AAA0109503)
摘要:目的 通过治疗前胸部增强CT肺内多病灶组学特征构建加权组学评分模型,预测非小细胞肺癌患者接受程序性死亡受体1(PD-1)/PD配体1(PD-L1)免疫治疗的疗效。方法 回顾性收集北京协和医院2015年6月至2022年2月接受PD-1/PD-L1 免疫治疗的非小细胞肺癌病例。根据临床结局分为有效组(部分缓解或完全缓解)和无效组(疾病稳定或疾病进展)。从治疗前动脉期CT图像提取多病灶影像组学,通过基于注意力机制的多示例学习算法在病例水平获得加权组学特征,采用Logistic回归建立加权评分模型。采用受试者工作特征曲线下面积(AUC)分别比较加权评分模型、PD-L1模型、临床模型、加权评分+PD-L1模型和综合模型预测肿瘤治疗疗效的效能。结果 最终纳入237例患者,随机分为训练集(n=165)和测试集(n=72)。训练集和测试集患者的平均年龄分别为(64±9)岁和(62±8)岁。加权评分模型预测免疫治疗疗效的AUC在训练集和测试集中分别为0.85和0.80,高于PD-L1-1模型(Z=37.30,P<0.001和Z=5.69,P=0.017)、PD-L1-50模型(Z=38.36,P<0.001和Z=17.99,P<0.001)和临床模型(Z=11.40,P<0.001和Z=5.76,P=0.016)的预测能力,与加权评分+PD-L1模型和综合模型比较差异无统计学意义(P均>0.05)。结论 基于治疗前增强CT影像多病灶加权组学评分能够预测非小细胞肺癌患者接受免疫治疗的疗效。
关键词:非小细胞肺癌;免疫检查点抑制剂;CT;加权组学评分
中图分类号: R445.3;R734.2 文献标志码: A 文章编号:1000-503X(2023)05-0794-09
DOI:10.3881/j.issn.1000-503X.15705
CT-Based Weighted Radiomic Score Predicts Tumor Response to Immunotherapy in Non-Small Cell Lung Cancer
ZHU Zhenchen1,CHEN Minjiang2,SONG Lan1,WANG Jinhua1,HU Ge3,HAN Wei4,TAN Weixiong5,ZHOU Zhen5,SUI Xin1,SONG Wei1,JIN Zhengyu1
1Department of Radiology,2Department of Respiratory and Critical Care Medicine,3Translational Medicine Center,PUMC Hospital,CAMS and PUMC,Beijing 100730,China
4Department of Epidemiology and Biostatistics,Institute of Basic Medical Sciences,CAMS and PUMC,Beijing 100005,China
5Beijing Deepwise & League of PHD Technology Co.,Ltd.,Beijing 100081,China
Corresponding author:SONG Lan Tel:010-69155442,E-mail:songl@pumch.cn
ABSTRACT:Objective To develop a CT-based weighted radiomic model that predicts tumor response to programmed death-1(PD-1)/PD-ligand 1(PD-L1)immunotherapy in patients with non-small cell lung cancer.Methods The patients with non-small cell lung cancer treated by PD-1/PD-L1 immune checkpoint inhibitors in the Peking Union Medical College Hospital from June 2015 to February 2022 were retrospectively studied and classified as responders(partial or complete response)and non-responders(stable or progressive disease).Original radiomic features were extracted from multiple intrapulmonary lesions in the contrast-enhanced CT scans of the arterial phase,and then weighted and summed by an attention-based multiple instances learning algorithm.Logistic regression was employed to build a weighted radiomic scoring model and the radiomic score was then calculated.The area under the receiver operating characteristic curve(AUC)was used to compare the weighted radiomic scoring model,PD-L1 model,clinical model,weighted radiomic scoring + PD-L1 model,and comprehensive prediction model.Results A total of 237 patients were included in the study and randomized into a training set(n=165)and a test set(n=72),with the mean ages of(64±9)and(62±8)years,respectively.The AUC of the weighted radiomic scoring model reached 0.85 and 0.80 in the training set and test set,respectively,which was higher than that of the PD-L1-1 model(Z=37.30,P<0.001 and Z=5.69,P=0.017),PD-L1-50 model(Z=38.36,P<0.001 and Z=17.99,P<0.001),and clinical model(Z=11.40,P<0.001 and Z=5.76,P=0.016).The AUC of the weighted scoring model was not different from that of the weighted radiomic scoring + PD-L1 model and the comprehensive prediction model(both P>0.05).Conclusion The weighted radiomic scores based on pre-treatment enhanced CT images can predict tumor responses to immunotherapy in patients with non-small cell lung cancer.
Key words:non-small cell lung cancer;immune checkpoint inhibitor;CT;weighted radiomic score
Acta Acad Med Sin,2023,45(5):794-802
肺癌是全球发病率和死亡率最高的恶性肿瘤,非小细胞肺癌(non-small cell lung carcinoma,NSCLC)占肺癌比例的80%~85%,其中以腺癌和鳞癌为主要病理亚型[1-2]。既往研究表明靶向程序性死亡受体1(programmed death-1,PD-1)或PD配体1(PD ligand-1,PD-L1)的免疫检查点抑制剂可以显著改善肺癌患者的客观缓解率和生存期[1,3-6]。临床上推荐对NSCLC患者进行PD-L1检测以筛选适合免疫治疗的患者[7-8],但多项研究发现PD-L1表达阴性的患者也能从免疫治疗中获益[9-12]。接受PD-1/PD-L1检查点抑制剂治疗的患者的肿瘤客观缓解率为15%~60%[3]。此外,肿瘤组织PD-L1检测具有侵袭性,不适用于所有患者。因此,目前仍需要一种精准、非侵入性的生物标志物来预测肿瘤对免疫治疗的反应。基于CT影像组学特征可以实现对医学图像的定量化分析,进而可以用来预测肿瘤的治疗疗效[13]。研究显示采用CT影像组学特征可以预测肿瘤组织中CD8淋巴细胞的浸润程度、免疫治疗疗效或生存期长短等等,但大多数研究结果受限于数据量小且病种复杂,限制了模型的推广应用[14-17]。基于注意力机制的多示例学习(attention-based multiple instances learning,a-MIL)算法可以获得与分类任务最相关的影像区域的权重系数,从而优化预测模型的准确性[18-20]。本团队前期研究结果显示采用a-MIL算法对多病灶组学特征进行加权求和,可以提升预测模型的效能[21]。因此,本研究尝试基于a-MIL构建多病灶加权评分模型,预测晚期NSCLC患者接受免疫治疗的疗效,并探索联合PD-L1表达水平是否能够提升模型的预测效能。
资料和方法
资料来源 回顾性收集2015年6月至2022年2月北京协和医院Ⅲ和Ⅳ期NSCLC患者的CT和临床资料。纳入标准:(1)年龄>18岁;(2)病理确诊为NSCLC;(3)接受至少1次PD-1/PD-L1免疫治疗;(4)不可切除的Ⅲ和Ⅳ期肺癌[7]。排除标准:(1)CT图像采集时间距离免疫治疗开始时超过28 d;(2)无基线增强CT图像;(3)无可以勾画的肿瘤病灶或病灶与周围组织分界不清;(4)接受PD-1/PD-L1治疗未满1个周期停药;(5)无治疗前PD-L1表达水平。最终纳入237例接受免疫治疗的NSCLC患者。本研究通过北京协和医院伦理委员会审批(伦理审查编号:S-K196Z)。
数据收集 从电子病历系统检索患者的性别、年龄、吸烟史、TNM分期、治疗前是否出现脏器转移、开始用药时间、用药方案、病理类型及表皮生長因子受体、KRAS和ROS1驱动基因突变。
PD-L1表达检测 采用免疫组织化学染色检测肿瘤样本的PD-L1表达水平,检测样本至少包括100个肿瘤细胞[22],计算PD-L1染色阳性肿瘤细胞数占肿瘤细胞总数的比例。以1%和50%为阈值,将PD-L1表达水平分为阴性(<1%)、低表达(1%~49%)和高表达(≥50%)。
结局评价 主要临床结局为总体最佳疗效,由1名高年资放射科医师和1名高年资呼吸科医师根据实体肿瘤疗效评价标准(1.1版)进行评估[23],根据治疗疗效将患者分为有效组(部分缓解或完全缓解)和无效组(疾病稳定或疾病进展)。
图像采集和评估 采用德国西门子Somatom Definition Flash和Somatom Force、美国通用电气医疗Discovery CT750 HD、荷兰飞利浦IQon CT和日本东芝Aquilion 64 CT扫描仪。扫描参数:管电压120 kVp,自动管电流调节技术,重建层厚0.625~5 mm。以2.5 ml/s的速率静脉注射80~100 ml非离子型对比剂优维显300(德国拜耳先灵制药公司)或碘佛醇320(江苏恒瑞医药股份有限公司),并在35 s后进行增强扫描,以获得动脉期CT图像。所有CT图像经匿名化处理、重采样和标准化校正后上传至Dr.Wise科研平台,在平台上完成病变自动分割[24]。由1名高年资胸部影像诊断医师在不知道患者用药情况和治疗疗效的情况下在纵隔窗(窗宽450 HU,窗位50 HU)和肺窗(窗宽1200 HU,窗位-600 HU)的横断面图像上逐层确认和修改结果。勾画时以瘤-肺界面作为感兴趣区的边界,且尽量排除血管、支气管、肺不张等相邻的正常肺组织。选择最大直径≥10 mm的病灶进行分析,且每个病例最多保留5个病灶。由Dr.Wise科研平台随机抽取30例影像资料分配给另一名高年资胸部影像诊断医师进行同样标准的勾画,进行可靠性分析。
组学特征提取 将半自动分割的三维肿瘤容积感兴趣区导入Python(3.8版)软件,使用PyRadiomics包(3.0.1版)为每个感兴趣区提取1454个组学特征。其中原始图像组学特征104个,包括14个形状特征、18个一阶特征和72个高阶纹理特征;经小波变换(n=8)和拉普拉斯高斯变换(σ=1,2或3)图像的组学特征990个;经算式变换的组学特征360个。加权组学特征由Zhu等[21]研究中所描述的a-MIL模型训练得到。
特征选择和模型构建 首先去除容易受勾画轮廓影响的特征[观察者间相关系数(inter-reader correlation coefficient,ICC)≤ 0.8];其次,计算两两特征的Pearson相关系数(Pearson correlation coefficient,PCC),如果一对特征的PCC≥0.85,保留组间差异统计学检验P值较低的特征;最后,将剩余的组学和临床特征输入基于L1的LASSO回归模型,保留系数非零的特征作为最终的建模特征。采用Logistic回归模型建立加权评分模型,并计算每例患者的组学评分,采用5折交叉验证方法选取验证集中性能最佳的模型,并在测试集中进行测试。以免疫治疗前PD-L1表达水平是否超过1%或50%构建PD-L1-1模型和PD-L1-50模型。对临床和病理特征采用多因素Logistic回归分析进行初筛,选取P<0.05的具有独立预测能力的特征,采用基于Bootstrap法的Logistic回归分析经抽样1000次筛选的特征用于构建临床模型。将加权组学评分和临床病理特征采用Logistic回归构建综合模型。
统计学处理 采用R软件(4.2.2)进行统计分析,用药周期以M(Q1,Q3)表示,其余计量资料以均数±标准差表示,对符合正态分布且方差齐时组间比较采用独立样本t检验,不符合正态分布且方差齐时组间比较采用秩和检验。分类变量以百分数表示,组间比较采用χ2检验或Fisher确切概率法。采用Logistic回归对肿瘤免疫治疗的预测因素进行分析,计算危险比值比(odd ratio,OR)和95% CI。采用受试者工作特征曲线下面积(area under curve,AUC)比较加权评分模型、PD-L1模型、临床模型、加权评分+PD-L1模型和综合模型预测肿瘤疗效的效能,并计算曲线最佳阈值下的敏感度、特异度、阳性预测值和阴性预测值。P<0.05为差异有统计学意义。
结果
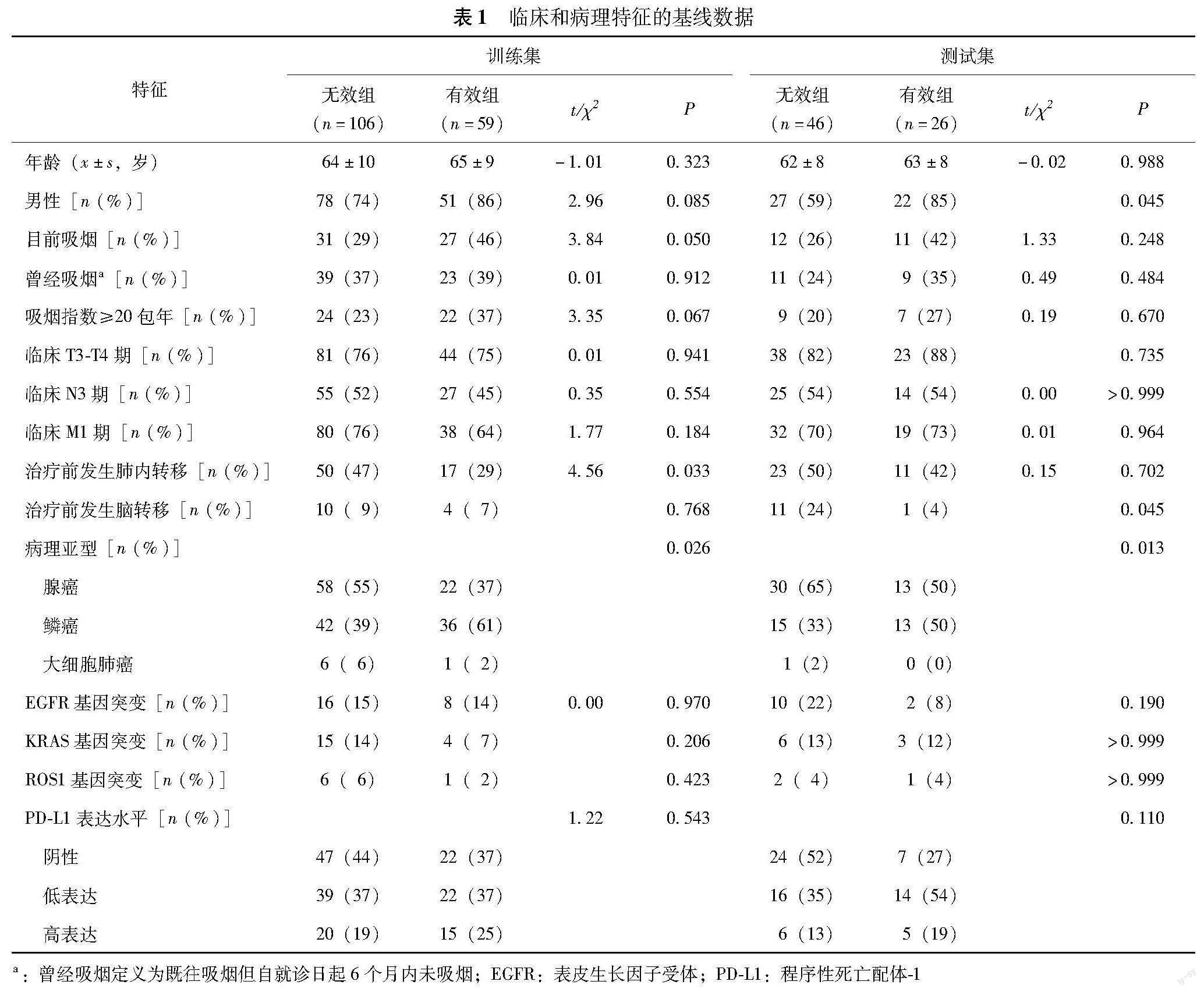
一般资料 共纳入237例NSCLC患者,免疫治疗中位周期数为10.0(4.0,22.5)个,中位随访时间为13.6(7.2,25.7)个月。将全部数据随机分为训练集(n=165)和测试集(n=72)。训练集中有效组占比36%,平均年龄(64±9)岁,使用一线免疫治疗80例、免疫单药治疗66例、联合化疗90例、联合靶向治疗17例,腺癌和鳞癌分别占48%和47%,PD-L1阴性、低表达和高表达病例比例分别为42%、37%和21%;与无效组比较,有效组中鳞癌病理亚型比例较高(P=0.026),而治疗前肺内转移比例较低(P=0.033)(表1)。测试集中有效组占比36%,平均年龄(62±8)岁,使用一线免疫治疗33例、免疫单药治疗26例、联合化疗42例、联合靶向治疗8例,腺癌和鳞癌分别占60%和39%,PD-L1阴性、低表达和高表达病例比例分别为43%、42%和15%;与无效组比较,有效组中男性比例较高(P=0.045),而治疗前肿瘤脑转移比例较低(P=0.045)(表1)。
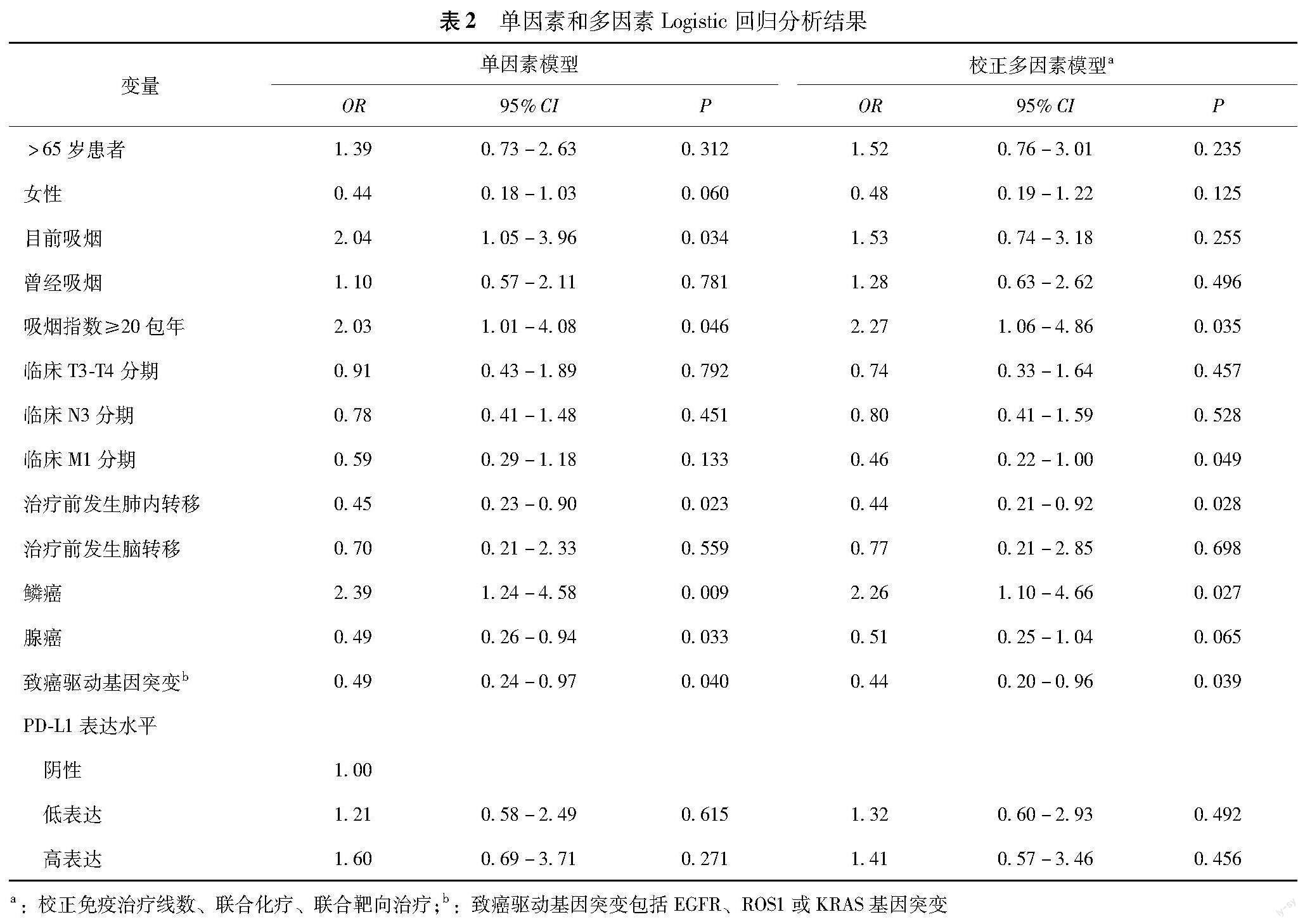
特征筛选 对多病灶原始组学特征通过a-MIL算法在病例水平进行加权求和,保留ICC>0.8的特征798个,去除共线性特征后剩余576个,采用LASSO回归筛选出33个加权组学特征,包括一阶特征8个、形态特征7个、灰度大小区域矩阵(gray-level size zone matrix,GLSZM)相关纹理特征10个、灰度游程矩阵(gray-level run-length matrix,GLRLM)相关纹理特征2个、灰度依赖矩阵(gray-level dependence matrix,GLDM)相关纹理特征1个、灰度共生矩阵(gray-level co-occurrence matrix,GLCM)相关纹理特征5个。正向权重最高的特征为经拉普拉斯高斯变换(σ=2 mm)的GLCM特征,负向权重最高的特征为经平方算子计算的GLCM特征。临床病理特征的Logistic回归分析结果显示,经过免疫治疗线数、联合化疗和联合靶向治疗调整后,吸烟指数≥20包年(OR=2.27,95%CI=1.06~4.86,P=0.035)和鳞癌(OR=2.26,95%CI=1.10~4.66,P=0.027)是免疫治疗有效的独立预测因子。M1分期(OR=0.46,95%CI=0.22~1.00,P=0.049)、治疗前肺内转移(OR=0.44,95%CI=0.21~0.92,P=0.028)和致癌驱动基因突变(OR=0.44,95%CI=0.20~0.96,P=0.039)是免疫治疗无效的独立预测因子(表2)。
模型构建和效能评价 由33个加权组学特征采用Logistic回归构建加权评分模型,根据每个加权组学特征对应的β系数(表3),计算每例患者的加权组学评分,截距为-0.93。基于吸烟指数≥20包年、治疗前肺内转移和鳞癌构建临床模型。基于吸烟指数≥20包年、治疗前肺内转移、致癌驱动基因突变、PD-L1高表达和加權组学评分构建综合模型。加权评分模型预测免疫治疗疗效的AUC在训练集和测试集中分别为0.85和0.80,高于PD-L1-1模型(Z=37.30,P<0.001和Z=5.69,P=0.017)、PD-L1-50模型(Z=38.36,P<0.001和Z=17.99,P<0.001)和临床模型(Z=11.40,P<0.001和Z=5.76,P=0.016)的预测能力,与加权评分+PD-L1模型和综合模型比较差异无统计学意义(P均>0.05)(表4、图1)。
亚组分析 不同PD-L1表达水平对应的免疫治疗有效率在免疫单药亚组中差异有统计学意义(P=0.047)。根据加权组学评分是否达到0.39将患者分为高评分和低评分组,两组患者在一线免疫治疗(χ2=44.13,P<0.001)、后线免疫治疗(P<0.001)、免疫单药治疗(χ2=16.11,P<0.001)和免疫联合治疗亚组(χ2=44.13,P<0.001)中免疫治疗有效率差异均有统计学意义。
讨论
本研究纳入北京协和医院接受PD-1/PD-L1免疫治疗的NSCLC患者,基于治疗前胸部增强CT影像,构建了多病灶加权评分模型,其AUC在训练集中为0.85,测试集中为0.80,与PD-L1和临床模型比较,具有更优的预测效能。
PD-1/PD-L1信号通路是目前临床肿瘤靶向治疗的方向之一,通常采用PD-L1表达水平筛选目标人群及预测免疫治疗的有效性。多项关于帕博利珠单抗的临床研究表明,PD-L1表达水平≥50%的人群可以获得更高的客观缓解率和更长的生存期[25-26]。Herbst等[6]研究发现PD-L1表达水平≥1%的人群接受阿替利珠单抗治疗后的客观缓解率较对照组显著提高。本研究免疫单药的亚组分析结果显示,PD-L1表达阴性患者的治疗有效率显著低于PD-L1表达水平≥1%的患者,提示PD-L1表达水平对免疫单药治疗疗效的预测有较大帮助,但本研究也发现PD-L1模型在免疫联合治疗的人群中疗效预测表现不佳,这可能与化疗能够改变肿瘤免疫微环境的特征有关。既往研究表明PD-L1表达阴性的人群接受免疫联合化疗的客观缓解率和生存率较对照组显著提高[10,27]。此外,本研究构建的临床模型预测免疫治疗疗效的AUC在测试集中仅为0.60,其性能还有待进一步提升。
影像组学可以对医学图像进行定量分析,传统组学分析方法通常提取病灶最大层面的组学特征进行模型构建。Shen等[28]基于治疗前增强CT影像的纹理特征构建了预测肺癌患者接受免疫治疗后的疾病进展情况模型,AUC在训练集中达到0.812。Ligero等[14]研究显示基于GLCM和GLDM的纹理特征可以有效地区分免疫治疗反应和非反应组,在外部验证中,该模型AUC达到了0.7。与单个病灶模型相比,多病灶模型更能全面评估患者的肿瘤特征,更准确地预测患者的治疗反应和预后。本研究采用一种新的组学分析方法,通过a-MIL对多病灶的组学特征自适应地加权求和,获得一个整体肿瘤水平的组学特征,在训练集(AUC=0.85)和测试集(AUC=0.80)中均显示出较好的预测效果,且优于PD-L1和临床模型。研究表明a-MIL多病灶算法还可准确预测晚期肺癌患者免疫治疗的无进展生存期,为肺癌免疫治疗提供了新的思路和方法。
本研究将PD-L1表达水平和临床病理特征通过基于Bootstrap的Logistic回归法联合加权组学评分构建综合模型,其预测效能与单一的加权评分模型相比未见提升,这可能与加入的其他特征对于肿瘤治疗反应的预测能力不足有关;另外,有研究表明影像组学特征可以预测PD-L1表达水平和肿瘤致癌驱动基因突变,加权评分模型中可能已包含了与这些因素相关的临床信息[29-31]。
本研究存在一些局限性。首先,本研究是一个回顾性、单中心研究,还需要前瞻性、多中心的研究验证。其次,本研究仅基于动脉期增强影像勾画病灶,未来可对多期相的组学特征进行探索。
綜上,本研究结果表明,基于治疗前增强CT影像多病灶加权组学评分能够预测NSCLC患者免疫治疗的肿瘤反应,为PD-1/PD-L1免疫治疗疗效评价提供了新的方法。
参考文献
[1]Chen P,Liu Y,Wen Y,et al.Non-small cell lung cancer in China[J].Cancer Commun(Lond),2022,42(10):937-970.DOI:10.1002/cac2.12359.
[2]Siegel RL,Miller KD,Fuchs HE,et al.Cancer statistics,2021[J].CA Cancer J Clin,2021,71(1):7-33.DOI:10.3322/caac.21654.
[3]Memmott RM,Wolfe AR,Carbone DP,et al.Predictors of response,progression-free survival,and overall survival in patients with lung cancer treated with immune checkpoint inhibitors[J].J Thorac Oncol,2021,16(7):1086-1098.DOI:10.1016/j.jtho.2021.03.017.
[4]Horn L,Mansfield AS,Szczesna A,et al.First-line atezolizumab plus chemotherapy in extensive-stage small-cell lung cancer[J].N Engl J Med,2018,379(23):2220-2229.DOI:10.1056/NEJMoa1809064.
[5]Tambo Y,Sone T,Shibata K,et al.Real-world efficacy of first-line pembrolizumab in patients with advanced or recurrent non-small-cell lung cancer and high PD-L1 tumor expression[J].Clin Lung Cancer,2020,21(5):e366-e379.DOI:10.1016/j.cllc.2020.02.017.
[6]Herbst RS,Baas P,Kim DW,et al.Pembrolizumab versus docetaxel for previously treated,PD-L1-positive,advanced non-small-cell lung cancer(KEYNOTE-010):a randomised controlled trial[J].Lancet,2016,387(10027):1540-1550.DOI:10.1016/S0140-6736(15)01281-7.
[7]中华医学会肿瘤学分会,中华医学会杂志社.中华医学会肺癌临床诊疗指南(2022版)[J].中华医学杂志,2022,102(23):1706-1740.DOI:10.3760/cma.j.cn112137-20220413-00795.
[8]王佳慧,陈公琰.基于PD-1/PD-L1抑制剂的非小细胞肺癌免疫治疗预测标志物的研究进展[J].现代肿瘤医学,2021,29(10):1822-1825.DOI:10.3969/j.issn.1672-4992.2021.10.039.
[9]Gandhi L,Rodriguez-Abreu D,Gadgeel S,et al.Pembrolizumab plus chemotherapy in metastatic non-small-cell lung cancer[J].N Engl J Med,2018,378(22):2078-2092.DOI:10.1056/NEJMoa1801005.
[10]Paz-Ares L,Luft A,Vicente D,et al.Pembrolizumab plus chemotherapy for squamous non-small-cell lung cancer[J].N Engl J Med,2018,379(21):2040-2051.DOI:10.1056/NEJMoa1810865.
[11]Hellmann MD,Paz-Ares L,Bernabe Caro R,et al.Nivolumab plus ipilimumab in advanced non-small-cell lung cancer[J].N Engl J Med,2019,381(21):2020-2031.DOI:10.1056/NEJMoa1910231.
[12]Paz-Ares L,Ciuleanu TE,Cobo M,et al.First-line nivolumab plus ipilimumab combined with two cycles of chemotherapy in patients with non-small-cell lung cancer(CheckMate 9LA):an international,randomised,open-label,phase 3 trial[J].Lancet Oncol,2021,22(2):198-211.DOI:10.1016/S1470-2045(20)30641-0.
[13]Yin X,Liao H,Yun H,et al.Artificial intelligence-based prediction of clinical outcome in immunotherapy and targeted therapy of lung cancer[J].Semin Cancer Biol,2022,86(Pt 2):146-159.DOI:10.1016/j.semcancer.2022.08.002.
[14]Ligero M,Garcia-Ruiz A,Viaplana C,et al.A CT-based radiomics signature is associated with response to immune checkpoint inhibitors in advanced solid tumors[J].Radiology,2021,299(1):109-119.DOI:10.1148/radiol.2021200928.
[15]Nardone V,Tini P,Pastina P,et al.Radiomics predicts survival of patients with advanced non-small cell lung cancer undergoing PD-1 blockade using Nivolumab[J].Oncol Lett,2020,19(2):1559-1566.DOI:10.3892/ol.2019.11220.
[16]Vaidya P,Bera K,Patil PD,et al.Novel,non-invasive imaging approach to identify patients with advanced non-small cell lung cancer at risk of hyperprogressive disease with immune checkpoint blockade[J].J Immunother Cancer,2020,8(2):e001343.DOI:10.1136/jitc-2020-001343.
[17]Liu Y,Wu M,Zhang Y,et al.Imaging biomarkers to predict and evaluate the effectiveness of immunotherapy in advanced non-small-cell lung cancer[J].Front Oncol,2021,11:657615.DOI:10.3389/fonc.2021.657615.
[18]Zhang X,Lu D,Gao P,et al.Survival-relevant high-risk subregion identification for glioblastoma patients:the MRI-based multiple instance learning approach[J].Eur Radiol,2020,30(10):5602-5610.DOI:10.1007/s00330-020-06912-8.
[19]Li Z,Zhao W,Shi F,et al.A novel multiple instance learning framework for COVID-19 severity assessment via data augmentation and self-supervised learning[J].Med Image Anal,2021,69:101978.DOI:10.1016/j.media.2021.101978.
[20]Lu MY,Williamson DFK,Chen TY,et al.Data-efficient and weakly supervised computational pathology on whole-slide images[J].Nat Biomed Eng,2021,5(6):555-570.DOI:10.1038/s41551-020-00682-w.
[21]Zhu Z,Chen M,Hu G,et al.A pre-treatment CT-based weighted radiomic approach combined with clinical characteristics to predict durable clinical benefits of immunotherapy in advanced lung cancer[J].Eur Radiol,2023,33(6):3918-3930.DOI:10.1007/s00330-022-09337-7.
[22]Whiteside TL.The tumor microenvironment and its role in promoting tumor growth[J].Oncogene,2008,27(45):5904-5912.DOI:10.1038/onc.2008.271.
[23]Schwartz LH,Seymour L,Litiere S,et al.RECIST 1.1-standardisation and disease-specific adaptations:perspectives from the RECIST Working Group[J].Eur J Cancer,2016,62:138-145.DOI:10.1016/j.ejca.2016.03.082.
[24]Qi LL,Wu BT,Tang W,et al.Long-term follow-up of persistent pulmonary pure ground-glass nodules with deep learning-assisted nodule segmentation[J].Eur Radiol,2020,30(2):744-755.DOI:10.1007/s00330-019-06344-z.
[25]Reck M,Rodriguez-Abreu D,Robinson AG,et al.Updated analysis of KEYNOTE-024:pembrolizumab versus platinum-based chemotherapy for advanced non-small-cell lung cancer with PD-L1 tumor proportion score of 50% or greater[J].J Clin Oncol,2019,37(7):537-546.DOI:10.1200/JCO.18.00149.
[26]Aguilar EJ,Ricciuti B,Gainor JF,et al.Outcomes to first-line pembrolizumab in patients with non-small-cell lung cancer and very high PD-L1 expression[J].Ann Oncol,2019,30(10):1653-1659.DOI:10.1093/annonc/mdz288.
[27]Rittmeyer A,Barlesi F,Waterkamp D,et al.Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer(OAK):a phase 3,open-label,multicentre randomised controlled trial[J].Lancet,2017,389(10066):255-265.DOI:10.1016/S0140-6736(16)32517-X.
[28]Shen L,Fu H,Tao G,et al.Pre-immunotherapy contrast-enhanced CT texture-based classification:a useful approach to non-small cell lung cancer immunotherapy efficacy prediction[J].Front Oncol,2021,11:591106.DOI:10.3389/fonc.2021.591106.
[29]Wang C,Ma J,Shao J,et al.Non-invasive measurement using deep learning algorithm based on multi-source features fusion to predict PD-L1 expression and survival in NSCLC[J].Front Immunol,2022,13:828560.DOI:10.3389/fimmu.2022.828560.
[30]Mu W,Jiang L,Shi Y,et al.Non-invasive measurement of PD-L1 status and prediction of immunotherapy response using deep learning of PET/CT images[J].J Immunother Cancer,2021,9(6):e002118.DOI:10.1136/jitc-2020-002118.
[31]楊新官,关玉宝.EGFR突变与ALK重排型肺癌的影像组学研究进展[J].国际医学放射学杂志,2018,41(4):431-435.DOI:10.19300/j.2018.Z5569.
(收稿日期:2023-06-02)

