赤芍-附片对慢加急性肝衰竭大鼠PI3K/AKT信号通路及相关炎症因子表达的影响*
曹钰楠,谭年花,唐陈琴,陈 斌
(1.湖南中医药大学,湖南 长沙 410208;2.湖南中医药大学第一附属医院肝病研究所,湖南 长沙 410007)
慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)是在慢性肝病基础上,由各种诱因引起肝功能急性失代偿的临床综合征[1]。ACLF病情凶险,短期病死率高[2]。目前关于ACLF的发病机制主要集中在免疫炎症失衡、氧化应激、细胞凋亡等方面,其中不同致病因素引起的免疫炎症反应在ACLF的发生发展过程中极为关键,而全身炎症反应既是ACLF的特征也是其驱动因素。促炎性细胞因子水平的升高及在免疫应答过程中各种免疫细胞的活化就是过度炎症反应的表现[3],同时也影响着患者的预后。前期研究[4-5]已证实温阳解毒化瘀方治疗肝衰竭疗效确切,能够减轻炎症反应。温阳解毒化瘀方以清温并用法组方。赤芍-附片作为核心药对彰显了组方特点,在临床配伍应用中具有高度代表性。磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(AKT)信号通路是一条与炎症、肿瘤、免疫性疾病等发病机制密切相关的胞内信号转导途径[6]。故本研究以PI3K/AKT信号通路作为切入点,探究赤芍-附片对ACLF的作用机制,旨在为赤芍-附片药对治疗ACLF提供参考。
1 材料与方法
1.1 实验动物 健康雄性SPF级SD大鼠48只,体质量130~150 g,由湖南斯莱克景达实验动物有限公司提供,动物生产许可证号:SCXK(湘)2019-0004,合格证号:ZS-202103230022。大鼠饲养于湖南中医药大学动物实验中心,室温(24±2)℃,湿度40%~60%,昼夜明暗交替12 h。实验经实验动物伦理委员会批准(LLBH-202103160007)。
1.2 主要试剂与仪器 牛血清白蛋白(批号:A1933-5G)、D-半乳糖(批号:MB1853-1)、脂多糖(批号:MB5198-1)均购自美国Sigma 公司;白介素-1β(IL-1β)试剂盒(批号:KE00021-40000723)、白介素-6(IL-6)试剂盒(批号:KE00139-40000712)、肿瘤坏死因子-α(TNF-α)试剂盒(批号:KE00068-40000941)均购自美国Proteintech公司;p-PI3K抗体(批号:PA5-38905)购自Invitrogen Antibodies公司;PI3K抗体(批号:60225-1-Ig)、p-AKT抗体(批号:66444-1-Ig)、AKT抗体(批号:10176-2-AP)、山羊抗鼠二抗(批号:SA00001-1)、山羊抗兔二抗(批号:SA00001-2)均购自美国Proteintech公司;mRNA逆转录试剂盒(批号:CW2569)、miRNA逆转录试剂盒(批号:CW2141)均购自北京康为世纪生物科技有限公司。H1650R型冷冻离心机购自湖南湘仪实验室仪器开发有限公司;DYY-6C型电泳仪、DYCZ-24DN型电泳槽均购自北京六一仪器厂;BA210T型显微镜购自北京Motic公司;PIKOREAL96荧光定量RCP仪、SPL0960型荧光PCR板均购自美国Thermo公司。
1.3 实验药物 赤芍(批号:2012003C)、附片(批号21030068S)均购于湖南中医药大学第一附属医院,经药学部邓桂明研究员鉴定中药为正品。制备方法:称取对应剂量的赤芍、附片(赤芍组赤芍50 g;附片组附片15 g;赤芍-附片组赤芍50 g,附片15g),加入10倍量的水煮沸2 h,过滤药液,药渣加入8倍量水煮沸1 h,2次药液混合后过滤,再用旋转蒸发仪浓缩药液至65 mL(药液生药质量浓度为1 g/mL)。乳果糖口服液(湖南科伦制药有限公司,批号:H20093523,66.7 g/100mL)。
1.4 ACLF动物造模[7-8]适应性喂养1周,首先将48只大鼠随机分为空白组(6只)、ACLF造模组(42只)。ACLF造模组大鼠构建ACLF模型。首先用牛血清白蛋白免疫致敏法构建免疫性肝纤维化大鼠模型,除空白组外的其余大鼠予牛血清白蛋白乳化液皮下多点注射致敏,0.5 mL/次(含牛血清白蛋白4 mg),分别在第1、15、25、35天注射,共4次;第36天起,予以尾静脉注射牛血清白蛋白攻击建立免疫性纤维化大鼠模型,初始剂量为2 mg/次,依次递加0.5 mg/次,达4 mg/次后维持此剂量,每周注射2次,持续6周;最后在第6周末,通过腹腔注射D-半乳糖(600 mg/kg)+脂多糖(100 μg/kg)急性攻击,构建ACLF大鼠模型。急性攻击8 h后以10%水合氯醛(0.4 mL/100g)进行麻醉并采集腹主动脉血、肝组织等样本以备检测。
1.5 分组与给药 至给药干预前共存活33只大鼠。将33只造模大鼠随机分为模型组(6只)、阳性组(乳果糖组,6只)、赤芍组(7只)、附片组(7只)、赤芍-附片组(7只)。在造模期间尾静脉注射的第6周开始进行药物灌胃干预,按人与大鼠等效剂量换算系数折算,赤芍组、附片组、赤芍-附片组大鼠每日中药等效剂量分别为4.50、1.35、5.85 g/kg,阳性组予乳果糖灌胃,大鼠每日等效剂量为1.8 g/kg。灌胃给药,2次/d,给药持续7 d至急性攻击前。
1.6 观察指标
1.6.1 肝功能、凝血酶原时间(PT) 采集腹主动脉血约5 mL,4 ℃,3 000 r/min(离心半径为10 cm),离心15 min分离血浆,取上清后生化法检测血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TBIL)、总胆汁酸(TBA);采用全自动血凝仪测定PT。
1.6.2 肝组织炎症因子TNF-α、IL-1β、IL-6水平 采用酶联免疫吸附试验法(ELISA)检测肝组织炎症因子TNF-α、IL-1β、IL-6水平。取各组大鼠肝组织研磨制备肝组织匀浆,重复冻融破坏细胞膜后离心取上清;设空白孔、标准品孔(50 μL)、样本孔,样本空中加入40 μL样品稀释液,逐步稀释至5倍,除空白孔外每孔加入酶试剂100μL,封板,37 ℃恒温孵育120 min,PBST洗涤后弃液,拍干;向孔中依次加入A、B显色液,37 ℃避光显色15~30 min;加入终止液50 μL终止反应;终止后15 min内测定OD值;制作标准曲线,计算样本浓度。
1.6.3 大鼠肝组织病理变化 取各组大鼠肝组织,脱水透明后石蜡包埋,再进行切片、贴片,将切片60 ℃恒温烘干。将烘干的切片用二甲苯、乙醇快速脱水。水洗后经苏木素染色,冲洗、返蓝后伊红染色,洗涤后不同浓度乙醇脱水40 s,二甲苯透明切片,封片,盖上盖玻片固封。显微镜下观察并取片。
1.6.4 肝组织PI3K、p-PI3K、AKT、p-AKT(Ser473)蛋白相对表达量 采用蛋白免疫印迹法(Western blotting)检测肝组织PI3K、p-PI3K、AKT、p-AKT(Ser473)蛋白相对表达量。取肝组织样本,洗涤后加入RIPA裂解液,反复研磨组织;冰上裂解,4 ℃,12 000 r/min(离心半径为10 cm),4 ℃,离心15 min,取上清。制胶,准备蛋白上清,根据蛋白定量结果加入样本开始电泳;转膜后用PBST冲洗,5%脱脂奶粉封闭90 min;抗体稀释液稀释一抗[PI3K(1∶5 000),P-PI3K(1∶1 000),AKT(1∶1 000),P-AKT(1∶2 000)],孵育一抗,PBST洗涤;用抗体稀释液稀释HRP标记的二抗,HRP山羊抗鼠IgG(1∶5 000),HRP山羊抗兔IgG(1∶6 000),37 ℃孵育90 min;加入ECL化学发光液,用塑封膜将膜包裹杂交膜,曝光、显影冲洗。
1.6.5 肝组织PI3KmRNA、AKT mRNA相对表达量 采用Realtime PCR法(RT-PCR)检测肝组织PI K mRNA、AKT mRNA相对表达量。取肝组织样本研磨,裂解,加入三氯甲烷后振荡、静置,4 ℃,12 000 r/min(离心半径为10 cm),离心15 min,收集上清液,加入等体积异丙醇后混匀、静置,再次离心后去除上清,加入无水乙醇洗涤,离心后弃掉废液,室温放置晾干,溶解沉淀,分光光度计测定RNA含量、纯度,逆转录cDNA,然后进行定量PCR扩增(预变性:95 ℃,10 min;变性95 ℃,15 s;退火55 ℃,20 s;延伸60 ℃,30 s。循环40次),按照2-ΔΔCt方法计算PI3K mRNA、AKT mRNA的相对表达量。引物序列见表1,扩增曲线及溶解曲线见图1~2。

表1 引物序列

图1 PI3K mRNA 扩增及溶解曲线图
图2 AKT mRNA 扩增及溶解曲线图
1.7 统计学方法 采用SPSS 26.0软件进行分析,计量资料用“均数±标准差”(±s)表示,多组间比较采用单因素方差分析(One-way ANOVA),两两比较用最小显著性差异法(LSD)检验,若不服从正态分布或方差不齐,则采用Kruskal-Wallis H检验,P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠肝脏组织形态变化情况 空白组大鼠肝脏表面光滑,肝细胞无变性坏死,排列有序,肝小叶结构正常,中央静脉清晰。模型组大鼠肝脏表面粗糙,可见颗粒状结节,肝组织破坏,肝细胞形态变化,呈融合性坏死、点状或灶状坏死,肝小叶结构紊乱,纤维组织增生,多发性假小叶形成,伴大量炎症细胞浸润,表明ACLF造模成功[1]。阳性组、赤芍组、附片组、赤芍-附片组肝细胞坏死程度较模型组改善,纤维组织减少,肝小叶结构破坏减轻,汇管区少量炎症细胞浸润,以赤芍-附片组改善最为明显。(见图3)
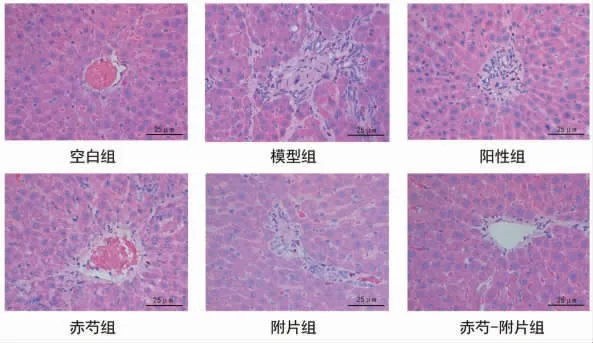
图3 各组大鼠肝脏病理图 (HE,×400)
2.2 各组大鼠肝功能、PT比较 模型组大鼠血清ALT、AST、TBIL、TBA、PT水平高于空白组(P<0.05);阳性组、赤芍组、附片组、赤芍-附片组大鼠血清ALT、AST、TBIL、TBA、PT水平均低于模型组(P<0.05),且赤芍-附片组大鼠血清ALT、AST、TBIL、TBA、PT水平均低于阳性组、赤芍组、附片组(P<0.05)。(见表2)
表2 各组大鼠血清TBIL、ALT、AST、TBA、PT 比较 (±s)

表2 各组大鼠血清TBIL、ALT、AST、TBA、PT 比较 (±s)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与赤芍-附片组比较,cP<0.05。
组别 n TBIL/(μmol/L) ALT/(IU/L) AST/(IU/L) TBA/(μmol/L) PT/s空白组 6 1.10±0.10 36.92±2.41 104.72±4.56 11.52±2.48 11.56±0.36模型组 6 4.56±0.41a 84.16±3.23a 246.02±12.61a 93.62±11.56a 15.66±0.27a阳性组 6 3.58±0.11bc 54.86±1.91bc 170.38±13.67bc 50.20±2.11bc 14.16±0.35bc赤芍组 7 2.74±0.32bc 49.02±4.90bc 157.10±6.00bc 41.42±5.65bc 13.68±0.76bc附片组 7 2.82±0.42bc 42.52±3.96bc 156.68±9.08bc 43.94±7.10bc 13.22±0.23bc赤芍-附片组 7 1.42±0.14b 31.94±2.18b 108.08±6.99b 22.68±3.61b 11.84±0.33b F 20.715 32.574 29.733 20.118 13.107 P 0.000 0.000 0.000 0.000 0.000
2.3 各组大鼠肝组织IL-1β、IL-6、TNF-α水平比较 模型组大鼠肝组织IL-1β、IL-6、TNF-α水平高于空白组(P<0.05);阳性组、赤芍组、附片组、赤芍-附片组大鼠肝组织IL-1β、IL-6、TNF-α水平均低于模型组(P<0.05),且赤芍-附片组大鼠肝组织IL-1β、IL-6、TNF-α水平低于阳性组、赤芍组、附片组(P<0.05)。(见表3)
表3 各组大鼠肝组织IL-1β、IL-6、TNF-α 水平比较(±s,μg/mL)
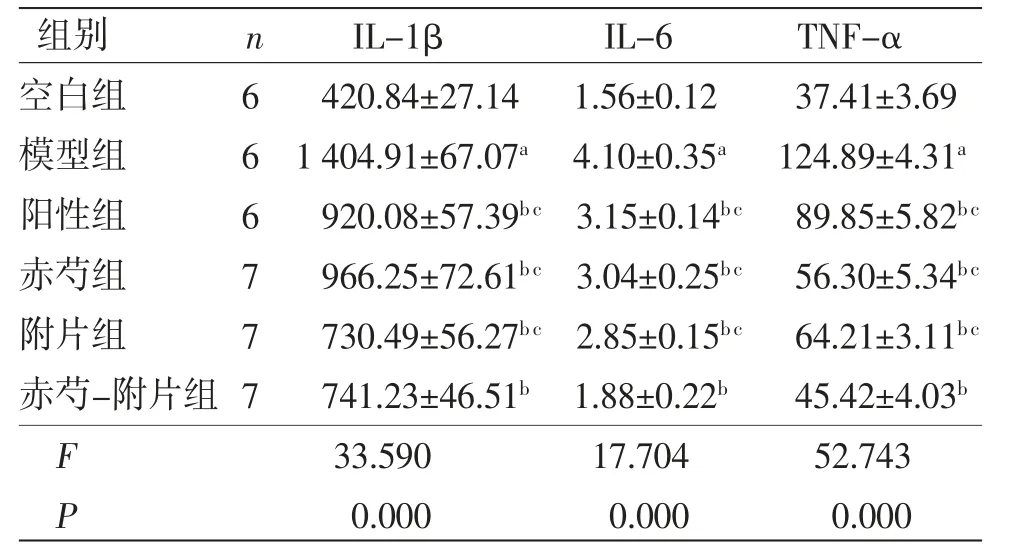
表3 各组大鼠肝组织IL-1β、IL-6、TNF-α 水平比较(±s,μg/mL)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与赤芍-附片组比较,cP<0.05。
组别 n IL-1β IL-6 TNF-α空白组 6 420.84±27.14 1.56±0.12 37.41±3.69模型组 6 1 404.91±67.07a 4.10±0.35a 124.89±4.31a阳性组 6 920.08±57.39bc 3.15±0.14bc 89.85±5.82bc赤芍组 7 966.25±72.61bc 3.04±0.25bc 56.30±5.34bc附片组 7 730.49±56.27bc 2.85±0.15bc 64.21±3.11bc赤芍-附片组7 741.23±46.51b 1.88±0.22b 45.42±4.03b F 33.590 17.704 52.743 P 0.000 0.000 0.000
2.4 各组大鼠肝组织PI3K、p-PI3K、AKT、p-AKT(Ser473)蛋白相对表达量比较 模型组大鼠肝组织p-PI3K、p-AKT蛋白相对表达量低于空白组(P<0.05);阳性组、赤芍组、附片组、赤芍-附片组大鼠肝组织p-PI3K、p-AKT蛋白相对表达量均高于模型组(P<0.05),且赤芍-附片组大鼠肝组织p-PI3K、p-AKT蛋白相对表达量高于阳性组、赤芍组、附片组(P<0.05)。(见图4、表4)
表4 各组大鼠肝脏组织PI3K、p-PI3K、AKT、p-AKT(Ser473)蛋白相对表达量比较 (±s)
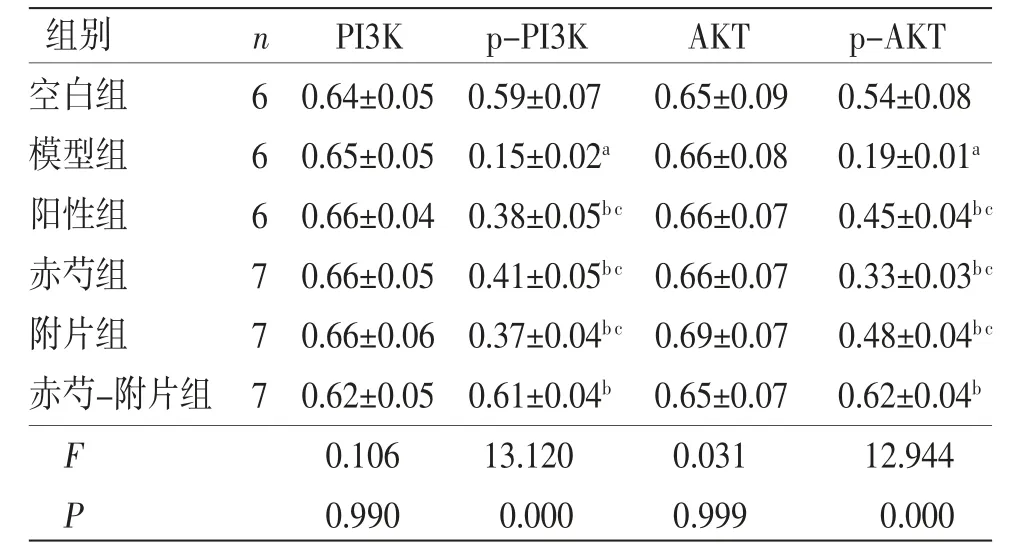
表4 各组大鼠肝脏组织PI3K、p-PI3K、AKT、p-AKT(Ser473)蛋白相对表达量比较 (±s)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与赤芍-附片组比较,cP<0.05。
组别 n PI3K p-PI3K AKT p-AKT空白组 6 0.64±0.05 0.59±0.07 0.65±0.09 0.54±0.08模型组 6 0.65±0.05 0.15±0.02a 0.66±0.08 0.19±0.01a阳性组 6 0.66±0.04 0.38±0.05b c 0.66±0.07 0.45±0.04b c赤芍组 7 0.66±0.05 0.41±0.05b c 0.66±0.07 0.33±0.03b c附片组 7 0.66±0.06 0.37±0.04b c 0.69±0.07 0.48±0.04b c赤芍-附片组 7 0.62±0.05 0.61±0.04b 0.65±0.07 0.62±0.04b F 0.106 13.120 0.031 12.944 P 0.990 0.000 0.999 0.000
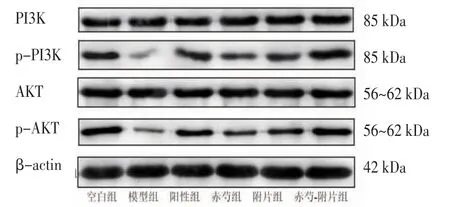
图4 各组大鼠肝组织PI3K、p-PI3K、AKT、p-AKT 蛋白表达Western blotting 图
2.5 各组大鼠肝组织PI3K mRNA、AKT mRNA相对表达量比较 模型组大鼠肝组织PI3K mRNA、AKT mRNA相对表达量低于空白组(P<0.05);阳性组、赤芍组、附片组、赤芍-附片组大鼠肝组织PI3K mRNA、AKT mRNA相对表达量高于模型组(P<0.05),且赤芍-附片组大鼠肝组织PI3K mRNA、AKT mRNA相对表达量高于阳性组、赤芍组、附片组(P<0.05)。(见表5)
表5 各组大鼠肝脏组织PI3K mRNA、AKT mRNA相对表达量 (±s)
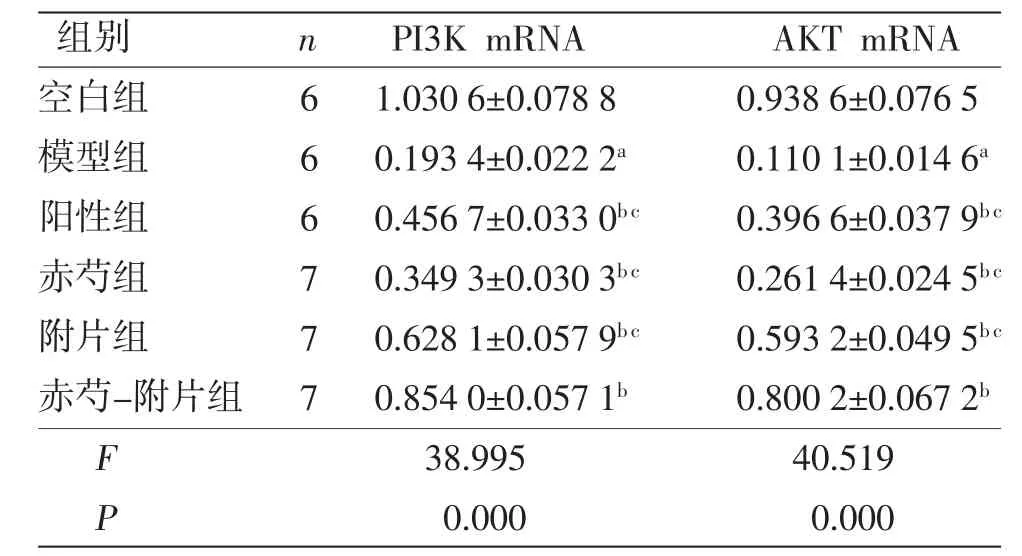
表5 各组大鼠肝脏组织PI3K mRNA、AKT mRNA相对表达量 (±s)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与赤芍-附片组比较,cP<0.05。
组别 n PI3K mRNA AKT mRNA空白组 6 1.030 6±0.078 8 0.938 6±0.076 5模型组 6 0.193 4±0.022 2a 0.110 1±0.014 6a阳性组 6 0.456 7±0.033 0b c 0.396 6±0.037 9b c赤芍组 7 0.349 3±0.030 3b c 0.261 4±0.024 5b c附片组 7 0.628 1±0.057 9b c 0.593 2±0.049 5b c赤芍-附片组 7 0.854 0±0.057 1b 0.800 2±0.067 2b F 38.995 40.519 P 0.000 0.000
3 讨 论
炎症和氧化应激是导致肝纤维化、肝细胞坏死、凋亡的重要因素[9-10]。为了维持内环境的稳定,肝脏固有免疫细胞(巨噬细胞/Kupffer细胞、自然杀伤细胞等)可吞噬、杀伤病原体,释放大量细胞因子,如IL-6、IL-10等,促进炎症因子风暴形成,加重肝衰竭。肝脏代偿性免疫抑制及免疫功能紊乱导致患者全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),使脓毒症的风险也随之上升。过度的免疫炎症反应会对组织造成严重病理损伤,引起肝脏组织严重坏死并导致肝外器官衰竭,同时也增加了感染的易感性[11]。因此,控制炎症反应在肝衰竭的治疗过程中尤为关键。目前中医药在治疗肝衰竭方面逐渐显露出其优势[12-13]。
慢加急性肝衰竭属于中医“急黄”“瘟黄”“肝瘟”范畴,其致病因素包括外感时邪疫毒、嗜酒过度、药物毒物、饮食所伤等。《诸病源候论·黄疸诸候·急黄候》记载:“谷气郁蒸,因为热毒所加,故卒然发黄……命在顷刻,故云急黄也。”随着临床经验的积累,历代医家逐渐加深了对急黄(瘟黄)的认识,中医大致将其基本病机总结为湿、热、瘀、毒、虚。课题组前期通过观察肝衰竭患者不同黄疸证型的临床特点,总结出了“阳黄-阴阳黄-阴黄”中医辨证论治体系,同时发现肝衰竭患者多是虚实夹杂,且疾病的发生发展过程中均存在湿热、瘀毒、脾虚。湿热瘀毒为标,脾虚为本。三者相互交织,发为肝瘟。赤芍-附片是治疗肝衰竭“清温并用”法的核心药对,临床疗效确切。赤芍味苦,性微寒,归肝经,具有清热凉血、祛瘀止痛的功效。现代药理学研究表明,赤芍可以降低炎症因子水平,减轻炎症反应,具有保肝作用[14-15]。附子,味辛,性大热,上能助心阳,下可温脾肾,主要有回阳救逆、补火助阳、散寒止痛功效。现代药理学研究表明,附子具有抗炎、镇痛、强心、抗肿瘤等药理作用,能降低促炎因子的产生与释放[16]。但二者是否存在协同增效效应尚不清楚。
本研究结果表明,ACLF模型大鼠肝功能、凝血功能明显下降,肝脏组织形态破坏,促炎因子IL-6、IL-1β、TNF-α水平升高,证实ACLF中存在明显的炎症反应。研究显示TNF-α、IL-1β、IL-6是D-Gal/LPS诱导大鼠肝衰竭模型肝损伤的主要介质[17],与本研究结果一致。本研究结果表明,在乳果糖、赤芍、附片、赤芍-附片药对干预后,ACLF大鼠TBIL、ALT、AST、TBA和PT水平均较模型组改善,说明乳果糖、赤芍、附片、赤芍-附片药均可改善肝功能、凝血功能,减轻肝脏组织坏死及炎症细胞浸润等病变,亦可降低ACLF大鼠IL-1β、IL-6、TNF-α水平,抑制炎症反应。赤芍-附片组肝功能、凝血、炎症指标的整体改善比赤芍组、附片组更为显著,说明两者配伍的效果优于单用,可能与附片能提高赤芍的主要效应成分芍药苷的生物利用度有关[18]。
PI3K是一种细胞内磷脂酰肌醇激酶,具有磷脂酰肌醇激酶和丝氨酸/苏氨酸(Ser/Thr)激酶活性。PI3K是由一个催化亚基和一个调节亚基构成的异二聚体。其中调节亚基以p85异构体为主,主要包括SH2和SH3结构域,能与靶蛋白相结合,被受体酪氨酸激酶(TK)激活。AKT是一种丝/苏氨酸激酶。因为与蛋白激酶A和蛋白激酶C具有高度的同源性,AKT又被称为蛋白激酶B,亦称为PKB或Rac,是PI3K通路中重要的中介因子[19]。AKT在多种细胞中广泛表达。PI3K/AKT信号通路是一个依靠磷酸化传导信号的通路,能够多级调控、级联放大,具有交通枢纽的地位。该信号通路被激活后,可继续通过激活下游的多种靶点蛋白,参与细胞的增殖、凋亡、活化、分化、恶变等一系列细胞活动及调控蛋白合成、能量代谢、血管生成等重要的生理过程[20],从而在各类疾病中起着重要调控作用。PI3K/AKT信号通路作为调节炎症因子分泌的关键通路,在肝衰竭病理机制中具有重要意义,能传导汇聚多种细胞外和细胞内信号,通过对下游效应因子的激活,调节促炎和抗炎细胞因子的产生。本研究结果也证实了这一点。本研究结果表明,模型组大鼠肝组织p-PI3K、p-AKT蛋白表达及PI3K mRNA、AKTmRNA表达均下降,说明PI3K/AKT信号通路参与了ACLF发生发展过程。阳性组、赤芍组、附片组、赤芍-附片组大鼠肝组织p-PI3K、p-AKT蛋白表达及PI3K mRNA、AKTmRNA表达均上升,说明乳果糖、赤芍、附片、赤芍-附片药对均能激活PI3K/AKT信号通路,降低促炎因子水平。WANG H等[21]发现调节PI3K/Akt/STAT3信号通路能降低炎症因子的表达进而改善肝损伤,与本研究结果一致。SUN X J等[22]证实调节PI3K/Akt-Nrf2通路能改善全身炎症反应。WANG Y P等[23]研究表明,利用骨髓细胞2激活PI3K/AKT/FoxO3a信号通路可下调IL-5、TNF-α和IL-5β炎症因子的表达。DONG L L等[24]研究表明PI3K/Akt/mTOR信号通路能抑制促炎性细胞因子(TNF-α、IL-6和IL-1β)的产生。另有研究[25]表明,在激活PI3K/AKT/FOXO1信号通路后,脂毒性诱导的炎症反应得到明显缓解。HEMAVATHY H等[26]发现干预PI3K/AKT信号传导通路能抑制IL-1β、TNF-α的释放,从而抑制炎症反应。此外,本研究结果表明,赤芍组、附片组PI3K mRNA、AKT mRNA表达水平与PI3K、AKT蛋白表达水平不完全一致,可能是受翻译速率、mRNA半衰期、蛋白折叠等多因素影响所致[27]。与模型组、赤芍组、附片组比较,赤芍-附片药对组的p-PI3K、p-AKT蛋白表达水平及PI3K mRNA、AKT mRNA表达水平上升最显著,进一步说明了PI3K/AKT信号通路是参与肝衰竭持续性炎症反应的重要通路。
综上所述,赤芍-附片药对可以改善ACLF大鼠的免疫炎症反应,其对ACLF大鼠肝脏的保护作用可能与激活PI3K/AKT信号通路,下调炎症因子的表达,从而减少炎症因子的产生有关。然而,赤芍-附片药对是否可以通过其他信号通路对ACLF产生影响有待进一步探究。

