一株临沧覆土栽培盖囊菇高温品种可控环境因子优化研究
洪 鹏,和 敏,周会明,张焱珍,卯明娟,王 瑞,马凯云,邓 云
滇西科技师范学院生物技术与工程学院,云南临沧 677000
盖囊菇(Pleurotus cystidiosusO.K. Mill.)又名盖囊侧耳、泡囊侧耳,是侧耳科、侧耳属真菌,多分布于中国台湾、云南、浙江等地,是一种高温木腐菌,其肉质肥嫩可口,菌柄粗壮,含有多种氨基酸和维生素,除包括人体必需的8种氨基酸外,还含有维生素B1、维生素B2、烟酸等[1],颇受消费者喜爱。因此,盖囊菇具有重要的经济价值,对该菇进行驯化研究对其开发利用意义较大。关于盖囊菇的相关文献报道较少,主要研究在种质资源驯化栽培[2-4]、活性化学成分开发[5]、原生质体融合[6]、系统发育分析[7-8]、生物活性[9-12]等方面,与其他市场常见人工栽培食用菌相比,该菇具有地域性强、栽培技术不完善以及生长环境特殊等特点,导致其大规模推广滞后且受到严重的阻碍,培育地域性品种成为该菇商品化的发展趋势。
生理特性的研究是大型真菌驯化栽培的前提,本研究以一株采集于云南省临沧市的覆土栽培盖囊菇高温品种为材料,从该菇的可控环境条件入手,基于单因素试验的基础上采用正交优化试验的方法研究不同温度、琼脂浓度、酸碱度、氧气、光照等因素对盖囊菇菌丝体生长及孢梗束形成的影响,为后续该菇在本市及其它地域的覆土栽培品种林下推广提供一定理论依据。
1 材料与方法
1.1 材料
1.1.1 供试菌株 覆土栽培盖囊菇高温品种菌株由滇西科技师范学院食用菌课题组提供。
1.1.2 PSA培养基 马铃薯20%,蔗糖2%,琼脂1.5%,水1 L,pH自然。
1.2 方法
1.2.1 菌株活化与接菌 将盖囊菇菌丝试管从冰箱中取出放入室温中培养7 d左右,然后转接至活化培养基中(菌块直径为5 mm[13],下同),在25 ℃下培养。待长满后转接至PSA平板培养基中,25 ℃下培养观察并记录。
1.2.2 生物学特性 (1)温度试验。以PSA为基础培养基,第一次先设置0、5、10、15、20、25、30、35、40 ℃的温度梯度进行试验,并测定培养基灭菌前后的pH。在第一次温度梯度的基础上缩小温度梯度进行第二次试验,设置19、21、23、25、27、29 ℃的温度梯度。2次试验中每个温度梯度均设置4个重复,培养皿型号为70 mm。接菌后,记录菌丝萌发时间(d)、孢梗束形成时间(d)以及培养时间(d),待菌丝长至培养皿总面积约2/3时,采用十字交叉法测量菌落直径,计算生长速度(mm/d)[14],记录菌落颜色、菌落生长势(“+++”表示浓密健壮,“++”表示较浓密,“+”表示生长“-”表示不生长)[15-16]、孢梗束形成数量(个)、下同。
(2)琼脂浓度试验。以PSA为基础培养基,通过控制琼脂浓度来控制含水量,设置0.2%、0.5%、1.0%、1.5%、2.0%、2.5%、3.0%的琼脂浓度梯度进行试验,每个梯度设置4个重复,在最适温度下培养。
(3)酸碱度试验。以最适琼脂浓度PSA为基础培养基,设置pH为4.00、4.50、5.00、5.20、5.40、5.60、5.80、6.00、6.20、6.40、6.60、6.80、7.00、7.50、8.00、8.50、9.00、9.50、10.00的梯度进行试验[17]。用0.1%氢氧化钠溶液和0.1%氯化氢溶液调节培养基的pH,每个梯度设置4个重复,在最适培养温度下培养。
(4)氧气试验。以最适琼脂浓度、酸碱度的PSA为基础培养基,通过控制培养皿的直径来控制含氧量。试验中共设置培养基型号为60、70、90、100 mm的4个梯度,每个梯度设置4个重复,在最适温度和光照下培养。
(5)光照试验。以最适琼脂浓度和酸碱度PSA作为基础培养基,设置24 h光照、12 h光照、24 h黑暗的梯度进行试验[18],使用功率为5 w的白色灯管在37 cm×50 cm×15 cm的空间内进行照射,且照射距离为15 cm;每个梯度设置4个重复,在最适温度下培养。
1.2.3 正交优化试验 根据盖囊菇菌丝的温度、琼脂浓度、酸碱度、氧气、光照单因素试验结果,设置L16(45)以菌丝体生长速度为指标的正交试验因素与水平(表1),以孢梗束形成数量为指标的正交试验因素与水平(表2)。
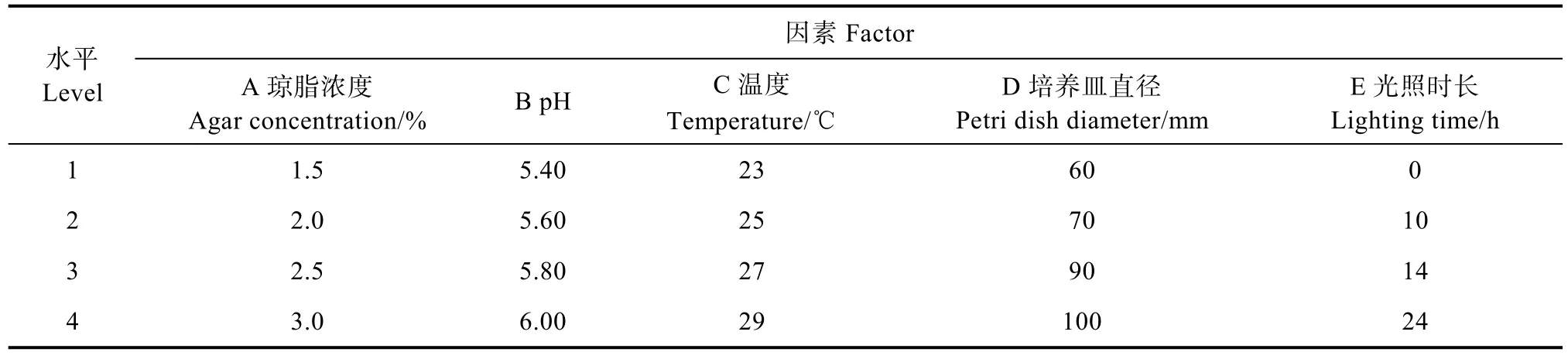
表1 正交试验因素与水平(菌丝体)Tab. 1 Orthogonal test factor and level (mycelium)
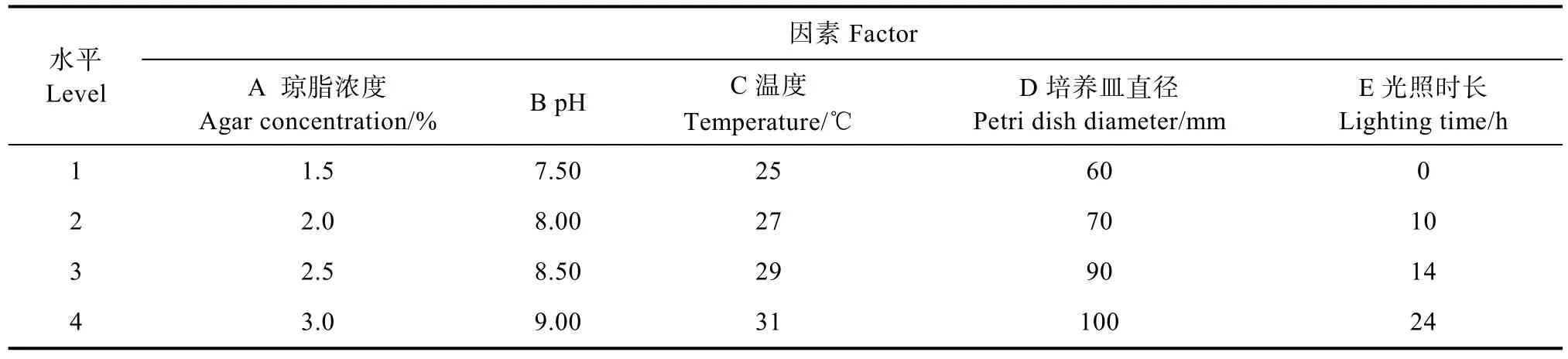
表2 正交试验因素与水平(孢梗束)Tab. 2 Orthogonal test factor and level (coremium)
1.3 数据处理
所有数据采用十字交叉法进行测量,所得结果均为3次重复,采用SPSS 19.0统计软件Duncan’s法进行数据统计分析[19]。
2 结果与分析
2.1 温度对盖囊菇菌丝体生长与孢梗束形成的影响
2.1.1 5 ℃温度梯度试验 由表3可知,盖囊菇在10~30 ℃下菌丝均能生长且颜色均为白色(图1)。在温度范围10~25 ℃,其菌丝生长速度随温度的升高而加快,25 ℃时,盖囊菇的菌丝生长速度最快,为(3.84±0.15)mm/d,且菌丝长势最好,与其他温度处理相比在0.05和0.01水平上有极显著差异。其次是20 ℃和30 ℃温度处理,而30 ℃时菌丝长势比20 ℃浓密(图1)。盖囊菇孢梗束在15~30 ℃内均能形成,在温度范围15~25 ℃,其孢梗束形成数量随温度的升高而增多,25 ℃时,形成数量最多,为(39.50±2.38)个/皿,且与其他温度处理相比在0.05和0.01水平上有极显著差异。
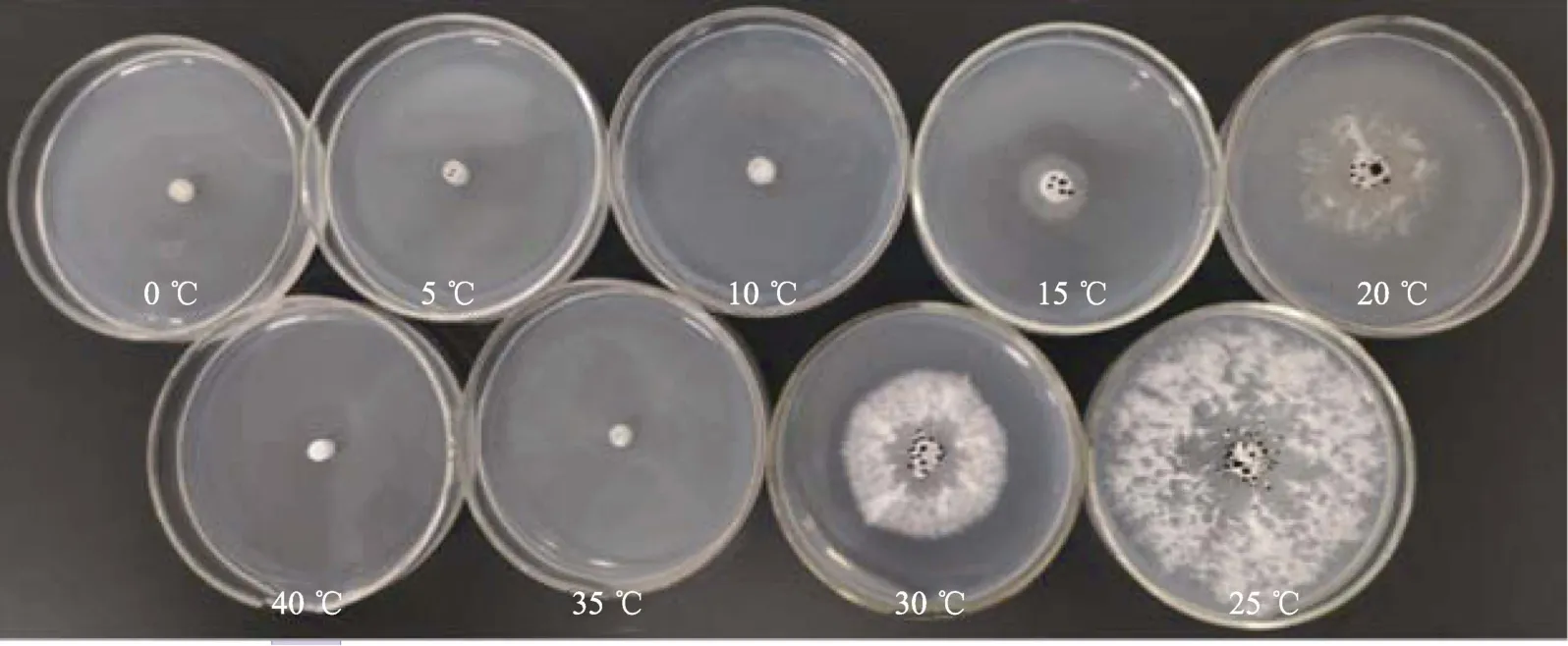
图1 5 ℃温度梯度下盖囊菇菌株在PSA平板中的培养情况Fig. 1 Cultivation of P. cystidiosus strains in PSA plate under 5 ℃ temperature gradient
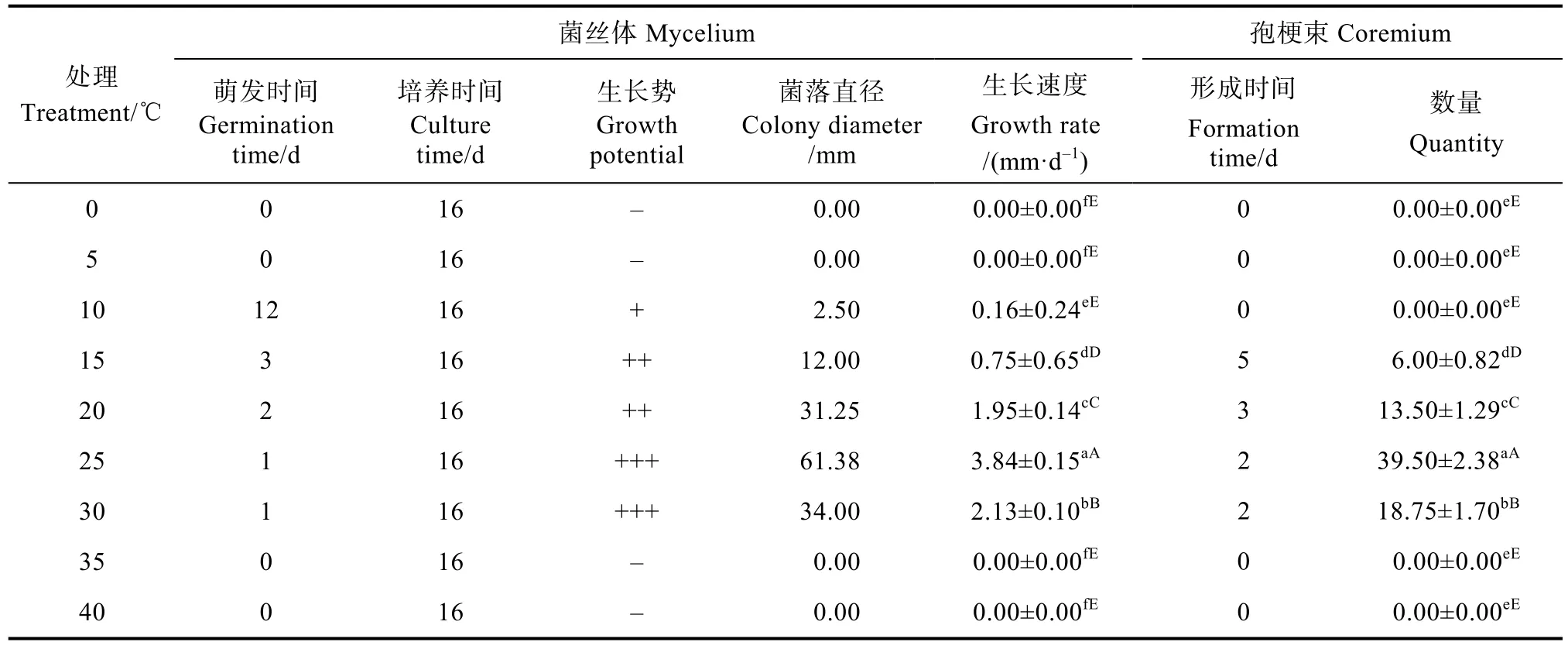
表3 5 ℃温度梯度下菌丝体生长与孢梗束形成Tab. 3 Mycelium development and coremium formation under 5 ℃ temperature gradient
2.1.2 2 ℃温度梯度试验 由表4可知,当温度在25 ℃时,盖囊菇的生长速度最快,为(3.25± 0.36)mm/d,在25 ℃和27 ℃的菌落直径和菌丝生长速度与其他温度处理相比在0.05和0.01水平上有极显著差异。盖囊菇孢梗束在27 ℃时,形成数量最多(图2),为(11.75±2.08)个/皿,且与其他温度处理相比在0.05水平上有显著差异。

图2 2 ℃温度梯度下盖囊菇菌株在PSA平板中的培养情况Fig. 2 Cultivation of P. cystidiosus strains in PSA plate under 2 ℃ temperature gradient
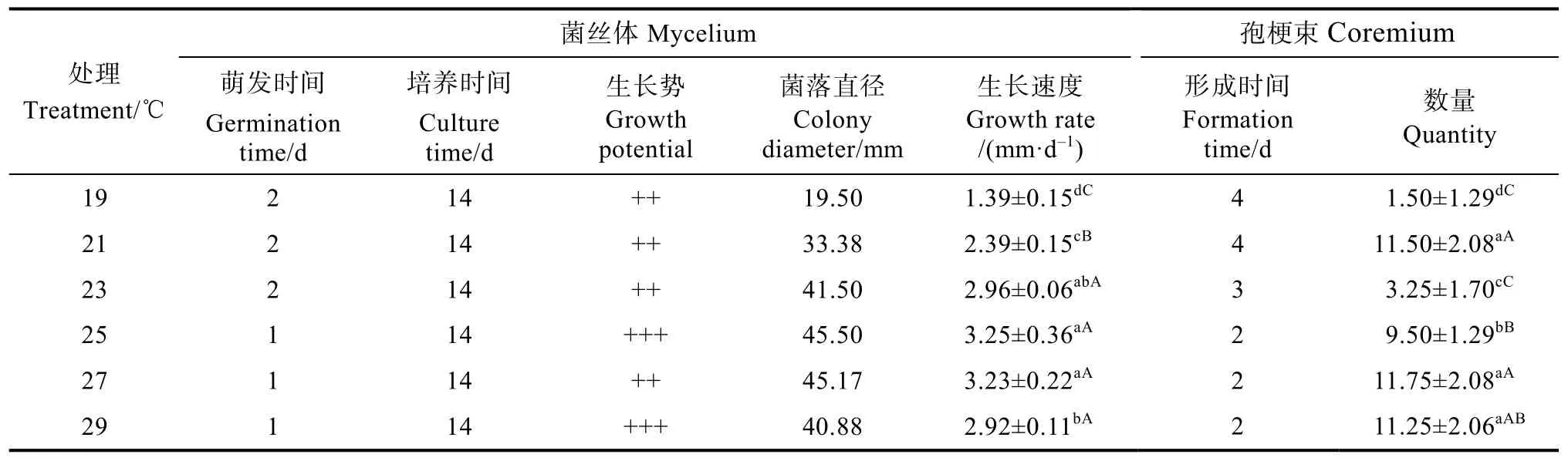
表4 2 ℃温度梯度下菌丝体生长与孢梗束形成Tab. 4 Mycelium development and coremium formation under 2 ℃ temperature gradient
2.2 琼脂浓度对盖囊菇菌丝体生长与孢梗束形成的影响
由表5可知,盖囊菇菌丝体在琼脂浓度为0.5%~3.0%的范围内均能生长,在该范围内琼脂浓度与菌丝生长速度成正比,在3.0%时菌丝生长速度最快,为(2.96±0.16)mm/d,相比于其他琼脂浓度有极显著的差异,且菌丝健状浓密(图3);其孢梗束在0.5%~3.0%内均能形成,在2.0%时,孢梗束数量最多,为(29.75±0.96)个/皿,与其他处理相比在0.05和0.01水平上有极显著差异。

图3 不同琼脂浓度下盖囊菇菌株在PSA平板中的培养情况Fig. 3 Cultivation of P. cystidiosus strains in PSA plate under different agar concentration
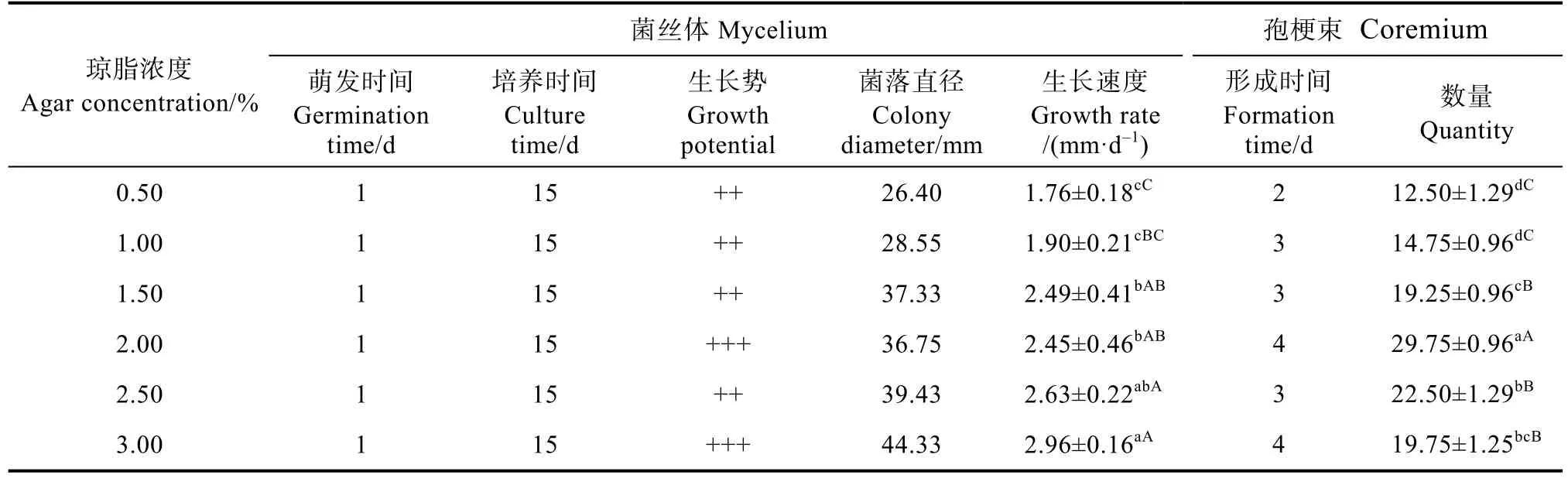
表5 不同琼脂浓度下菌丝体生长与孢梗束形成Tab. 5 Mycelium development and coremium formation under different agar concentration
2.3 酸碱度对盖囊菇菌丝体生长与孢梗束形成的影响
由表6可知,盖囊菇在pH为4.00~10.00下菌丝均能生长,在4.00~6.00范围内,其菌丝生长速度随pH的增加而增加,当pH增加到5.40时,菌丝生长速度趋于平缓,当pH大于7.00时,菌丝生长速度开始下降。在pH为5.80时菌丝生长速度最快,为(3.50±0.16)mm/d,pH为5.80在0.05和0.01水平上相较于其他pH有显著差异;其孢梗束在pH范围为4.00~10.00均能形成,在pH为8.0时,孢梗束数量最大(图4),为(20.75±1.71)个/皿,与其他处理相比在0.05和0.01水平上相较于其他pH有极显著差异。
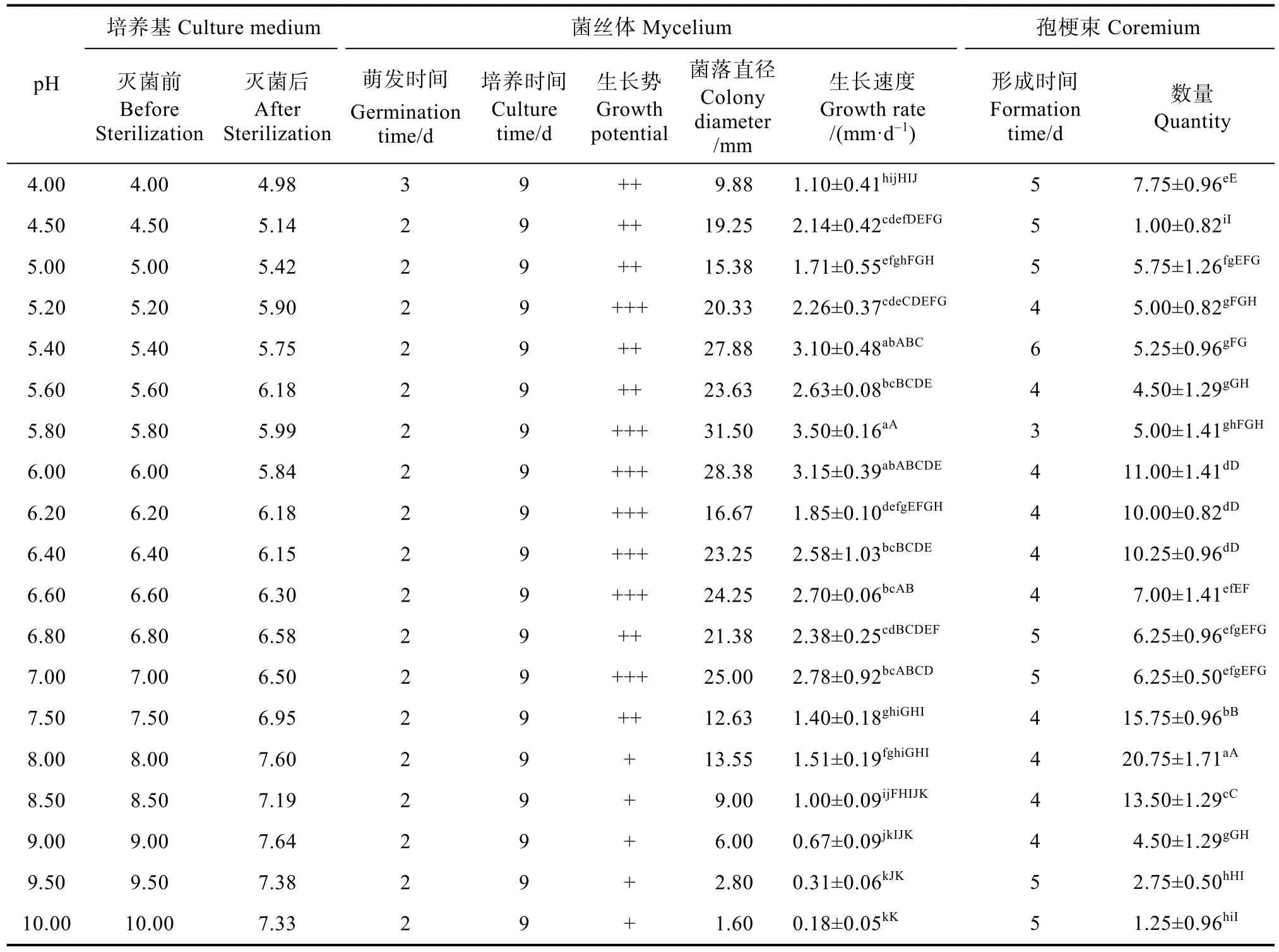
表6 不同pH下菌丝体生长与孢梗束形成Tab. 6 Mycelium development and coremium formation under different pH
2.4 氧气对盖囊菇菌丝体生长与孢梗束形成的影响
由表7可知,盖囊菇在培养皿直径为60~100 mm内,其菌丝体均能生长且孢梗束均能形成(图5)。当培养皿规格为100 mm时,菌丝生长速度最快,孢梗束数量最多,分别达到(3.31±0.40)mm/d、(24.50±2.08)个/皿,与其他处理相比在0.05水平上均有显著差异,且菌丝健状浓密。

图5 不同含氧量下盖囊菇菌株在PSA平板中的培养情况Fig. 5 Cultivation of P. cystidiosus strains in PSA plate under different oxygen content
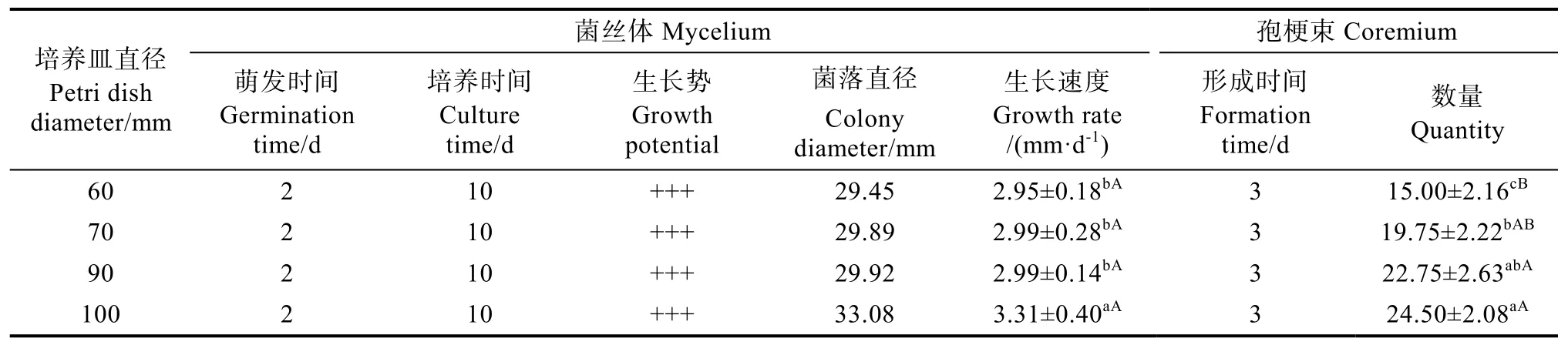
表7 不同含氧量下菌丝体生长与孢梗束形成Tab. 7 Mycelium development and coremium formation under different oxygen content
2.5 光照对盖囊菇菌丝体生长与孢梗束形成的影响
由表8可知,盖囊菇在光照时间为0~24 h内菌丝均能生长,其菌丝生长速度随光照时长的增加而减小,当光照时长为0 h连续黑暗时,盖囊菇的菌丝生长速度最快,为(2.79±0.15)mm/d,与其他光照处理相比在0.05和0.01水平上有极显著差异,且菌丝健壮浓密(图6);盖囊菇孢梗束在0~24 h内均能形成,其孢梗束数量随光照时长的增加而增加,在24 h连续光照时,形成数量最多,为(19.67±1.15)个/皿,且与其他光照处理相比在0.05和0.01水平上有极显著差异,但菌丝较稀疏。

图6 不同光照时间下盖囊菇菌株在PSA平板中的培养情况Fig. 6 Cultivation of P. cystidiosus strains in PSA plate under different light duration
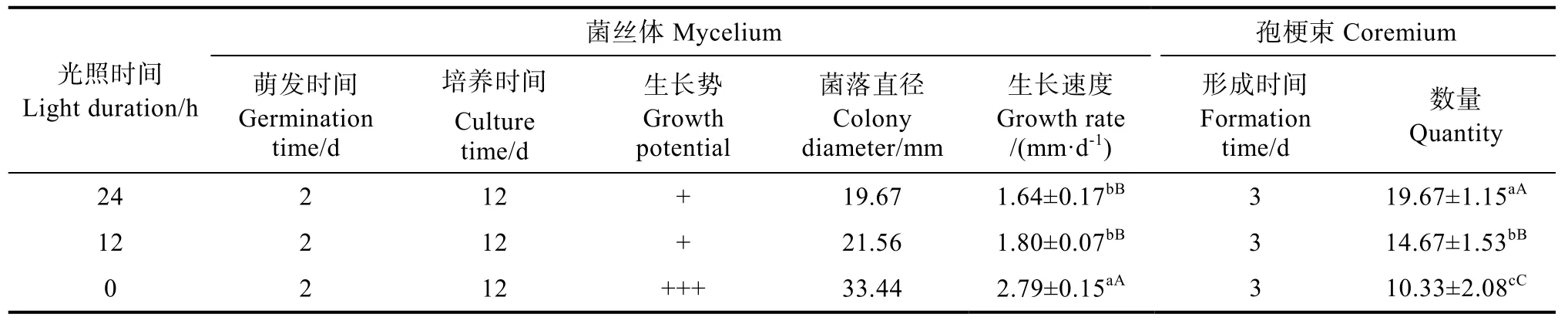
表8 不同光照时间下菌丝体生长与孢梗束形成Tab. 8 Mycelium development and coremium formation under different light duration
2.6 正交试验结果
2.6.1 以菌丝体生长速度为指标的正交试验 (1)正交组合对菌丝体生长与孢梗束形成的影响。由表9可知,盖囊菇在所有的正交组合上菌丝均能生长,在正交组合15上,盖囊菇的菌丝生长速度最快,为(3.56±0.62)mm/d(表10),与其他处理相比在0.05和0.01水平上有极显著差异,且菌丝健壮浓密(图7)。盖囊菇孢梗束在所有的正交组合上均能形成,在正交组合5上,形成数量最多,为(21.50±2.08)个/皿(表9),与其他处理相比在0.05和0.01水平上有极显著差异。

图7 不同正交组合下盖囊菇菌株在PSA平板中的菌丝体生长情况Fig. 7 Mycelium growth of P. cystidiosus strains in PSA plate under different orthogonal combinations
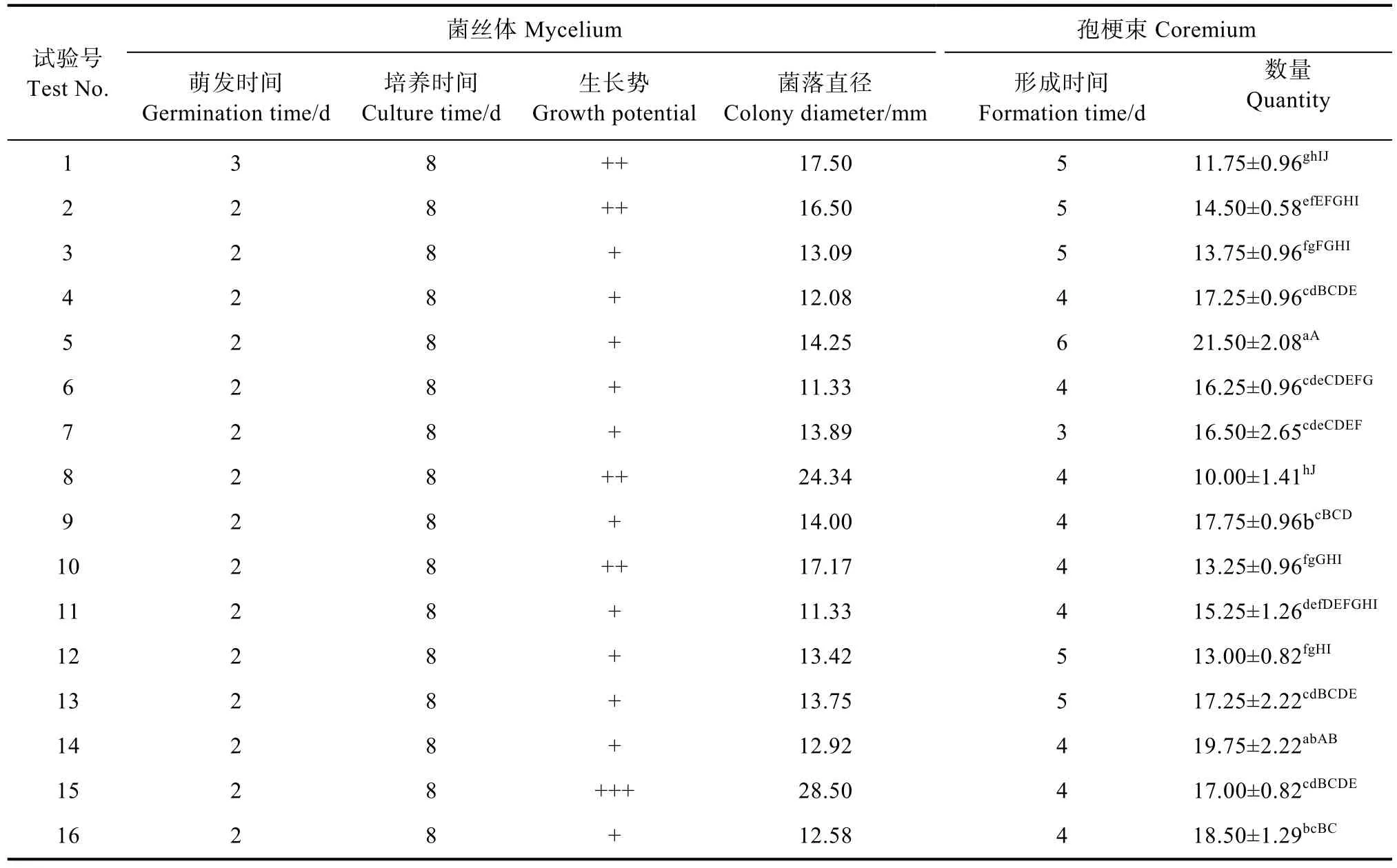
表9 正交组合下菌丝体生长与孢梗束形成Tab. 9 Mycelium development and coremium formation under orthogonal combinations
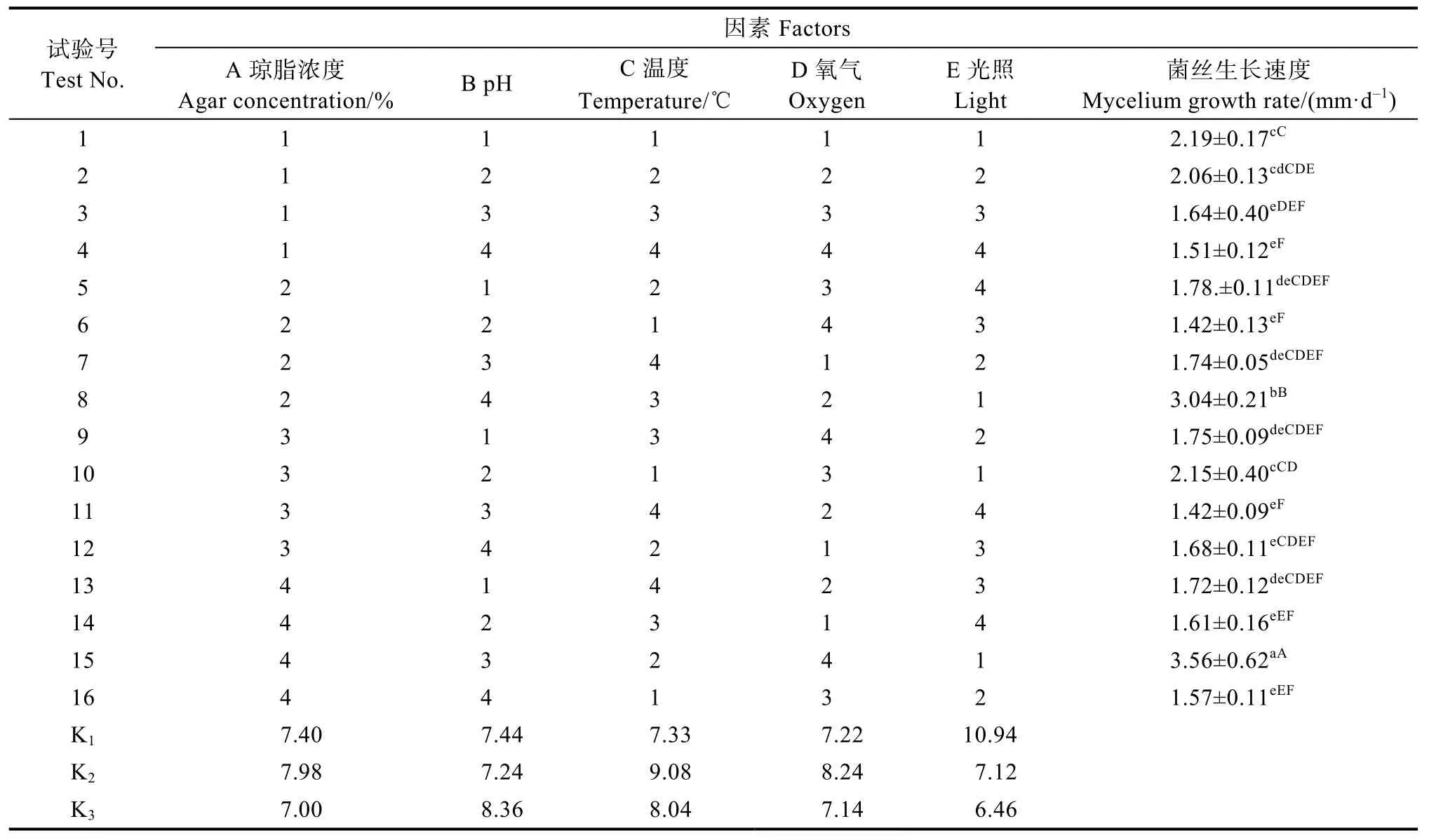
表10 以菌丝体生长速度为指标的极差分析Tab. 10 Range analysis table with mycelium growth rate as index
(2)极差分析与验证试验。由表10极差R值可知,温度、琼脂浓度、酸碱度、氧气、光照5个因素对盖囊菇菌丝生长速度的影响顺序为:光照>温度>琼脂浓度>酸碱度>氧气,极差分析(A4B3C2D4E1,A4B3C2D2E1)与显著性分析(A4B3C2D4E1)最优组合结果不一致。经验证试验,该菌在组合A4B3C2D4E1培养基上其菌丝生长速度最大,达到(4.14±0.51)mm/d,其余参数结果均相同。因此,最优组合为A4B3C2D4E1,即琼脂浓度为3.0%、pH为5.80、温度为25 ℃、培养皿大小为100 mm、光照时长为0 h。
2.6.2 以孢梗束形成数量为指标的正交试验 (1)正交组合对孢梗束形成数量的影响。由表11可知,盖囊菇在琼脂浓度为1.5%~3.0%、pH为7.50~9.00、温度为25~31 ℃、培养皿大小为60~100 mm、光照时长为0~24 h时菌丝均能生长,当为3.0%、pH为8.50、24 h黑暗、培养皿大小为100 mm时,盖囊菇的菌丝生长速度最快,为(3.65±0.52)mm/d,与其他处理相比在0.05和0.01水平上有极显著差异,且菌丝健壮浓密(图8)。盖囊菇孢梗束在琼脂浓度为1.5%~3.0%、pH为7.50~9.00、温度为25~31 ℃、培养皿大小为60~100 mm、光照时长为0~24 h内均能形成,在琼脂浓度为2.0%、pH为5.4、温度为25 ℃、24 h光照、培养皿大小为90 mm时,形成数量最多,为(48.75±8.18)个/皿(表12),与其他处理相比在0.05和0.01水平上有极显著差异。

图8 不同正交组合下盖囊菇菌株在PSA平板中的培养情况Fig. 8 Cultivation of P. cystidiosus strains in PSA plate under different orthogonal combinations
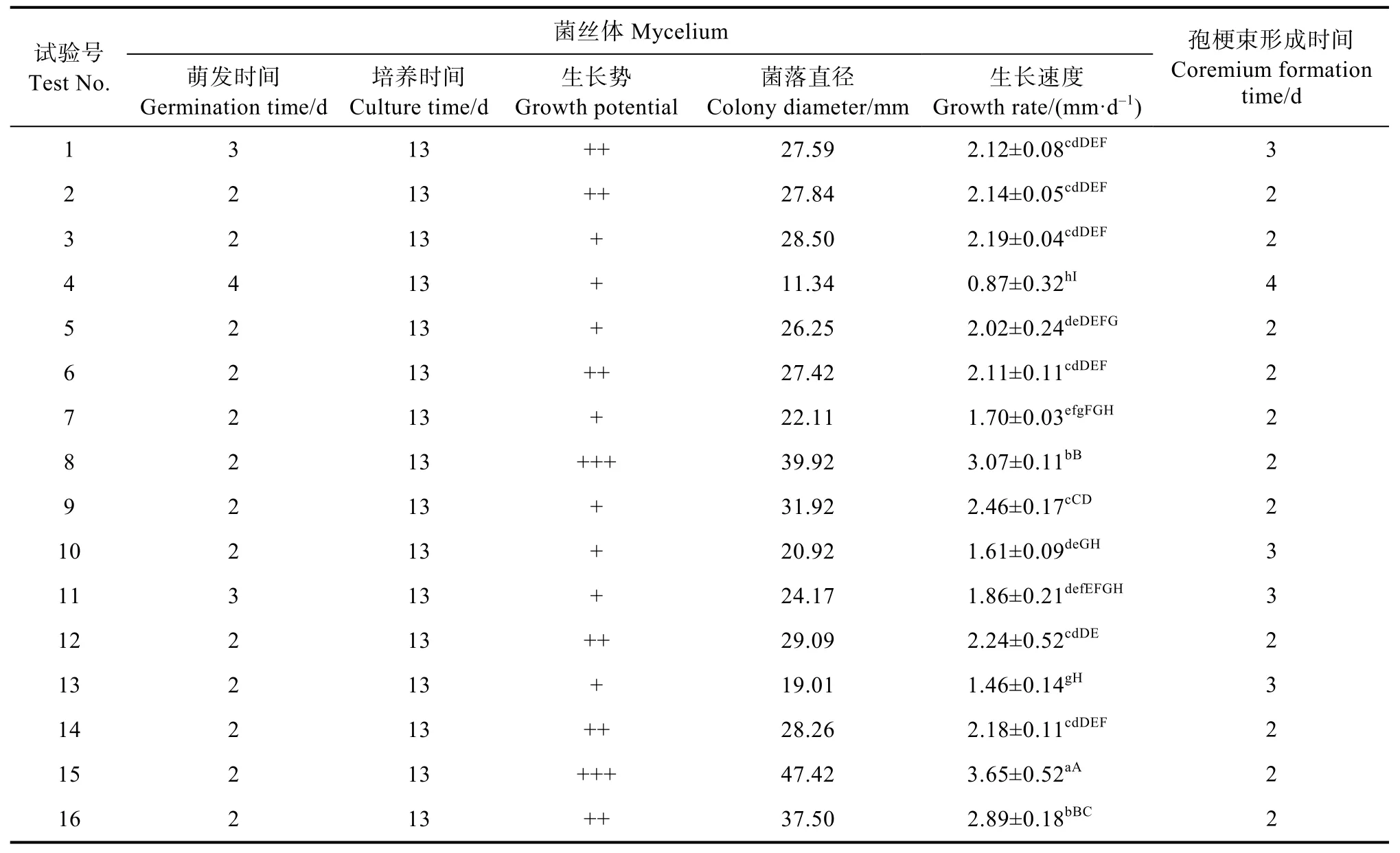
表11 正交组合下菌丝体生长与孢梗束形成Tab. 11 Mycelium development and coremium formation under orthogonal combinations
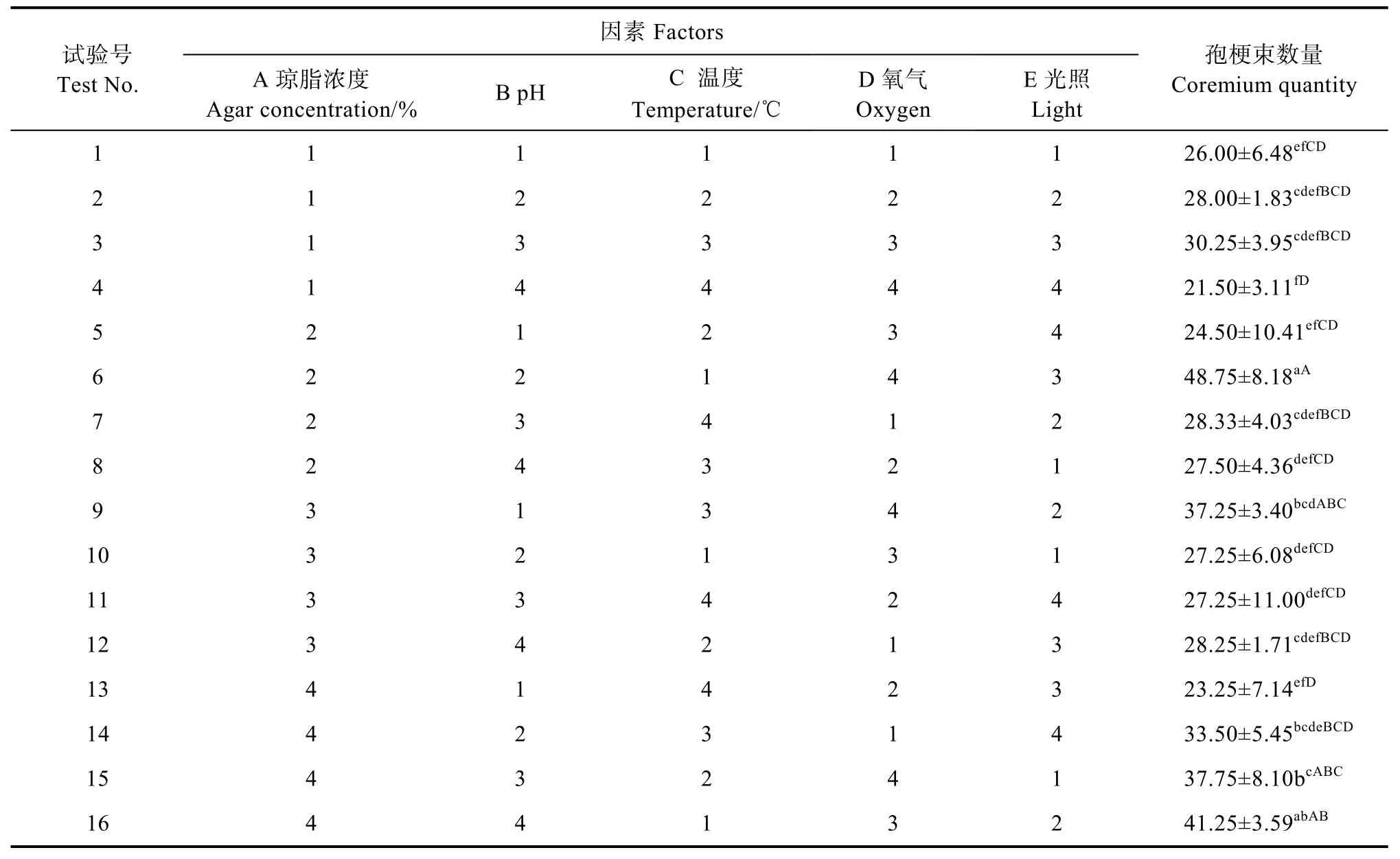
表12 以孢梗束形成数量为指标的极差分析Tab. 12 Range analysis table with number of coremium formation as index
(2)极差分析与验证试验。由表12极差分析可知,温度、琼脂浓度、酸碱度、氧气、光照5个因素对盖囊菇孢梗束形成的影响顺序为:温度>氧气>琼脂浓度>光照>酸碱度,极差分析(A4B2C1D4E2)与显著性分析最优组合6(A2B2C1D4E3)不同,经进一步验证试验,该菌在组合A4B2C1D4E2培养基上孢梗束形成数量最大,达到(49.00±3.46)个/皿,但在组合A2B2C1D4E3上其生长速度最大[(3.26±0.45)mm/d],其余参数结果均相同。因此,最优组合为A4B2C1D4E2,即琼脂浓度2.0%、pH为8.00、温度25 ℃、培养皿直径为100 mm、光照时长为14 h。
3 讨论
本试验用平板固体培养的方式,采用单因素和正交优化试验来探究5种可控环境因子对一株临沧覆土栽培盖囊菇高温品种菌丝体生长和发育及原基分化的影响。
结果显示,盖囊菇菌丝体生长与孢梗束形成的温度范围分别为10~30 ℃、15~30 ℃,二者在所有琼脂浓度、pH、氧气、光照处理上也均发育,其中单因素试验二者最适环境因子除氧气(培养皿直径100 mm)相同外,温度(25、27 ℃)、琼脂浓度(3.0%、2.0%)、pH(5.80、8.00)、光照(0、24 h)各不相同,正交优化试验组合除温度均为25 ℃外、其他环境因子与单因素结果完全一致。
上述盖囊菇菌丝生长的温度范围与郭禧淑等[2]、严泽湘[20]、贺新生等[21]研究结果一致。该菇菌丝生长最适温度与DAWIDOWICZ等[22]研究结果相同,但与HOA等[23](28 ℃)的与李蝶等[3](27.5 ℃)的不符。该菇菌丝生长pH的范围与李蝶的研究结果一致,其最适pH与贺新生研究结果相同,而与DULAY等[24](7.00)、郭禧淑等(6.00~6.50)、严泽湘(6.00~6.50)等研究结果不同。氧气浓度与盖囊菇菌丝生长速度成正比,黑暗情况下更有利于菌丝生长,该结果与贺新生的研究相同。目前,盖囊菇孢梗束的研究极少且仍处于形态学观察阶段,其它方面未见报道,环境条件对其影响较大。
因此,本试验结果与前人的研究存在部分差异,导致出现上述结果极有可能与菌株的遗传多样性有关,同一品种但不同来源其生物学特性存在一定的差异,如和耀威等[25]与陈绪涛等[26]分别对不同来源的黑木耳、皱环球盖菇菌株均开展了温度试验,在不同的温度梯度下菌株间温度的变化趋势与最适温度均存在不同程度的差异。此外,培养基质种类、试验设备型号、人员操作技术等因素均可能引起试验结果的差异。
总之,在摸清临沧覆土栽培盖囊菇高温品种可控环境条件的基础上,一方面,继续采用本试验的培养方式,有必要对该菇的营养生理[27]、不同生育阶段酶活[28]、液体发酵技术[29]等进行系统的研究;另一方面,采用培养料培养方式,对该菇进行不可控环境条件[30]、栽培[31]、产品加工[32]、孢梗束形成机理等方面的研究,为该菇的林下推广与应用鉴定基础。

