肿瘤坏死因子受体相关因子6高表达对子宫内膜癌细胞侵袭、迁移及上皮间质转化的影响
冯一平,袁浩鑫,曾尚云,王思雨
(大同市第五人民医院妇科,山西 大同 037009)
子宫内膜癌在女性恶性肿瘤中有较高的发病率,多发于女性绝经后,阴道不规则流血是其最典型症状[1-2]。目前手术联合放化疗可提高患者的5年生存率,但对于子宫内膜癌的复发和转移的防治还没有较好的治疗策略。上皮间质转化是癌症转移的关键步骤,在子宫内膜癌的恶性进展过程中起到重要的推进作用[3-5]。肿瘤坏死因子受体相关因子6(TRAF6)是一个泛素连接酶,与肿瘤的发生发展以及侵袭转移过程密切相关[6]。据报道,TRAF6可抑制上皮间质转化和结直肠癌转移[7]。本研究以人子宫内膜癌细胞Ishikawa作为研究对象,提高TRAF6的表达,探究TRAF6对人Ishikawa细胞恶性生物学行为的影响。
1 材料与方法
1.1 实验材料 人子宫内膜癌Ishikawa细胞、人子宫内膜上皮细胞ESC,上海ATCC细胞库提供;BCA蛋白定量试剂盒,购自南京森贝伽生物科技有限公司提供;空载质粒慢病毒载体、TRAF6质粒慢病毒载体,广州源井生物科技有限公司提供;兔抗人TRAF6、E-cadherin、Occludin、N-cadherin、Vimentin抗体,艾博抗(上海)贸易有限公司提供;Trizol RNA分离试剂,赛默飞世尔科技(中国)有限公司提供。
1.2 实验方法
1.2.1 细胞转染与分组:将Ishikawa细胞用胰酶消化,移液器配合少量培养基进行吹打,收集细胞,1500 r/min、4 ℃低温离心10 min,制备单细胞悬液(5×104/ml),接种于6孔板(2 ml/孔)。通过转染试剂将空载质粒慢病毒载体或TRAF6质粒慢病毒载体转染入Ishikawa细胞中,记为NC组或TRAF6高表达组,对照组为未转染的Ishikawa细胞。各组细胞置于细胞培养箱中继续培养48 h。
1.2.2 RT-qPCR和WB法检测人子宫内膜癌细胞、人子宫内膜上皮细胞中TRAF6 mRNA和蛋白表达:胰酶消化收集Ishikawa细胞和ESC细胞于离心管。向离心管中滴加1 ml Trizol混匀充分裂解,12000 r/min、4 ℃低温离心10 min,取上清与异丙醇混合后离心,留沉淀进行RNA洗脱和再溶解。取RNA逆转录得到cDNA,随后进行RT-qPCR。设置β-actin为内参,引物序列见表1,以2-ΔΔCt法处理数据。分别提取Ishikawa、ESC细胞总蛋白,并定量蛋白浓度。将50 μg蛋白与3倍体积的上样缓冲液(4×)混匀,沸水浴变性10 min,凝胶孔中上样,80 V电泳至蛋白Marker出现红色标度(70 kD),调整电压为130 V,溴酚蓝距底部约0.5 cm,停止电泳,转膜。5%脱脂奶将膜封闭后,与一抗溶液(1∶500稀释的TRAF6抗体)孵育1 h,洗涤后浸入二抗溶液(1∶1000稀释的羊抗兔IgG抗体)孵育1 h,显色后拍照,通过Image J软件分析结果。
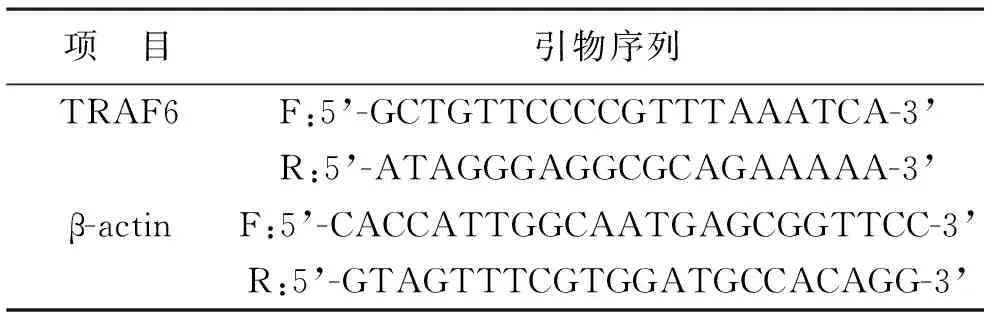
表1 引物序列
1.2.3 Transwell实验检测细胞侵袭能力:1.2.1中细胞经胰酶消化,并重悬(2×105个/ml),在Transwell上室(基质胶包被)中加入100 μl细胞悬液,将500 μl细胞培养基(含10% FBS)加入下室,孵育24 h后,将穿过膜的细胞固定、结晶紫染色,光镜下计数穿膜细胞数。
1.2.4 划痕实验检测细胞迁移能力:取1.2.1中细胞,细胞层用无菌枪头(200 μl)垂直划线形成划痕,继续培养24 h,光镜下于0 h和24 h分别拍照。通过Image Pro Plus 6.0系统分析0 h和24 h的划痕面积,计算划痕愈合率。划痕愈合率(%)=(1-24 h划痕面积/0 h划痕面积)×100%。
1.2.5 WB检测细胞E-cadherin、Occludin、N-cadherin、Vimentin蛋白表达:取1.2.1中细胞,根据全蛋白提取试剂盒说明书操作,提取细胞总蛋白,检测E-cadherin、Occludin、N-cadherin、Vimentin蛋白表达。
1.2.6 裸鼠移植瘤实验:取1.2.1中细胞,胰酶消化收集,无菌PBS重悬为5×106/ml的单细胞悬液,注射器抽取200 μl注射于裸鼠右侧腋窝皮下,对应细胞分组分别记为对照组、NC组和TRAF6高表达组,每组10只。接种后对裸鼠状况密切关注,14 d后处死裸鼠,观察肿瘤侵袭周围脏器情况以及肺、肝脏有无肿瘤转移情况。
2 结 果
2.1 人子宫内膜癌细胞、人子宫内膜上皮细胞中TRAF6 mRNA和蛋白表达比较 相较于ESC细胞,Ishikawa细胞的TRAF6 mRNA水平和蛋白表达显著降低(均P<0.05),见表2。

表2 ESC和Ishikawa细胞中TRAF6 mRNA和蛋白表达比较
2.2 TRAF6对Ishikawa细胞侵袭和迁移能力的影响 与对照组相比,TRAF6高表达组穿膜细胞数、划痕愈合率降低(均P<0.05);NC组与对照组相比,穿膜细胞数、划痕愈合率比较差异无统计学意义(均P>0.05),见表3。

表3 各组穿膜细胞数和划痕愈合率
2.3 TRAF6对上皮间质转化标志蛋白表达的影响 与对照组和NC组相比,TRAF6高表达组E-cadherin、Occludin蛋白表达升高,N-cadherin、Vimentin蛋白表达水平降低(均P<0.05),见表4。

表4 TRAF6对E-cadherin、Occludin、N-cadherin、Vimentin蛋白表达的影响
2.4 TRAF6对裸鼠大体肿瘤侵袭周围脏器的影响 接种各组细胞后密切关注裸鼠状况,三组裸鼠在成瘤后均表现出不同程度的精神欠佳和消瘦。裸鼠大体解剖肉眼观察,可见皮下肿瘤包膜完整、光滑、质硬,与皮肤及周围组织无明显粘连。其中对照组和NC组相较于TRAF6高表达组,可见裸鼠肺、肝脏表面存在粗糙暗沉,质硬、粟粒状改变,表明对照组和NC组Ishikawa细胞可引起肿瘤侵袭周围脏器肺及肝脏,而TRAF6高表达组未出现明显转移情况。
3 讨 论
子宫内膜癌是女性生殖道常见恶性肿瘤[8-9]。大量研究[10-12]发现,子宫内膜癌有淋巴转移的患者在进行手术以及放化疗后,5年生存率仍不可观,而无淋巴转移的患者则预后较好。因此,如何阻断子宫内膜癌的侵袭和转移,成为提高其临床治疗效果和患者生存率的关键。
TRAF6可介导细胞内多条信号通路,参与细胞发育、免疫、稳态等过程[13-15],并且在癌症的发生发展中具有重要作用[16]。Hu等[17]研究发现,降低TRAF6的表达会使宫颈癌细胞活力增强。Muto等[18]研究发现,TRAF6通过直接靶向MYC致癌活性在髓系恶性肿瘤中发挥肿瘤抑制作用。本研究发现,与人子宫内膜上皮细胞ESC相比,人子宫内膜癌细胞Ishikawa中TRAF6低表达;本研究进一步构建稳定高表达TRAF6的Ishikawa细胞来验证其作用,结果显示高表达TRAF6的Ishikawa细胞的侵袭和迁移能力均显著低于对照组,裸鼠移植瘤实验结果也证实高表达TRAF6的Ishikawa细胞的体内成瘤转移现象不明显。以上结果提示高表达TRAF6可抑制子宫内膜癌的侵袭迁移,表明TRAF6在子宫内膜癌的发生发展中可能具有重要作用。
在上皮间质转化过程中,肿瘤细胞的上皮特征消失,获得成纤维细胞样形态,随后发展为间质表型[19]。此时细胞的上皮标志蛋白(如E-cadherin、Occludin等)表达减少,细胞极性和黏附性降低,而间质标志蛋白(如N-cadherin、Vimentin等)表达增加,细胞侵袭和迁移能力升高[20]。研究显示,在妇科癌症(卵巢癌、宫颈癌和子宫内膜癌)上皮间充质转化中,E-cadherin下调,N-cadherin、Vimentin上调[21];且E-cadherin是子宫内膜癌预后良好的潜在标志物[22]。据报道,TRAF6可通过抑制上皮间质转化来抑制癌细胞转移[7]。本研究结果显示,相较于对照组,TRAF6高表达组E-cadherin、Occludin蛋白水平升高,N-cadherin、Vimentin蛋白表达水平降低。提示TRAF6可阻断上皮间质转化过程,抑制子宫内膜癌细胞的侵袭迁移。
综上所述,TRAF6在子宫内膜癌的发生发展中具有重要的调节作用,过表达TRAF6抑制子宫内膜癌细胞的侵袭、迁移与上皮间质转化。本研究为子宫内膜癌治疗靶标的相关研究提供理论和实验依据,后续将进行TRAF6作用机制的深入探讨。

