蛋白精氨酸甲基转移酶5在前列腺癌组织中的表达及其与患者临床病理特征的关系
王小禹,周 宁,黄 芩,甘利娟
(1.江油市九O三医院病理科,四川 江油 621700;2.绵阳四O四医院病理科,四川 绵阳 621000)
前列腺癌是男性最常见的癌症,也是癌症相关死亡的主要原因之一[1]。血清前列腺特异度抗原(Prostate specific antigen,PSA)检测常用于辅助诊断前列腺癌,但其特异度不理想,导致对非致命性疾病的过度治疗[2-3]。多参数磁共振成像(mpMRI)技术的引入改善了对疑似前列腺癌的风险分类[4],但仍存在完善和进步的空间。关于前列腺癌诊断和预后的生物标志物,目前的研究聚焦于无创的尿液或血液检测[5]。新兴的癌基因蛋白精氨酸甲基转移酶5(Protein arginine methyltransferase 5,PRMT5)是蛋白精氨酸甲基转移酶(Protein arginine methyltransferases,PRMTs)家族中的一种Ⅱ型酶,可将组蛋白和非组蛋白底物的精氨酸残基甲基化[6]。越来越多的证据表明,PRMT5通过表观遗传和非表观遗传机制在多种癌症中作为致癌基因起作用。Deng等[7]研究发现,PRMT5在转移性激素敏感性前列腺癌和去势抵抗性前列腺癌细胞中通过表观遗传激活雄激素受体的转录活性进而促进前列腺癌细胞的生长。因此,本研究旨在分析PRMT5 在前列腺癌组织中的表达及其与患者临床病理学特征的关系,并评估PRMT5对前列腺癌的诊断效能。
1 对象与方法
1.1 研究对象 选取2019年1月至2022年6月在江油市九O三医院泌尿外科行根治性前列腺癌切除术的96例患者为观察组,另选取同期经尿道前列腺电切术的70例良性前列腺增生患者作为对照组。病例纳入标准:①观察组患者均经影像学及病理检查确诊为前列腺癌;②首次进行前列腺癌根治手术;③对照组患者均存在下尿路症状(尿频、尿急、尿道口灼烧样痛),并经影像学及病理检查确诊为良性前列腺增生;④未患有其他内分泌、免疫或代谢疾病;⑤意识清醒,认知正常,能正常交流。排除标准:①严重心、肝、肾功能不全者;②合并其他恶性肿瘤;③合并传染性疾病者;④精神异常者。所有研究对象知情同意且研究通过本院伦理委员会审核批准。
1.2 免疫组织化学染色检测前列腺组织中PRMT5表达水平 手术标本经4%多聚甲醛固定,石蜡包埋、切片,采用兔链霉卵白素-生物素两步法检测试剂盒(购自北京中杉金桥生物技术有限公司)进行免疫组化染色,检测步骤严格按照试剂盒说明书进行。PRMT5抗体购自美国Abcam公司。采用DAB辣根过氧化物酶显色试剂盒(购自上海碧云天生物技术有限公司)显色,苏木素复染细胞核、封片、镜检。
1.3 前列腺组织PRMT5 mRNA表达水平检测 取前列腺组织100 mg置于液氮中保存。提取组织总RNA,测定RNA纯度后,采用逆转录试剂盒将mRNA逆转录合成cDNA,以此为模板,采用RT-qPCR检测PRMT5的表达水平。按照AceQ qPCR SYBR Green Master Mix试剂盒(货号Q111-02,购自南京诺唯赞生物科技股份有限公司)方法,采用20 μl扩增体系,程序如下:95 ℃ 变性30 s;56 ℃ 退火30 s;72 ℃ 延伸30 s,共40个循环。以β-actin为内参计算基因表达量,采用2-ΔΔCt法计算相对表达量。引物序列见表1。

表1 引物序列
1.4 血清PRMT5表达水平检测 抽取两组患者外周静脉血 5 ml,室温静置30 min,3000 r/min,4 ℃离心10 min,取上清液置于-80 ℃储存备用。采用酶联免疫吸附实验(ELISA)检测血清PRMT5表达水平,试剂盒购自美国Bio Vision公司(货号E4977),检测步骤严格按照试剂盒说明书进行。
1.5 观察指标 ①比较两组患者的一般资料,包括年龄、体重指数(BMI)、吸烟饮酒史;②比较两组患者病理切片PRMT5染色阳性面积,组织PRMT5 mRNA表达水平和血清PRMT5的水平;③统计前列腺癌患者临床病理特征,比较不同病理特征下血清PRMT5的表达情况;④分析血清PRMT5与PSA的相关性及血清PRMT5水平对前列腺癌的风险性;⑤评估血清PRMT5及PRMT5、PSA联合对前列腺癌的诊断效能。
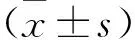
2 结 果
2.1 两组患者一般资料比较 两组患者年龄、BMI、吸烟饮酒方面比较差异无统计学意义(均P>0.05),见表2。

表2 两组患者一般资料比较
2.2 两组患者PRMT5表达水平比较 病理切片免疫组化染色结果显示,与良性前列腺增生组织相比,PRMT5阳性区域在前列腺癌组织中显著增加(P<0.001),提取两组组织RNA,RT-qPCR结果显示,前列腺癌组织中PRMT5 mRNA表达水平高于对照组,血清PRMT5水平高于对照组,差异具有统计学意义(均P<0.001),见表3。

表3 两组患者PRMT5表达水平比较
2.3 PRMT5表达水平与前列腺癌患者临床病理特征的关系 PRMT5表达在不同年龄、肿瘤大小不同的前列腺癌患者间比较无统计学差异(均P>0.05)。PRMT5表达与前列腺癌患者Gleason评分、微血管侵犯、TNM分期、淋巴结转移以及血清PSA水平有关:Gleason评分大于7分、存在微血管侵犯、TNM分期为Ⅲ-Ⅳ、发生淋巴结转移以及血清PSA水平大于等于10 ng/ml的前列腺癌患者的PRMT5表达高于Gleason评分小于7分、没有微血管侵犯、TNM分期为Ⅰ-Ⅱ、未发生淋巴转移以及血清PSA水平低于10 ng/ml的前列腺癌患者(均P<0.05)。见表4。

表4 PRMT5表达水平与前列腺癌患者临床病理特征的关系(ng/ml)
2.4 PRMT5与PSA相关性 Pearson相关性分析结果显示,血清PRMT5水平与PSA的水平呈显著正相关(r=0.536,P<0.001),见图1。

图1 PRMT5与PSA相关性散点图
2.5 血清PRMT5水平对前列腺癌患病风险的多因素Logistic回归分析 将血清PRMT5水平和PSA水平作为自变量,同时纳入年龄、Gleason评分因素,以前列腺癌为因变量(未发生=0,发生=1),构建多因素Logistic回归方程,结果显示,血清PRMT5水平升高,将增加前列腺癌患病风险,血清PRMT5升高是前列腺癌的危险因素。见表5。

表5 血清PRMT5水平对前列腺癌患病风险的多因素Logistic回归分析
2.6 血清PRMT5、PRMT5联合PSA对前列腺癌的诊断效能 ROC曲线分析结果显示,血清PRMT5截断值为14.230 ng/ml对诊断前列腺癌具有良好的灵敏度(84.38%)和特异度(87.14%),曲线下面积(AUC)为0.910(95%CI:0.866~0.953,P<0.001)。PRMT5联合PSA的AUC为0.968(95%CI:0.947~0.989,P<0.001),灵敏度为95.83%,特异度为82.86%,截断值为0.393。以上结果表明,血清PRMT5水平对前列腺癌具有良好的诊断价值,PRMT5联合PSA对前列腺癌的诊断具有更好的价值。见表6(图2)。

图2 PRMT5、PRMT5联合PSA诊断前列腺癌的ROC曲线
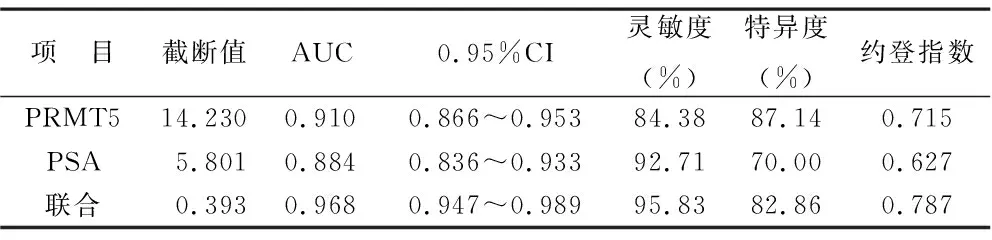
表6 PRMT5、PRMT5联合PSA对前列腺癌的诊断效能
3 讨 论
蛋白质精氨酸甲基化是一种常见的翻译后修饰形式,以 S-腺苷甲硫氨酸(S-adenosyl-methionine,SAM)为甲基供体,通过酶催化作用将SAM中的甲基基团转移到目的蛋白精氨酸胍基氮分子上[8]。PRMT主要有9个成员:PRMT1~9。精氨酸甲基化修饰分为单甲基化、对称性双甲基化和非对称性双甲基化修饰。PRMT 的主要功能包括 DNA 修复、信号转导,参与转录调控及细胞周期调控等[9]。PRMT家族蛋白及其介导的精氨酸甲基化修饰与癌症的发生发展密切相关。PRMT1在胰腺癌、结直肠癌、肝癌、乳腺癌、膀胱癌和肺癌等肿瘤组织中高表达[10-12]。Yang等[6]研究发现,通过调控转录因子 Twist1 34位精氨酸的甲基化进而参与上皮-间充质转化过程,并抑制上皮钙黏附蛋白(E-cadherin)的表达,导致肿瘤细胞的增殖和转移。Li等[13]报道了PRMT2 在乳腺癌组织中高表达。PRMT3 的酶活性在肺癌、胰腺癌和乳腺癌中明显升高[14]。PRMT6 在肺癌患者中的表达水平升高,且与预后不良有关。Miranda等[15]研究发现,PRMT7 在恶性乳腺癌组织和转移性乳腺癌细胞中表达增高,并通过催化E-cadherin启动子对称二甲基精氨酸的形成提高甲基化修饰水平,从而导致 E-cadherin的表达下调,细胞间黏附能力降低,促进了癌细胞转移。此外,PRMT7在肺癌组织中的表达高于正常肺组织,在肺癌细胞中过表达 PRMT7增强细胞的侵袭能力[16]。Jiang等[17]报道了PRMT9在肝癌细胞中表达水平较高,且与肝癌患者的生存率呈负相关。而PRMT5则是被发现在乳腺癌、宫颈癌、卵巢癌、食管癌和胃癌等肿瘤组织中表达水平增高[18-20]。Li等[21]研究发现,PRMT5在肺癌中的表达上调,使用其特异度抑制剂GSK591或shRNA抑制或下调PRMT5的表达可显著增强白藜芦醇诱导的细胞凋亡和化学敏感性,进而抑制肺癌细胞的增殖迁移。同时,Zhu等[22]研究发现,PRMT5可以与肿瘤基因产物核糖体蛋白S10(RPS10)作用,催化其158位和160位精氨酸残基发生甲基化,调控核糖体的装配过程,影响蛋白质合成。
前列腺癌是男性最常见的癌症之一,据报道,全世界每年有超过35万男性死于前列腺癌。改善前列腺癌的临床诊断方法以及寻找新的治疗靶点,是目前临床上急需解决的问题。Deng等[7]研究发现,PRMT5能够激活雄激素受体(Androgen receptor,AR)的转录,通过与转录因子特异度蛋白1(Specificity protein 1,SP1)相互作用被招募至AR启动子周围,并在 AR 的近端启动子区域与依赖腺苷三磷酸的染色质重构因子(Brg1)形成复合物进而促进前列腺癌细胞的生长。此外,Gu等[23]研究发现,前列腺癌细胞细胞质内的 PRMT5 能够促进前列腺癌细胞的生长,而细胞核内的 PRMT5 则抑制前列腺癌细胞的生长,具体机制尚有待研究。
在本研究中,我们检测了前列腺癌组织、血液样本中PRMT5的水平,发现PRMT5在前列腺癌组织中高表达,其表达与血清PSA水平呈正相关。传统前列腺癌的诊断依赖于患者血液中PSA的检测和组织活检检查,尽管前列腺癌的新兴标志物日益增多,且PSA在某些前列腺良性疾病中也可出现升高,如:良性前列腺增生或前列腺炎,但PSA仍在前列腺癌患者的筛查、治疗、疗效判断及监测复发等过程中发挥了关键的作用[24]。本研究证明了血清PRMT5具有与血清PSA水平类似的识别前列腺癌的能力,并表明PRMT5与PSA结合进一步提高了诊断效能。
综上所述,PRMT5水平在前列腺癌患者组织和血清中显著升高,是前列腺癌患病的危险因素,且与血清PSA呈正相关,PRMT5可进一步发展为一种非侵入性前列腺癌诊断生物标志物,为研究前列腺癌的防治提供了新的思路。

