芹菜素对大鼠脑外伤的保护作用及机制研究
党旭升,赵永林,丁 朵,潘龙飞
(西安交通大学第二附属医院,陕西 西安 710004)
脑外伤(Traumatic brain injury,TBI)是各种外力因素导致颅脑的损伤,在全球范围内发生率高,中度至重度TBI患者可能会长期存在后遗症,给家庭和社会带来沉重负担。现在研究认为TBI的病理生理过程分为两个时期,第一为外伤瞬间发生的原发性损害;第二为继发性损伤,主要因为TBI后脑血流减少,进而导致脑缺血和缺氧,最终引起神经元、血管内皮细胞的损伤[1]。尽管有报道一些方法可以改善脑外伤的预后及后遗症,但仍缺少有效的药物治疗或减轻TBI后的脑损伤[2-3]。芹菜素是一种有广泛生物学活性的黄酮化合物,具有无诱变性和低毒性的特点,主要分布于蔬菜和水果中,且芹菜中含量最高。芹菜素已被证实具有抗肿瘤、抗炎、抗病毒、抗氧化、扩张血管等多种药理作用[4-5]。研究[6]表明,芹菜素可能通过增加白细胞介素10的水平,对轻度TBI具有神经保护作用。但芹菜素对TBI的保护作用及潜在机制仍需要进一步探讨。本研究拟探讨芹菜素对大鼠脑外伤后胶质细胞活化、血脑屏障通透性、炎性因子及氧化应激水平的影响,并探索其潜在的分子机制,为芹菜素治疗脑外伤提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 动物分组:72只清洁级雄性SD大鼠,从西安交通大学医学部实验动物中心购买,8~10周龄,体重250~300 g。大鼠饲养在温度(23±1)℃的环境中,食水自由,每天12 h照明及12 h黑暗。根据随机数字表法将大鼠分为对照组、TBI组、TBI+芹菜素组,每组24只,其中6只用于形态学检测,6只用于脑组织含水量检测,6只用于伊文斯蓝检测,6只用于Western blot、氧化应激、炎性因子检测。TBI+芹菜素组大鼠造模后每天腹腔注射芹菜素(40 mg/kg),持续3 d[6]。
1.1.2 主要试剂与仪器:芹菜素购自美国Sigma-Aldrich公司;神经微丝中链蛋白(NF-M)抗体、胶质纤维酸性蛋白(GFAP)抗体购自美国Cell Signaling Technology公司;离子钙接头蛋白抗体(Iba-1)抗体购自日本Wako公司;Claudin-5、ZO-1、Occludin-1、β-actin抗体购自Abcam公司;免疫组化SP试剂盒、DAB显色盒购自北京中杉金桥公司;Western blot相关试剂购自上海碧云天生物技术有限公司;肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)和IL-6 ELISA试剂盒购自美国R&D Systems公司;超氧化物歧化酶(SOD)比色活性试剂盒购自美国Thermo Fisher Scientific公司、过氧化氢酶(CAT)活性检测试剂盒、脂质过氧化(MDA)检测试剂盒、谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒购自美国Merck公司。
1.2 实验方法
1.2.1 动物模型制备:大鼠TBI模型采用 Feeney 法,利用自由落体打击装置导致颅脑损伤[7]。戊巴比妥钠麻醉大鼠,俯卧位,利用脑立体定向仪固定,切开颅骨表面皮肤,暴露颅骨,利用磨钻开一骨窗,位置为前囟后1.5 mm、右旁开2.5 mm,暴露硬脑膜,直径5 mm,将20 g打击锤置于硬脑膜正上方,打击锤于15 cm高度沿导管坠落,造模后骨蜡封闭骨窗,缝合皮肤。对照组仅麻醉、去骨瓣。
1.2.2 HE染色:处死大鼠后,灌注0.9%氯化钠溶液及多聚甲醛后取脑,常规包埋、切片。二甲苯透明,梯度乙醇脱去二甲苯,蒸馏水漂洗,苏木精染色15 min,伊红染色3 min,梯度乙醇脱水,常规封片,光学显微镜观察,图像采集与分析系统采集图像。
1.2.3 伊文斯蓝:通过测量伊文斯蓝外渗的量来评估脑外伤后微血管通透性的改变。经股静脉注射伊文斯蓝(0.2 ml/100 g),2 h后处死大鼠,0.9%氯化钠溶液灌注后取脑,并将大脑分成两个半球。每个样品立即称重,用10%的三氯乙酸溶液匀浆,离心20 min。将上清与乙醇混合,用分光光度计在波长610 nm处测量。
1.2.4 脑组织含水量检测:采用干湿重法测定脑组织含水量。将新鲜脑标本分成两个半球,分别测量湿重。继续将大脑半球放入100 ℃的烤箱中72 h,再次称重(干重)。脑组织含水量(%)计算公式为[(湿重-干重)/湿重]×100%。
1.2.5 Western blot检测微管相关蛋白表达:大鼠麻醉后处死,冰上分离脑组织,RIPA裂解液和磷酸酶抑制剂处理,离心后收集上清。用BCA蛋白测定试剂盒检测蛋白质浓度,蛋白煮沸后用SDS-聚丙烯酰胺凝胶电泳分离,继续转移至PVDF膜,用5%脱脂牛奶在室温下封闭。4 ℃一抗孵育过夜:Claudin-5(1∶1000)、ZO-1(1∶1000)、Occludin-1(1∶1000)、β-actin(1∶1000)。继续用辣根过氧化物酶偶联二抗孵育。化学发光法显色、拍照,然后使用Image J软件进行分析。
1.2.6 免疫组化检测Iba-1、GFAP及NF-M的表达:大鼠处死后灌注、取脑,常规石蜡包埋、切片。将切片在柠檬酸缓冲液中提取抗原。洗涤后用H2O2孵育10 min,牛血清白蛋白在室温下封闭1 h,加入一抗:Iba-1抗体(1∶400)、GFAP抗体(1∶200)、NF-M抗体(1∶200),4 ℃过夜,清洗后,二抗在室温下孵育30 min。辣根酶标记链霉卵白素孵育30 min。DAB显色、苏木素溶液复染,脱水、封片,每张切片随机选取6个视野,采集图像。结果以免疫组化评分进行评估,染色强度与阳性细胞数的乘积为免疫组化评分,其中染色强度评分包括:无染色、轻度染色、中度染色、重度染色,分别为:0分、1分、 2分、3分;阳性细胞数百分比评分包括:无染色、1%~10%染色、11%~50%染色、51%~80%染色、81%~100%染色,分别为0分、1分、2分、3分、4分。评分最高12分,最低0分[8]。
1.2.7 ELISA检测炎性因子TNF-α、IL-6、IL-1β表达:取-80 ℃保存的大鼠脑组织,溶解、离心后取上清,采用ELISA试剂盒按照说明书步骤检测上清液中TNF-α、IL-1β和IL-6 的表达水平。具体为:包被液稀释包被抗原,洗涤后加封闭液,再次洗涤后结合一抗,洗涤后结合酶标二抗,显色后加入终止液,使用酶标仪读取450 nm的OD值。
1.2.8 氧化应激水平检测:大鼠皮层用9倍体积的0.9%氯化钠溶液进行匀浆,4 ℃下离心15 min。用试剂盒检测 SOD、CAT、GSH-Px 及 MDA 的含量。
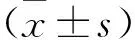
2 结 果
2.1 芹菜素对TBI后神经损伤的影响 HE染色提示:对照组大鼠皮层脑组织镜下可见神经细胞排列整齐、胞膜结构完整、染色质清晰。TBI组均可见不同程度的神经纤维排列紊乱、结构扭曲、神经细胞胞体肿胀、胞核固缩。与TBI+芹菜素组相比,神经纤维结构扭曲、胞体肿胀等病理改变明显减轻(图1)。免疫组化染色提示:对照组内NF-M表达量少,与对照组相比,TBI组NF-M的表达明显升高;与TBI组相比,TBI+芹菜素组NF-M的表达下降,差异有统计学意义(P<0.05)(图2)。提示芹菜素可以减轻TBI后的神经损伤。

图1 芹菜素对TBI后神经损伤的影响(HE染色,×20)
注:与对照组相比,*P<0.05;与TBI组相比,#P<0.05图2 芹菜素减轻TBI后的神经损伤(免疫组化染色,×20)
2.2 芹菜素对TBI后血脑屏障通透性的影响 Western blot结果提示:与对照组相比,TBI组Claudin-5、ZO-1、Occludin-1的表达均明显降低,差异均有统计学意义(均P<0.05),提示TBI后血脑屏障(Blood brain barrier,BBB)被破坏;与TBI组相比,TBI+芹菜素组Claudin-5、ZO-1、Occludin-1的表达均升高,差异均有统计学意义(均P<0.05)(图3A)。与对照组相比,TBI组皮层脑组织含水量及伊文斯蓝含量均明显升高(均P<0.05);与TBI组相比,TBI+芹菜素组脑组织含水量及伊文斯蓝含量均下降,差异均有统计学意义(均P<0.05)(图3B)。提示芹菜素可以减轻TBI后的BBB破坏。
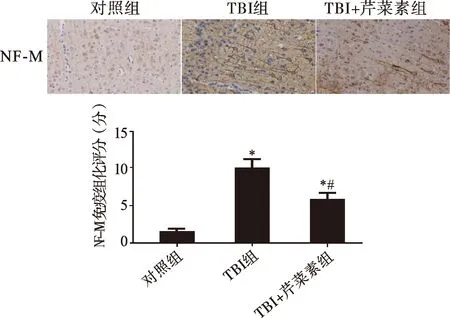
2.3 芹菜素对TBI后的胶质反应的影响 免疫组化结果提示:对照组内GFAP及Iba-1的表达均较少。与对照组相比,TBI组GFAP、Iba-1的表达均明显升高,差异均有统计学意义(均P<0.05),提示TBI后受损皮层内的星形胶质细胞及小胶质细胞大量活化;与TBI组相比,TBI+芹菜素组GFAP、Iba-1的表达均降低,差异均有统计学意义(均P<0.05)(图4、5)。提示芹菜素可以抑制TBI后的胶质细胞反应。

注:与对照组相比,*P<0.05;与TBI组相比,#P<0.05图4 芹菜素对TBI后星形胶质细胞活化的影响(免疫组化染色,×20)
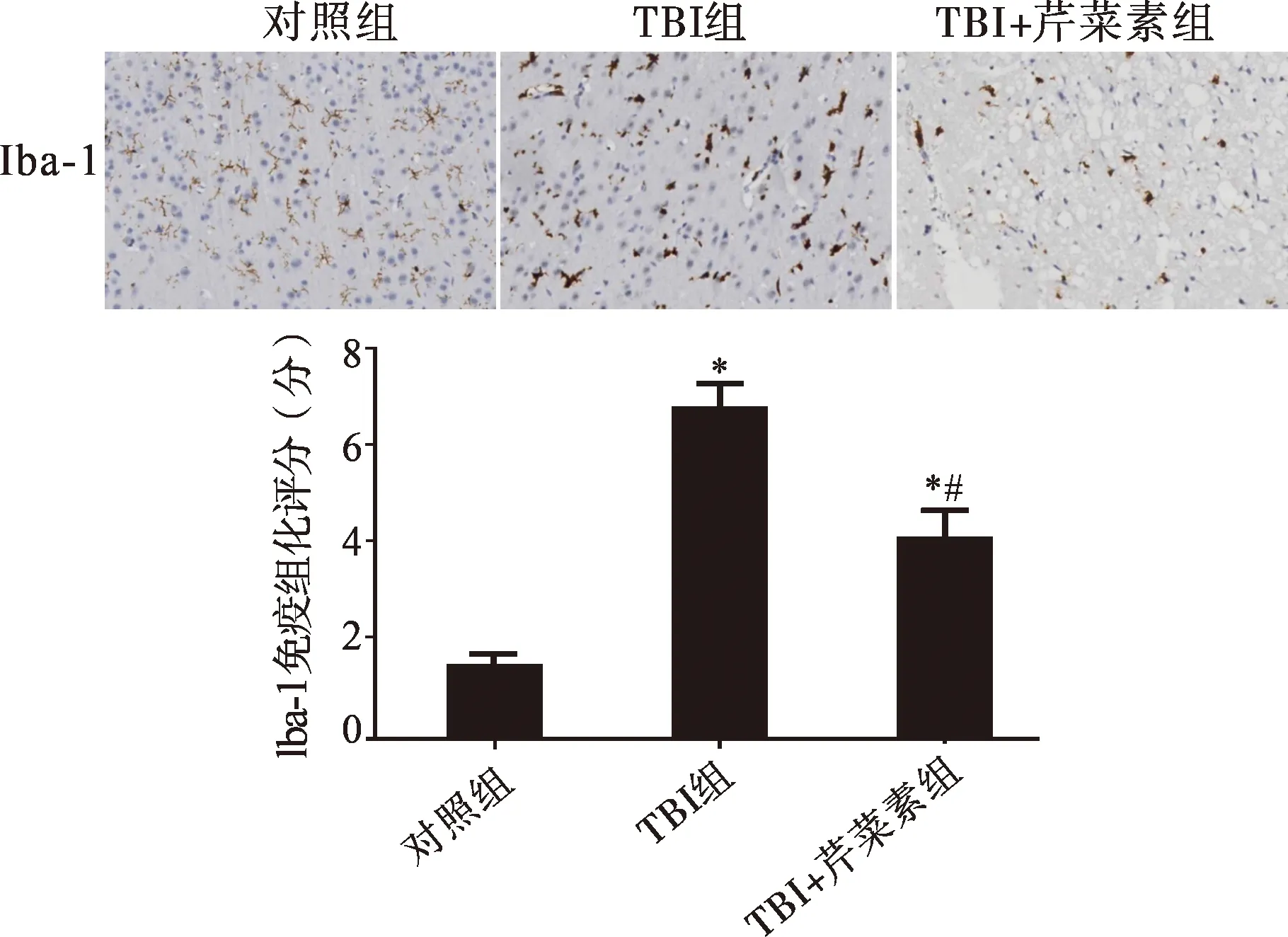
注:与对照组相比,*P<0.05;与TBI组相比,#P<0.05图5 芹菜素对TBI后小胶质细胞活化的影响(免疫组化染色,×20)
2.4 芹菜素对TBI后大鼠脑皮层组织炎性反应及降低氧化应激水平的影响 与对照组相比,TBI组大鼠皮层组织中SOD、GSH-Px和CAT活性降低,MDA含量升高(均P<0.05)。与TBI组比较,TBI+芹菜素组大鼠脑皮层组织中 SOD、GSH-Px 和 CAT 活性增强,MDA 含量减少(均P<0.05)(图6A)。与对照组相比,TBI组促炎因子IL-6、IL-1β、TNF-α的水平均明显升高(均P<0.05),与TBI组相比,TBI+芹菜素组IL-6、IL-1β、TNF-α的表达水平明显降低(均P<0.05)(图6B);提示芹菜素可以降低TBI后炎性因子和氧化应激水平。
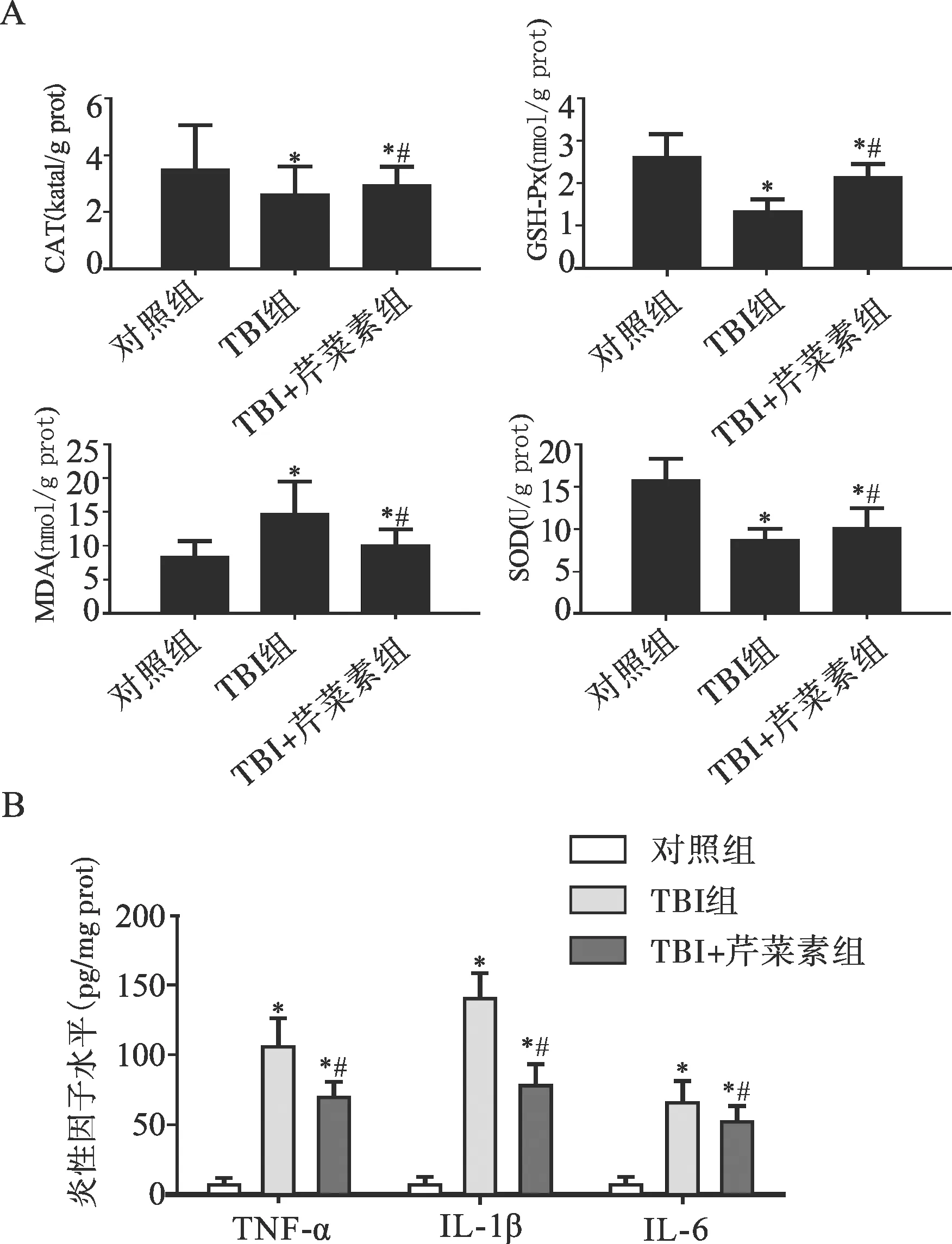
注:与对照组相比,*P<0.05;与TBI组相比,#P<0.05图6 芹菜素对TBI后大鼠脑皮层组织炎性反应及氧化应激水平的影响
3 讨 论
本研究中HE染色及NF-M的免疫组化染色发现,TBI组大鼠脑皮层神经细胞肿胀、坏死、神经纤维扭曲,轴索损伤标志物NF-M的表达升高,故本研究采用自由落体致伤法成功模拟临床TBI。TBI的致死率和致残率高,近年来开展了多项针对TBI患者的各种干预措施的随机对照试验,但均未取得令人满意的结果,因此迫切需要更有效的药物来治疗TBI[9]。
芹菜素是天然抗氧化剂,有降血压和舒张血管、预防动脉粥样硬化、抑制肿瘤等作用,对糖尿病、健忘症和阿尔茨海默病、抑郁症和失眠等也有一定的缓解作用[4,10-12]。研究[13-15]发现,芹菜素可以通过下调氧化应激和炎症来改善糖尿病大鼠的糖脂代谢和内皮功能障碍;也可以剂量依赖性地降低阿尔茨海默动物模型的氧化应激水平,抑制乙酰胆碱酯酶的活性及Aβ-42聚集体的形成;并能通过调节AMPK通路缓解抑郁症动物的行为障碍,恢复细胞抗氧化能力。本研究发现TBI 后连续 3 d 给予芹菜素,可减轻TBI后的神经损伤,保护BBB完整性,并抑制胶质细胞的活化,提示芹菜素可以减轻TBI后的脑损伤。
BBB是内皮细胞的高度选择性半透性边界,可防止循环血液中的溶质非选择性地进入中枢神经系统。BBB被破坏是TBI后的关键继发性损伤事件,导致通透性增加,血管源性脑水肿,颅内压增高等,最终导致继发性脑损伤[16]。TBI后炎性反应是BBB被破坏的机制之一。炎性反应有助于清除坏死组织碎片,促进胶质细胞分化及血管生成,有效修复神经组织,但过度且持续的神经炎性反应可增加BBB通透性,加快脑水肿发生[17]。本研究中,TBI后紧密连接蛋白Claudin-5、ZO-1、Occludin-1的表达降低,伴有脑组织含水量及伊文斯蓝渗透量增加,提示BBB被破坏,而芹菜素则可以减轻BBB的破坏。
芹菜素对TBI后BBB的保护作用可能与抑制炎性反应及氧化应激水平有关。既往研究发现,芹菜素对化疗药物诱导的肾毒性具有保护作用,其保护作用与降低MDA、IL-6、TNF-α、caspase-1、IL-1β 的水平、升高 SOD 活性及GSH 水平有关[18]。用芹菜素处理小鼠的胆汁淤积模型,可以减轻胆囊萎缩及相关的肝损伤,缓解胆汁酸代谢异常,其保护作用与抑制TLR4/NF-κB通路及降低下游炎症因子及氧化应激水平有关[19]。既往还发现芹菜素可以增加TBI后脑内抗炎因子IL-10的水平,对轻度TBI具有神经保护作用[6]。本研究中,芹菜素能降低促炎因子IL-6、IL-1β、TNF-α的表达水平及氧化应激水平,与既往研究结果一致。小胶质细胞和星形胶质细胞是中枢神经系统的关键细胞,当它们被激活时,分泌多种细胞因子和炎性介质来调节中枢神经系统炎症,导致神经毒性[20]。本研究中TBI 后星形胶质细胞和小胶质细胞过度激活,而芹菜素能抑制胶质细胞活性,这可能是芹菜素抑制炎症及氧化应激的机制之一。
综上所述,芹菜素对大鼠TBI具有保护作用。芹菜素通过抑制胶质细胞活性,降低体内的炎症及氧化应激水平,减轻BBB的破坏,保护神经细胞,这可能是芹菜素改善TBI的作用机制。

