基于JNK信号通路探讨自噬、胰岛素抵抗在非酒精性脂肪性肝病中的发病机制
延 华,柴春艳,张 丹,赵 媛,李 敏
(1.陕西省人民医院老年病院,陕西 西安 710068;2.陕西省人民医院保健办,陕西 西安 710068)
随着肥胖的流行和生活方式的改变,全球非酒精性脂肪性肝病(Non-alcoholic fatty liver disease,NAFLD)已成为第一大慢性肝病的病因。NAFLD不仅可以导致肝纤维化、肝硬化,还与肥胖、2型糖尿病、血脂异常等一起作为代谢综合征的组分互为因果、相互影响[1]。所有这些代谢紊乱又均与胰岛素抵抗(InsuIin resistance,IR)相关[2]。由于IR,胰岛素升高通过与胰岛素受体结合,并通过磷脂酰肌醇3激酶(PI3K)蛋白激酶B(Akt)激活下游信号通路,从而刺激血糖摄取和储存[3]。C-Jun N末端激酶(JNK)与IR密切相关,并由炎症细胞因子和游离脂肪酸(FFA)激活[3]。研究[4]表明,JNK的激活会加速脂质积累并导致肝脏损伤。自噬是一个至关重要的生理过程,通过调节细胞内脂质储存,消除受损的细胞器和错误折叠的蛋白质,在细胞稳态中发挥重要作用[5]。研究[6]报道,自噬与NAFLD发病机制有关,自噬功能障碍已在NAFLD患者、NAFLD小鼠模型肝脏中被检测到。JNK信号通路对自噬过程至关重要,JNK的激活有助于自噬基因Beclin-1的表达,介导异常的自噬调节和介导p53磷酸化[7]。自噬异常干扰脂质代谢,自噬功能异常可能促进NAFLD发病。JNK、胰岛素抵抗、自噬均与NAFLD的病理过程有关。然而,它们之间的关系还没有被完全阐明。因此,了解JNK信号通路介导脂质代谢的分子机制,对于寻求NAFLD新的治疗方法具有重要意义。本文以NAFLD大鼠模型研究JNK信号通路在胰岛素抵抗和自噬中的作用及相关机制。
1 材料与方法
1.1 实验动物 雄性SD大鼠40只,8周龄,180~200 g,来自西安交通大学动物中心。大鼠在标准条件下饲养:温度25 ℃,12 h光/暗循环,以及自由采食标准实验室饲料和水。
1.2 实验试剂 SP600125(No.S1460,EMD Millipore,Billerica,美国),ELISA试剂盒(上海酶联生物科技有限公司),放射免疫沉淀分析裂解缓冲液(No.20101ES60,中国海门生物技术研究所),Lowry蛋白测定试剂盒(No.C504031,Pierce,Thermo Fisher Scientific,Inc,美国),聚偏二氟乙烯膜上(No.DVPP00010,EMD Millipore,Bedford,MA,美国)。Anti-Akt(No.2920)、磷酸化(p)Akt(Ser473)(No.4060)、anti-Atg 3(No.3415)、anti-Atg 5(No.12994)、anti-LC-3(No.4108)、anti-Beclin 1(No.3783)(Cell Signaling Technology,Inc.,Danvers,MA,美国),anti-IRS1(No.05-784)、 anti-p-IRS1(Ser307)(No.05-1087)(均为EMD Millipore),抗IRβ (No.sc-711)、anti-p-IRβ(Tyr 1150/1151)(No.sc-81500)、anti-p-JNK1 (Thr183)(No.sc-135642)、anti-JNK1(No.sc-571)和抗GAPDH(No.sc-20357,Santa Cruz,美国)。磷酸缓冲盐溶液(PBS,No.P1002北京索莱宝生物科技公司)。辣根过氧化物酶偶联的二抗(Invitrogen,Thermo Fisher Scientific,Inc,美国)。
1.3 实验方法
1.3.1 实验动物模型制备:将大鼠随机分为四组,正常饮食组(ND组,n=10)、高脂饮食组(HFD组,n=10)、JNK抑制剂SP600125治疗组(SP60012520组,n=10)、磷酸盐缓冲盐水PBS对照组(Control组,n=10)。ND组喂食正常饲料,HFD组、SP600125组和Control组喂食高脂饲料(88%基础饲料+2%胆固醇+10%猪油组成)20周,SP600125组大鼠腹腔注射SP600125(30 mg/kg体重)、Control组大鼠注射磷酸盐缓冲盐水PBS,每天1次,再延长8周。20周结束时,ND组和HFD组用戊巴比妥钠麻醉大鼠(40 mg/kg体重,腹腔内注射),经颈椎脱位处死后进行生化分析,对大鼠的肌肉、脂肪和肝脏标本进行Western blot检测。SP600125组和Control组治疗后,大鼠颈椎脱位处死,进行生化分析,并对大鼠肝脏标本进行Western blot检测。
1.3.2 生化分析:使用ELISA试剂盒检测血清FFA和胰岛素水平。糖耐量测试在喂食ND或HFD 20周后进行,禁食6 h后,ND组和HFD组大鼠腹腔注射葡萄糖(2.0 g/kg体重)。在不同时间点(0、15、30、60、120 min)尾静脉采血,使用便携式血糖仪[型号 860,江苏鱼跃医疗器材有限公司(南京)]检测血糖水平。
1.3.3 胰岛素抵抗测定:为了评估高脂饮食喂养的大鼠肝脏是否出现胰岛素抵抗,将大鼠禁食过夜,并腹腔注射胰岛素(1.5 U/kg)。30 min后,分离肝脏并进行Western blot检测磷酸化胰岛素受体β亚基(p-IRβ)和磷酸化胰岛素受体底物-1(p-IRS-1)和磷酸化蛋白激酶B(p-Akt)。
1.3.4 Western blot检测目的蛋白表达:使用放射免疫沉淀分析裂解缓冲液从组织中分离蛋白。将匀浆在15000 r/min、4 ℃下离心30 min,丢弃颗粒。蛋白浓度用Lowry蛋白测定试剂盒,用8%SDS-聚丙烯酰胺凝胶电泳分离20 g蛋白,样品装在聚丙烯酰胺凝胶上。随后,凝胶中的蛋白质被印迹到聚偏二氟乙烯膜上。用含0.1% Tween-20的5%脱脂牛奶在室温下封膜1 h,然后在4 ℃下用一级抗体探针过夜。使用的主要抗体如下:Anti-Akt(1∶1000),磷酸化(p)Akt(Ser473)(1∶1000),anti-Atg 3(1∶1000),anti-Atg 5(1∶1000),抗LC-3(1∶100),anti-Beclin 1,anti-IRS1(1∶2000), anti-p-IRS1(Ser307)(1∶2000),抗IRβ(1∶500),anti-p-IRβ(Tyr 1150/1151)(1∶500),anti-p-JNK1 (Thr183)(1∶200),anti-JNK1(1∶400)和抗GAPDH(1∶10 000)。然后将印迹与相应的辣根过氧化物酶偶联的二抗在室温下放置1 h。使用增强的化学发光检测系统(EMD Millipore)对印迹进行可视化,并将印迹暴露于薄膜中。使用Image 2.0版本(Bio-Rad Laboratories,Inc.,Hercules,CA,美国)进行量化。
1.4 统计学方法 所有数据分析使用SPSS 17.0统计学软件进行,计量资料以平均值±标准差表示,采用t检验进行分析,P<0.05为差异有统计学意义。
2 结 果
2.1 ND组与HFD组大鼠血糖、游离脂肪酸及胰岛素水平比较 腹腔注射葡萄糖后,ND组大鼠血糖浓度略有升高,但在120 min时降至空腹水平。HFD组大鼠血糖浓度逐渐升高,在60 min时达到峰值,到120 min尚未恢复正常水平,见表1。与ND组大鼠相比,HFD组大鼠血清中FFA和胰岛素水平显著升高(P<0.05),见表2。
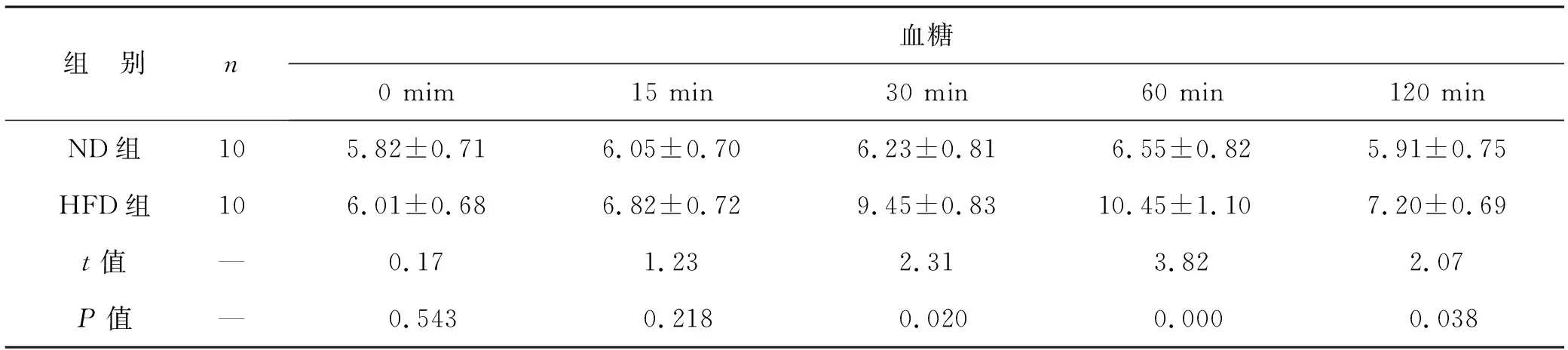
表1 ND组与HFD组大鼠不同时间血糖水平比较(mmol/L)

表2 ND组与HFD组大游离脂肪酸及胰岛素水平比较
2.2 ND组与HFD组大鼠肌肉、脂肪和肝脏组织中p-JNK1蛋白表达水平比较 检测大鼠肌肉、脂肪和肝脏中p-JNK1蛋白的表达水平,结果显示,与ND组相比,HFD组的大鼠的p-JNK1蛋白表达水平显著升高(P<0.05),见图1。

注:*P<0.05,**P<0.01图1 ND组与HFD组大鼠肌肉、脂肪和肝脏组织中p-JNK1蛋白表达水平比较
2.3 ND组与HFD组大鼠肝脏自噬相关蛋白表达水平比较 与ND组相比,HFD组自噬相关蛋白LC-3Ⅱ、Beclin-1、Atg 5和Atg 3表达水平上调(均P<0.05),见图2。

注:*P<0.05,**P<0.01图2 ND组与HFD组大鼠肝脏自噬相关蛋白表达水平比较
2.4 ND组与HFD组大鼠胰岛素抵抗指标p-IRβ、p-IRS-1、p-Akt表达水平比较 与ND组相比,HFD组大鼠的p-IRβ、p-IRS-1和p-Akt表达水平升高,差异具有统计学意义(均P<0.05),见图3。

注:*P<0.05,**P<0.01图3 ND组与HFD组大鼠胰岛素抵抗指标p-IRβ、p-IRS-1、p-Akt表达水平比较
2.5 SP600125组和Control组大鼠p-JNK1和自噬相关蛋白、胰岛素抵抗指标比较 与Control组对比,SP600125组p-JNK1水平下降,SP600125组大鼠肝脏中自噬相关蛋白LC-3Ⅱ、Beclin-1、Atg 5、Atg 3以及p-IRβ、p-IRS-1和p-Akt蛋白表达水平显著降低,差异具有统计学意义(均P<0.01),见图4。

注:**P<0.01,***P<0.001图4 SP600125组和Control组大鼠p-JNK1(A)和自噬相关蛋白(B)、胰岛素抵抗指标(C)比较
2.6 SP600125组和Control组大鼠FFA和胰岛素水平比较 与Control组相比,高脂饮食喂养的SP600125组大鼠血清中FFA和胰岛素水平显著降低,差异具有统计学意义(P<0.01),见表3。

表3 SP600125组和Control组大鼠FFA和胰岛素水平比较
3 讨 论
NAFLD是最常见的慢性肝病,与腹型肥胖、血脂异常、胰岛素抵抗等代谢危险因素密切相关[8-9]。近年来,NAFLD的发病率呈上升趋势,但发病年龄呈下降趋势[8]。然而,NAFLD的确切发病机制仍未完全阐明,目前也没有明确的药物途径来调节肝脏脂肪变性,降低胰岛素抵抗,改善脂肪肝[10]。
由于胰岛素抵抗,胰岛素升高通过与胰岛素受体结合,促进IRβ亚基(IRβ)和IR底物-1 (IRS-1)的磷酸化,并通过PI3K-Akt激活下游信号通路,从而调节血糖摄取和储存[3]。C-Jun N末端激酶(JNK包括JNK1、JNK2和JNK3亚型)与胰岛素抵抗相关,研究认为JNK1、JNK2在高脂饮食喂养小鼠中介导胰岛素抵抗,JNK可被炎性细胞因子和FFA激活,激活的JNK会使其下游的靶点IRS-1的丝氨酸307位点磷酸化,从而减弱胰岛素敏感性[11]。研究[12]显示,JNK激活能够上调细胞中自噬相关基因Beclin-1和微管相关蛋白1A/1B轻链3 (LC-3)Ⅱ的表达水平,而SP600125(JNK的抑制剂)或JNK的敲低逆转了这一过程。
虽然以往的研究已经证实JNK、自噬和胰岛素抵抗是相关的[13],但JNK在异常自噬和胰岛素抵抗在NAFLD发病机制中的作用尚未阐明。本研究假设JNK信号通路可能是HFD诱导的胰岛素抵抗及自噬功能的关键调节因子。研究[14]表明,胰岛素抵抗与NAFLD的病理进展密切相关,而JNK是胰岛素信号通路中的关键分子。研究[15]表明,TNF-α、FFA和活性氧激活JNK,从而促进胰岛素抵抗的发生和进展。在本研究中,在高脂饮食喂养的肥胖大鼠中,JNK活性在胰岛素敏感组织(如肝脏和脂肪)中显著增加。激活的JNK使IRS-1的丝氨酸残基磷酸化,从而导致胰岛素抵抗。此外, JNK1已经被报道作为一个关键的分子连接肥胖、炎症和葡萄糖稳态紊乱[16]。Ozcan等[17]报道肥胖诱导的内质网应激可能通过JNK的过度激活导致胰岛素受体信号通路的抑制。越来越多的证据表明JNK可能被认为是治疗胰岛素抵抗和糖尿病的一个潜在的治疗靶点[18]。因此,阐明JNK引发胰岛素抵抗并导致NAFLD的确切机制非常必要。为了探讨这种复杂的发病机制,本研究测定了喂食ND或HFD的大鼠肌肉、脂肪和肝脏组织中的JNK活性,结果显示JNK在HFD大鼠中被激活。
此外,Western blot分析表明,高脂饮食诱导大鼠肝脏发生自噬、IRS-1和Akt的磷酸化。自噬功能障碍可能导致肝脏内脂质过度积累,从而促进NAFLD的发生和进展。自噬相关基因表达、自噬小体的蛋白水平在肥胖脂肪组织和胰岛素抵抗中被证明显著增加[19]。本研究表明,在HFD喂养的大鼠中,IRS-1的丝氨酸307位点被过度磷酸化,同时p-Akt (Ser473)增加。此外,在高脂饮食大鼠肝脏中观察到激活的自噬相关基因LC-3 Ⅱ、Beclin-1、Atg 5、Atg 3高表达。可以推测,JNK介导的自噬通路在胰岛素抵抗中具有重要作用。这些结果可能为NAFLD的潜在治疗提供一定依据。
JNK可以调节细胞的自噬,以应对各种应激。Shimizu等[7]证明了灭活的JNK可以抑制自噬细胞死亡。此外,有研究[20]发现抑制JNK显著抑制了H-ras介导的Atg 5诱导、自噬和细胞死亡。本研究结果表明,SP600125对JNK有抑制作用,降低了高脂饮食大鼠肝脏的自噬相关基因的表达,并降低了胰岛素及游离脂肪酸水平,预防了胰岛素抵抗。但SP600125抑制HFD喂养大鼠肝脏自噬和改善胰岛素抵抗的分子机制尚不清楚。
总之,本研究证明JNK介导的自噬与胰岛素抵抗有关,但还需要进一步的实验来探索p-JNK干扰自噬相关基因表达并导致胰岛素抵抗的分子机制。本研究也表明肥胖与JNK1活性异常升高密切相关,选择性下调JNK活性为治疗人类肥胖、胰岛素抵抗、2型糖尿病和NAFLD提供了一个有力的依据。JNK可能被认为是预防和治疗NAFLD的潜在药物靶点。

