胸背向超重及超重旋转复合暴露对家兔肺损伤的病理学观察
任 逸, 李富柱, 孙 浩, 尚世龙, 肖艳华, 祝 郁,王健全, 郭玉琴, 马红磊∗
(1.江苏大学机械工程学院, 镇江 212013; 2.中国航天员科研训练中心, 北京 100094)
1 引言
在航空机动飞行过程中常常伴随超重、侧翻、旋转等多种失速机动动作,这种复合动力学环境与人体血液动力学变化及前庭反应密切相关,极易引起组织脏器损伤及空间运动病的发生[1-3]。如何有效评估复合动力学环境暴露对机体的影响是目前航天医学领域的一项重要研究课题。
已有研究表明,肺脏是胸背向过载(±Gx)造成机体损伤的主要靶器官,其特殊的弹性体结构使内部气体、血液及组织分布极易受到过载的影响[4-6]。 Ax 等[7]、Rohdin 等[8]研究发现,胸背向过载引起胸膜压力梯度的变化与肺泡形态及分布、肺毛细血管阻力及静态肺容积等因素直接相关,易诱发肺部血流与通气的异质性改变,进而导致肺损伤。 此外,Melek 等[9]及Johar 等[10]也分别利用转椅、转床等设备研究评估了旋转暴露对人体心肺功能及结构的影响机制。 超重旋转复合环境作为机动飞行过程中极为常见的力学环境,却鲜有相关的研究与分析,该种复合环境对人体的影响机制及程度目前尚不明确。 因此,研究分析超重旋转复合力学环境对人体的作用机制,有助于丰富航天生理学基础理论,并据此制定针对性的防护对策,进而提高乘员的安全性及飞行效率。
本文利用超重旋转复合实验平台,选取家兔作为实验对象,模拟单一超重及超重旋转复合环境,通过观察加载暴露后肺脏的病理变化及半定量评估,综合分析各力学环境对于机体肺脏的损伤特点与可能机制,为复合环境下人体病理生理响应机制提供实验依据。
2 方法
2.1 实验动物
为避免雌性激素对实验结果产生影响,实验动物选取成年雄性家兔,体重2.5 ~3 kg,体长约30 cm,无人畜共患病,不携带B 病毒和结核杆菌等致病因子。 动物由北京芳元缘养殖场提供,在常规饲养期间,保持室温25 ℃左右及良好的湿度和通风条件,实验人员定时投放食物和水,喂养条件保持一致。 本文研究中涉及动物实验程序均经中国航天员科研训练中心伦理委员会批准。
2.2 实验设备
以中国航天员科研训练中心自研的超重旋转复合实验平台为基础,实验样机如图1 所示,该设备包括底座部分(离心电机、减速器、支撑台架及传动结构等)、旋转支架(转臂、平衡臂及配重块等)、自转座椅部分(自转电机、传动链条、连接框架、座椅及蓄电池等)、控制柜(可编程运动控制器、控制单元及功率单元等)。 离心半径为1.8 m,最大输出过载20 G,自转座椅最大转速100 r/min。 超重暴露通过离心机旋转实现,自转暴露通过自转座椅实现,二者控制系统独立。 正式实验前,按照实验过载要求和实验程序进行预实验,确保输出过载与实验设计过载环境保持良好的一致性。

图1 超重旋转复合实验平台样机Fig.1 Prototype of integrated overload and rotation test platform
2.3 实验设计及分组
根据前期预实验结果发现,过载曲线峰值达到13 G 时,家兔会出现较重的生理反应,甚至引起重要脏器的损伤;同时发现复合10 r/min、20 r/min 水平自转也分别加重了上述现象。 因此,本实验选用Apollo 返回舱的实际再入参数,并在其基础上进行标准化处理,使过载峰值达到13 G,如图2 所示。 该曲线总加载时长约405 s,第一、二峰值分别达到13 G、9 G(为便于表述,后文选取第一峰值作为特征表述,即13 G 超重暴露),且中间存在较长时间中低量级的超重过载,有利于提高实验动物存活率。
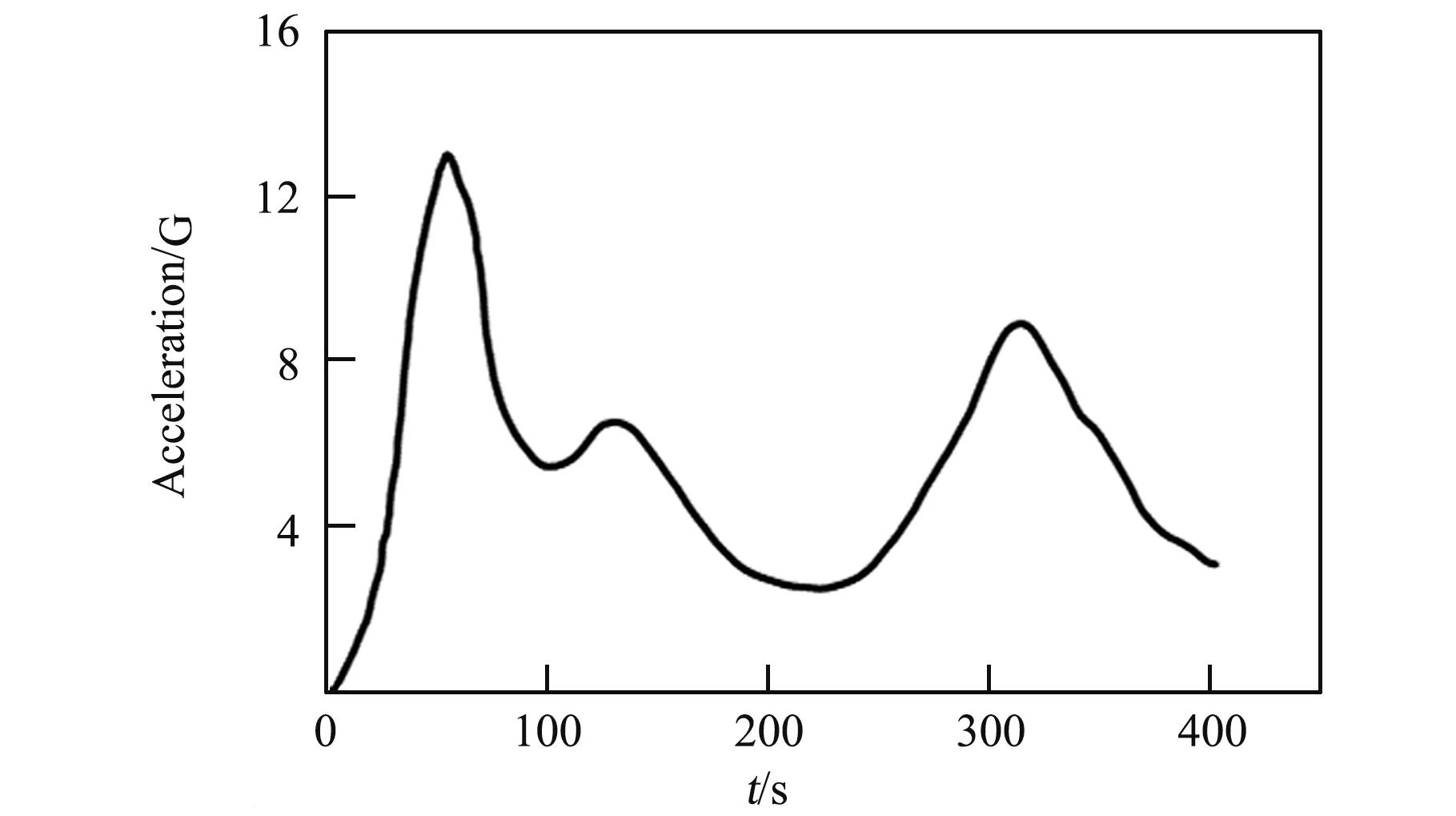
图2 超重过载曲线Fig.2 Overload curve
本文研究选取成年雄性家兔共21 只,随机分为3 组,每组7 只:对照组(Control Group,CG组)、实验组1(Experimental Group1,EG1 组)、实验组2(Experimental Group 2,EG2)。 其中,CG 组为13 G 超重暴露,EG1 组为13 G 超重复合10 r/min 自转暴露,EG2 组为13 G 超重复合20 r/min 自转暴露。
2.4 实验方法
实验开始前,将家兔放置到特制的兔笼中并固定到离心机末端的自转座椅上,使其保持坐姿并面朝离心机旋转中心,保证良好及一致的束缚状态后,按照设计顺序开始实验。 CG 组家兔实验中,启动离心机并使自转座椅电机保持抱闸状态,确保超重过程中家兔无自转运动,且家兔的超重作用方向始终为胸背向。 EG1、EG2 组家兔实验中,家兔的初始方向均面朝离心机轴心,其旋转轴线为头-尾方向连线,设置好参数后同时启动离心机与自转座椅。 实验结束后,立即取下家兔并进行大体解剖观察。
2.5 肺脏损伤程度判定
选用2 种创伤评分学方法对肺脏损伤进行半定量评估: ①简明损伤分级(Abbreviated Injury Scaling, AIS)[11],肺损伤的AIS 分值范围为0 ~6分; ②肺器官损伤分级(Organ Injury Scaling,OIS)[12-13],将肺损伤程度分为I~Ⅵ共6 个级别。
2.6 病理学观察
解剖观察后留取离体左肺下叶组织,分别经4%多聚甲醛灌注固定、流水冲洗、10%中性甲醛固定及常规冲洗后,用梯度乙醇脱水,并于二甲苯中进行透明(共2 次),然后进行石蜡包埋并用石蜡切片机进行连续切片,切片厚度为3 μm,将其贴于多聚赖氨酸处理过的载玻片上;在分别进行脱蜡、水化、苏木精-伊红染色、脱水、透明、封片等处理后,置于光学显微镜下观察。
2.7 统计分析
研究结果的计量数据以平均值±标准差的形式表示,采用SPSS 18.0 软件进行单因素方差分析的统计学方法,P<0.05 认为差异具有统计学意义。
3 结果
3.1 总体实验结果及大体解剖观察
CG 组家兔实验后均存活;EG1 组家兔实验后有2 例死亡,死亡率约为29%(2/7);EG2 组家兔实验后有3 例死亡,死亡率约为43%(3/7)。实验结束后大部分家兔表现出精神萎靡、呼吸短促、行动迟缓等行为学状态。
大体解剖结果显示,各组家兔实验后未出现明显的肺表面撕裂伤,无血气胸,但存在不同程度的点片状出血、水肿与塌陷现象。 CG 组家兔肺损伤主要表现为弥散的出血点与出血斑,偶见水肿及轻微糜烂,1 例左肺下叶存在明显的肋间压痕;EG1 组家兔肺部损伤主要表现为大面积斑片状出血及淤血,出血位置有一定程度向肺叶边缘转移的趋势,1 例出血严重发生实变;EG2 组家兔双肺大面积出血,肺形态较前两组萎陷更明显,且出血位置表现出更明显向肺叶边缘转移的趋势。
3.2 肺损伤评分
根据AIS 及OIS 分别对各组家兔肺脏损伤程度进行分级和评分,结果见表1。 CG 组家兔肺损伤OIS 定级集中在Ⅰ~Ⅲ级,其中Ⅰ级居多(43%); EG1、 EG2 组 肺 损 伤 均 集 中 在Ⅳ级(43%、57%)。
根据AIS 评分规则,CG、EG1、EG2 组家兔肺损伤的AIS 评分分别为2.29±0.88、4.14±0.90、4.71±0.70。 组间方差分析显示,CG 组与EG1、EG2 组间均具有显著性差异(P=0.003、P<0.001),EG1 与EG2 组间无显著性差异(P=0.223)。
3.3 光镜下病理
各组实验后,家兔肺组织在光镜下表现为不同程度的肺不张、出血、肺泡水肿及炎性细胞浸润等。 其中,CG 组家兔主要表现为局部肺组织间质、肺泡及支气管内出血,部分肺泡发生塌陷、叠压、肺泡腔消失等,有炎性细胞聚集,如图3(a)所示。 EG1 组出血面积更大,肺组织及肺泡内充满大量红细胞,局部肺泡隔结构消失,肺泡变大且数目变少,如图3(b)所示;呼吸性细支气管内有溶血,肺不张更严重。 EG2 组家兔肺组织镜下表现为高度肺不张,视野内有大片红色实变区,肺泡壁增厚且出现空隙或透明层,肺泡中细胞分布散乱,肺泡囊中有溶血,局部发生弥漫性肺损伤如图3(c)所示。
4 讨论
现代高性能战斗机具有高过载、高角加速度及高认知负荷等特点,如机动飞行或超机动飞行场景下常常涉及超重、旋转、横滚等动力学复合环境暴露,极易引起航空人员血液动力学特性变化及前庭功能稳定性发生改变,对机体的身体素质及耐受性带来巨大挑战的同时,也对地面模拟实验平台提出了更高的要求[14-15]。 本文使用的超重旋转复合实验平台,该设备搭建了2 套独立的运动控制系统,分别控制转臂离心转动及末端座椅自转运动,可实现超重/旋转/超重旋转复合等环境模拟,且控制系统便捷稳定,运行可靠,可以有效支撑超重、旋转、超重旋转复合等模拟实验。本课题组通过前期预实验发现峰值为13 G 的超重加载会对生物体肺脏造成明显的病理性变化,实验结果与预期基本一致。
本文研究结果显示,家兔肺脏解剖观察的OIS 定级与AIS 评分基本一致,超重旋转复合组家兔的肺脏损伤明显高于单一超重组,且随着自转速度加快,肺脏的损伤程度也在增加。 结合光镜下病理表现,各组均可见不同程度的出血,超重旋转组家兔出血面积更大,且表现出更明显的结构性损伤,包括高度肺不张、肺泡壁断裂、肺实变等。 正常的肺结构与功能极大程度上取决于肺部血流与通气的匹配性[7],Johson 等[16]研究发现,超重暴露会引起肺脏局部气道关闭及重力依赖区肺泡缺氧导致血管收缩、血管阻力增加,加剧肺部血流灌注与气体交换的异质性变化进而诱发肺损伤。 此外,Bogle 等[17]及Miyamura 等[18]研究发现,前庭系统的刺激会通过中枢命令(大脑皮层和下丘脑)及外周反射(肌肉代谢反射)调节心血管功能,尤其是水平半规管及垂直半规管的激活会分别诱发通气反应及心率的增加。 这为超重旋转组家兔肺脏损伤加重提供了一种理论解释,即可能是由于旋转环境进一步刺激了家兔的前庭系统,加剧了肺脏的血液灌注及气体交换的区域性不匹配变化。
超重环境下姿态差异对机体肺脏的损伤表现也存在明显的影响,该种差异主要来自静水压力梯度及胸膜压力梯度的变化[19-20]。 超重旋转组家兔实验过程中,由于过载方向始终在改变,其胸膜压力梯度也不断变化,肺泡始终处于正压与负压来回切换状态,加剧了其分布及形态的不均匀性,进而引发更严重的结构性损伤。 Johnson等[16]研究提出,胸膜压力梯度与功能剩余容量(Functional Residual Capacity,FRC)直接相关,将直接影响吸气时的通气分布,这可能也是超重旋转组家兔肺脏损伤加重的原因之一。
此外,Glenny 等[21]在探究重力因素对肺部血流分布影响时指出,一氧化氮酶在肺血流引导中发挥了关键作用,且在人体背侧肺组织中表达程度更高;Kerckx 等[22]也提出超重环境会引起肺泡一氧化氮浓度的增加,这种变化与肺部血流的区域性灌注密切相关。 在本文研究中,单一超重组家兔实验过程中背侧肺组织始终受压,但该种压迫是否直接影响一氧化氮酶的表达及肺泡一氧化氮浓度,目前尚不清楚。
另外,本文研究中选取的样本较小,这可能是造成个别组AIS 评分差异性不显著的原因之一。前庭刺激及一氧化氮浓度对肺脏损伤的影响程度及机制,仍需要后续开展进一步的研究分析。
5 结论
1)超重旋转复合实验平台可有效模拟超重旋转复合环境,模型构建准确可靠。
2)超重暴露与超重旋转复合暴露均会对家兔肺脏的正常结构及功能造成影响,复合暴露加载下影响更明显,且随着复合自转水平升高,损伤会逐步加重。

