单胃动物微量矿物元素铁、铜、锰、锌吸收机制研究进展
徐伟伟,殷运菊,闫昭明,唐小懿,陈清华*
(1. 湖南农业大学动物科学技术学院,湖南 长沙 410125;2. 湖南百宜饲料科技有限公司,湖南 浏阳 410300)
微量矿物元素在动物机体中占比小于0.01%,在动物生长、发育、繁殖以及代谢中起到不可替代作用[1]。微量矿物元素以来源分为有机与无机2类。有机微量元素最早一般指葡萄糖酸锌、富马酸亚铁等有机酸类,随着技术发展,后来出现金属氨基酸螯(络)合物、金属蛋白盐及多糖复合物等[2],也有以酵母硒等为代表的酵母型微量元素[3]。无机微量元素的发展经历无机盐时代和无机盐包被时代,无机微量元素在畜禽养殖中的应用较为广泛,其优势在于利用方便,价格低廉,但其缺点也暴露无疑,畜禽养殖中,无机微量元素添加量往往远大于NRC推荐量,这使得畜禽粪便中铜、铁、锌、锰等金属元素超标,农田长期大量使用这些畜禽粪便,会使其在土壤富集,使土壤板结、破坏土壤微生物组成、影响作物产量和养分吸收,最终还可能通过食物链传递作用对人类健康造成危害[4-6]。
1 微量矿物元素离子吸收机制探究
微量元素进入消化系统后被胃肠道上皮细胞吸收,进入血液后才能供组织细胞利用,进入胃肠道的微量元素主要被小肠吸收,部分可以被胃和其他肠段吸收。
1.1 Cu的吸收代谢机制
Cu在动物机体中承担着合成血红蛋白和激活机体正常代谢及发育所需多种相关酶的合成。Cu2+的吸收大都发生在小肠,当Cu2+穿过肠腔进入门静脉循环系统,随血液运输至肝脏,肝脏是分配机体Cu2+利用与代谢的重要枢纽,一部分Cu2+在肝脏中会被动员至外周组织,另一部分则会被分泌到胆汁中排泄至体外[7]。在肠道粘膜细胞外侧存在Reductase蛋白,可将Cu2+还原为Cu+,小肠黏膜上皮细胞中的特异性铜转移蛋白(copper transport protein 1,Ctr1)对Cu+有高亲和力,将Cu+转运至小肠上皮细胞内,Cu+会与铜依赖性酶结合或通过Cu+转运P型蛋白ATPase ATP7A从细胞膜外侧转运在血液中[8]。Cu通过门静脉转运至肝脏,再通过体循环和未知蛋白转运至外周组织,过量的铜会通过胆汁排出体外。
研究表明,在猪肠道上皮细胞模型中,添加30 μmol/L和120 μmol/L铜蛋白螯合物可以显著提高超氧化物歧化酶1(superoxide dismutase 1,SOD1)蛋白表达水平,相反30 μmol/L和、120 μmol/L硫酸铜处理会使细胞内丙二醛含量显著升高,并显著下调ATP7A基因表达量,在120 μmol/L甘氨酸螯合铜处理下ASCT2基因表达显著上调,表示氨基酸转运增多[9]。
1.2 Fe的吸收代谢机制
Fe元素对于动物机体各类细胞及蛋白质合成都有重要意义,其中包括氧转移蛋白、血红蛋白及参与电子转移的氧化还原酶[10]。以上物质均为动物机体生长发育代谢所必需的,缺Fe会导致动物机体发生缺铁性贫血,相反,机体内游离的Fe元素过多会导致机体发生疾病,例如肝损伤、肝硬化、纤维化及 肠道炎症[11]。
在解剖学上,Fe主要在十二指肠绒毛的上半部分肠上皮细胞中吸收[12]。饲料中的Fe主要以不易溶解的Fe3+的形式存在,在转运前通过Fe还原蛋白细胞色素氧化酶(duodenal cytochrome b,DCYTB)还原为溶解度更高的Fe2+形式,还原后的Fe2+主要通过二价金属离子转运体(divalent metal-ion transporter-1,DMT1)转运至细胞内,当机体内Fe元素充足时,多余的Fe元素会通过铁转运蛋白(ferroportin-1,FPN1)排出细胞外[13-15]。排出后的Fe2+会被铁调素(hepcidin,HEPC)氧化为Fe3+,FPN1与膜铁转运辅助蛋白(recombinant,hephaestin,HEPH)参与这一过程,共同调节铁元素的排出[16-17]。Shawki等[18]研究发现,通过将小鼠肠道中二价金属离子转运体(divalent metal-ion transporter-1,DMT1)转运蛋白表达基因静默后研究其对机体Fe运输的重要性,通过这一试验发现,敲除DMT1转运蛋白的小鼠表现出严重的小细胞低色素性贫血、心脏以及脾脏肿大,血铁及组织非血红素铁储存减少,而二价锰、锌等离子并未减少,这揭示了DMT1可能是机体内转运Fe元素的主要转运蛋白。同样,也有试验证明,饲料中的Fe主要以不易溶解的Fe3+的形式存在,在转运前通过Fe还原蛋白细胞色素氧化酶(duodenal cytochrome b,DCYTB)还原为溶解度更高的Fe2+形式,还原后的Fe2+主要通过二价金属离子转运体(divalent metal-ion transporter-1,DMT1)转运至细胞内,这也印证了DMT1对Fe2+运输的重要性。当机体内Fe元素充足时,多余的Fe元素会通过铁转运蛋白(ferroportin-1,FPN1)排出细胞外[13-15]。排出后的Fe2+会被铁调素(hepcidin,HEPC)氧化为Fe3+,FPN1与膜铁转运辅助蛋白(recombinant,hephaestin,HEPH)参与这一过程,共同调节铁元素的排出[16-17]。
哺乳动物对于过量Fe元素的排泄并未有清晰的生理机制,机体中Fe元素的排出可通过黏膜细胞的脱落和失血等方式排出,动物机体全身的铁稳态主要通过调节小肠对铁元素的转运实现[19]。目前所知动物机体唯一排泄铁的转运蛋白是铁转运蛋白(ferroportin,FPN),发挥作用时受肝素的调节,在维持机体铁平衡中起关键作用,当畜禽机体FPN基因表达异常时,会导致机体铁积累过量,从而造成机体损伤[20-21]。
1.3 Mn的吸收代谢机制
Mn元素对于动物生长有重要作用,在细胞生长、神经发育、免疫及抗氧化等过程中起关键作用[22]。Mn元素在动物饮食中存在形式主要是Mn2+,Mn2+在小肠中的吸收转运机制尚未完全清晰。目前已知Mn2+转运蛋白主要有ZIP8(SLC39A8)、ZIP14(SLC39A14)和ZNT10(SLC30A10),动物机体Mn稳态主要依靠肠、肝中存在的以上3种转运体[22]。ZIP家族转运体蛋白控制金属离子从细胞外液转转入细胞的细胞质,ZNT家族转运蛋白则控制金属离子从细胞内转运至细胞外,这两类转运体蛋白广泛存在于动物机体的肠道和肝脏中[23]。前人的研究表明,ZIP8基因编码的蛋白质能够转运Zn2+、Fe2+、Mn2+等多种二价阳离子[24-26]。试验人员将小鼠ZIP8基因敲除,小鼠肝、脑、肾、心等多脏器中锰含量显著降低,并在相关细胞培养试验中,ZIP8-I-KO小鼠细胞组织的铁和锌水平与对照组相比并无差异,这揭示了ZIP8的主要功能是调节锰的吸收代谢[27]。ZIP14转运蛋白可以转运包括锌、铁和锰在内的多种金属离子进入细胞。ZIP14基因在肝脏中表达最高,在控制全身锰稳态中起到关键作用,有研究者证明,缺乏ZIP14基因,会阻碍肝脏对锰的吸收以及通过胆管排泄这一过程,进而导致锰在血液及肝外组织中积累,造成机体高锰[28-29]。ZNT10是动物机体中重要的Mn排泄转运蛋白,研究人员发现,缺乏ZNT10转运蛋白的斑马鱼体内锰含量显著增加,而机体铁和锌的水平与对照组相比无显著差异[30]。也有试验发现,ZNT10敲除小鼠的肝脏、大脑和血液中锰含量显著升高,同样,其体内铁和锌含量与对照组相比,并无显著差异,这揭示了ZNT10转运蛋白在锰的排泄过程中起到关键作用,其为锰排泄的主要通道[31]。还有研究表明,小肠黏膜细胞表面的DMT1蛋白也参与Mn2+的转运,但这一转运方式并不是Mn元素主要转运途径[32]。
1.4 Zn的吸收代谢机制
Zn元素是动植物生长必须的微量元素,在动物体内含量在过度金属中仅次于Fe。Zn与真核细胞中超10%的蛋白质结合[33]。Zn缺乏会导致动物机体生长、免疫及大脑功能受损。过量的Zn可能对细胞有毒害作用,其作用机制可能是Zn与金属蛋白结合,从而抑制蛋白功能。对于动物机体健康而言,Zn稳态主要是通过调节胃肠道对Zn的吸收及排泄来实现[34]。
Zn以二价阳离子形式存在时,在细胞膜转运过程中不需要历经氧化还原反应,其转运方式与Cu2+、Fe2+相似,锌离子转运蛋白在锌的转运与调控中起关键作用,Zn的吸收与排泄依靠两类锌转运蛋白,锌转运蛋白SLC30A(ZnT)和Zrt-[35]。在目前所发现的锌转运蛋白中,SLC39A(ZIP4)对肠道锌转运贡献最大,当ZIP4基因突变时,会导致机体缺乏锌元素,从而发生肠病性肢端皮炎,表现为毛发脱落和腹泻[33]。将小鼠中ZIP4相关基因敲除后会导致小鼠死亡,饲喂高锌日粮则会延长小鼠寿命,这一现象说明ZIP4在正常饮食下承担了机体大部分Zn的吸收与转运工作,同时也证明,除ZIP4还有可以转运锌离子的转运途径[36]。通常情况下,ZIP家族转运蛋白负责金属从细胞外液或细胞内囊泡转运至细胞的细胞质,然而,ZnT蛋白负责的是将金属从细胞质中转运至细胞外液[37]。
肠上皮细胞吸收的锌有可能是通过ZnT1转运至门静脉,进入血液循环系统。在果蝇中ZnT1直系同源物体ZnT1定位于肠上皮细胞基底外侧膜,这证明ZnT1在锌输出中起关键作用[38]。ZnT1将锌转运至门静脉后,锌与白蛋白和α2-巨球蛋白结合从而转运至外周组织,可通过胞吐等方式脱落排除[39]。
研究发现,不管饲粮中添加蛋氨酸锌还是硫酸锌都会增加蛋鸡小肠、肝脏、十二指肠和空肠中锌元素含量,这表明无论添加何种来源的锌元素都会增加机体吸收。其中肝脏锌元素含量最高、十二指肠锌元素含量最低,这可能是不同器官对锌的转运不同导致[40]。
综上,动物机体无机微量元素Fe、Cu、Mn和Zn的主要吸收部位在肠道,通过肠道黏膜上的各种转运蛋白以及离子通道吸收转运,部分金属离子转运蛋白见表1。
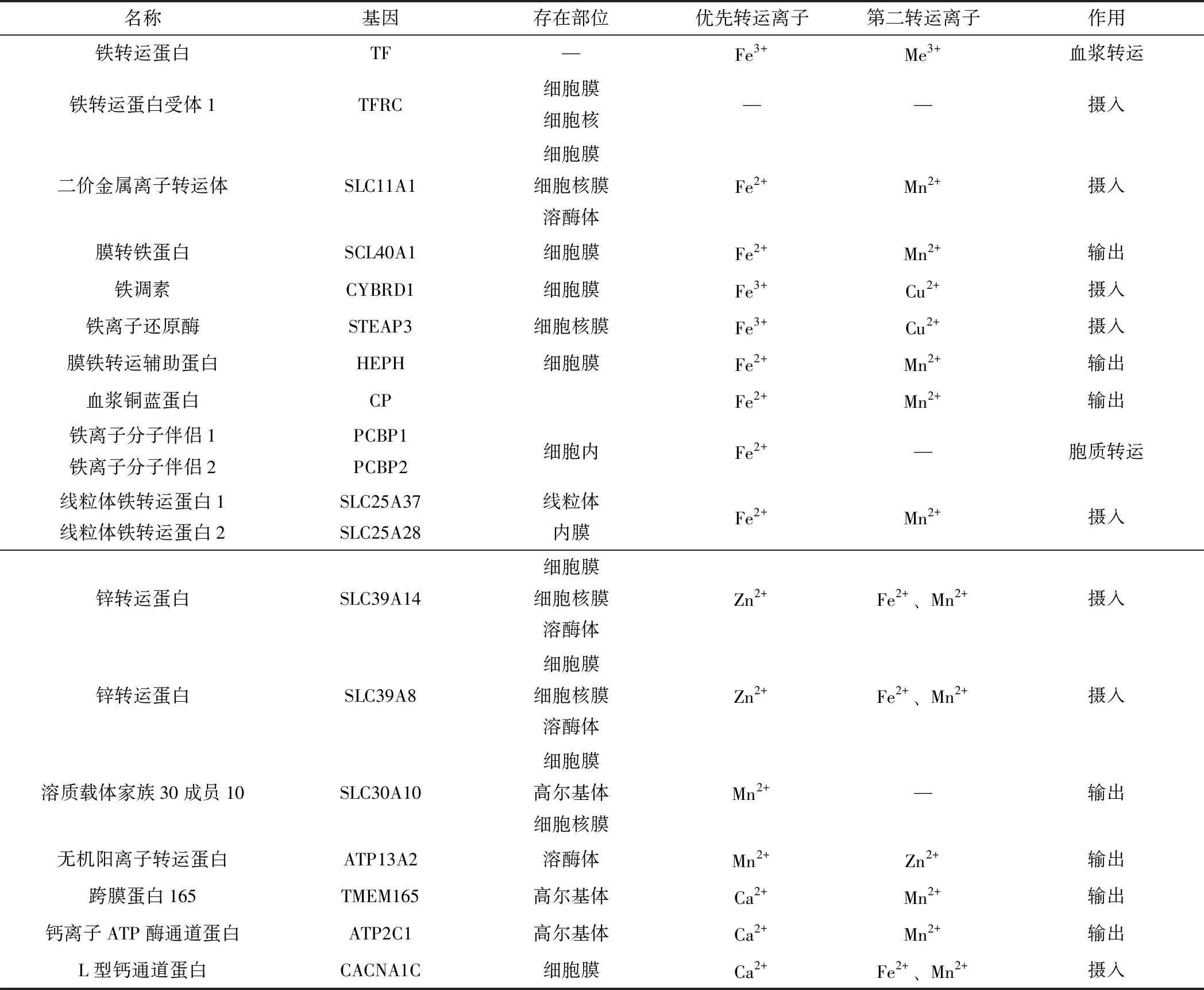
表1 部分金属离子转运蛋白存在部位及主要转运的离子
2 单胃动物机体有机微量矿物元素吸收途径
有机微量元素多以复合物形式存在,金属氨基酸络合物、蛋白螯合盐、有机酸与酵母培养物为主流产品。各种产品其金属离子都通过离子键等方式与载体结合,其结合强度与载体种类及结合方式有显著相关性。
有研究指出,氨基酸螯合微量元素在小肠转运过程中,可完整转运至小肠上皮细胞内,并非利用小肠金属离子转运通道。金属微量元素被螯合物包裹在中心,其金属螯合物可以以整体形式通过氨基酸转运机制或胞吞转运至细胞内[41]。
利用有机铜替代无机铜在猪的应用中表现出更高的利用率和更低的排泄量,提高了猪的生长性能[42]。同时,有学者研究[43]也得出了类似的结果,甘氨酸铜在育肥猪中可以促进机体对铜的吸收,并且可以改善肠道微生物群,减少铜的排泄。有研究表明,有机金属复合物,如蛋白盐可以附着在肠肽转运蛋白(peptide transporter,PepT1)上,PepT1是一种二肽与三肽转运体,PepT1转运体没有过度特异性,除二肽与三肽外还可以转运其它分子,但是现有研究还没有证实PepT1转运体是使有机铜吸收率变高的原因[44]。
也有研究表明,蛋氨酸螯合锌可通过氨基酸转运体转运等其它吸收途径吸收和转运。在蛋鸡饲粮中补充蛋氨酸螯合锌与硫酸锌,结果显示,蛋氨酸螯合锌可以改善肠道健康,提高机体锌的利用率,减少锌排放对环境的污染[45]。当用有机微量矿物元素替代无机微量矿物元素可以改善肉鸡肌肉品质,包括减少滴水损失,改善肉色等[46]。但在另一试验中,添加不同来源的锰对肉鸡小肠氨基酸和小肽的转运蛋白mRNA表达量没有影响,但其DMT1和FPN1相关基因表达量却显著上升,机体吸收猛可能是提高肉鸡十二指肠DMT1表达的原因[47]。Yu等[48]对肉鸡饲喂不同锌源的饲料发现,有机锌的吸收率要远高于无机锌,并且有机锌螯合越紧密其吸收率就越高,这揭示了有机锌其金属离子与配体螯合越紧密其被整体转运至细胞内的可能性就越高。同样,在饲喂不同来源锌时肉鸡也表现出了相同的结果[49]。在用有机微量元素与无机微量元素对比喂养蛋鸡试验中,有机微量元素在一定浓度下表现出对蛋鸡的生产性能有显著提高作用[50]。还有研究表明,利用蛋氨酸螯合有机微量元素复合包替代无机微量元素饲喂肉鸭,按照推荐量的50%添加有机微量元素复合包不影响其生长性能、屠宰性能及免疫性能,并且可以减少粪便中微量元素排泄[51-52]。
3 小结
综上所述,目前关于畜禽机体无机微量元素吸收机制的研究较为清晰,但有机微量元素的研究较少,吸收途径可能存在2种:其一是,进入畜禽肠道后分解为金属离子,并通过离子通道吸收。其二是通过相应配体的吸收通道被小肠直接吸收。有机微量元素在体内的吸收途径更为广泛,其吸收速率要高于单一吸收通道的无机微量元素,这也可能是有机微量元素在畜禽中利用率较高的原因之一。目前对于有机微量元素在畜禽机体中吸收机制的研究尚且存在以下几点问题:1)有机微量元素在畜禽机体内吸收机制尚不完全清晰,还需加强研究;2)有机微量元素在畜禽生产中的添加剂量尚未制定统一标准,需要探究在不同动物中合理的添加量;3)有机微量元素替代无机微量元素对环境污染的改善作用目前还未完全清晰,有待相关研究。

